
所属成套资源:2024年高考化学三轮冲刺考前巩固专题训练
2024年高考化学三轮冲刺考前巩固专题训练27 难溶电解质的溶解平衡及沉淀转化
展开
这是一份2024年高考化学三轮冲刺考前巩固专题训练27 难溶电解质的溶解平衡及沉淀转化,文件包含2024年高考化学三轮冲刺考前巩固专题训练27难溶电解质的溶解平衡及沉淀转化答案docx、2024年高考化学三轮冲刺考前巩固专题训练27难溶电解质的溶解平衡及沉淀转化docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
一、选择题
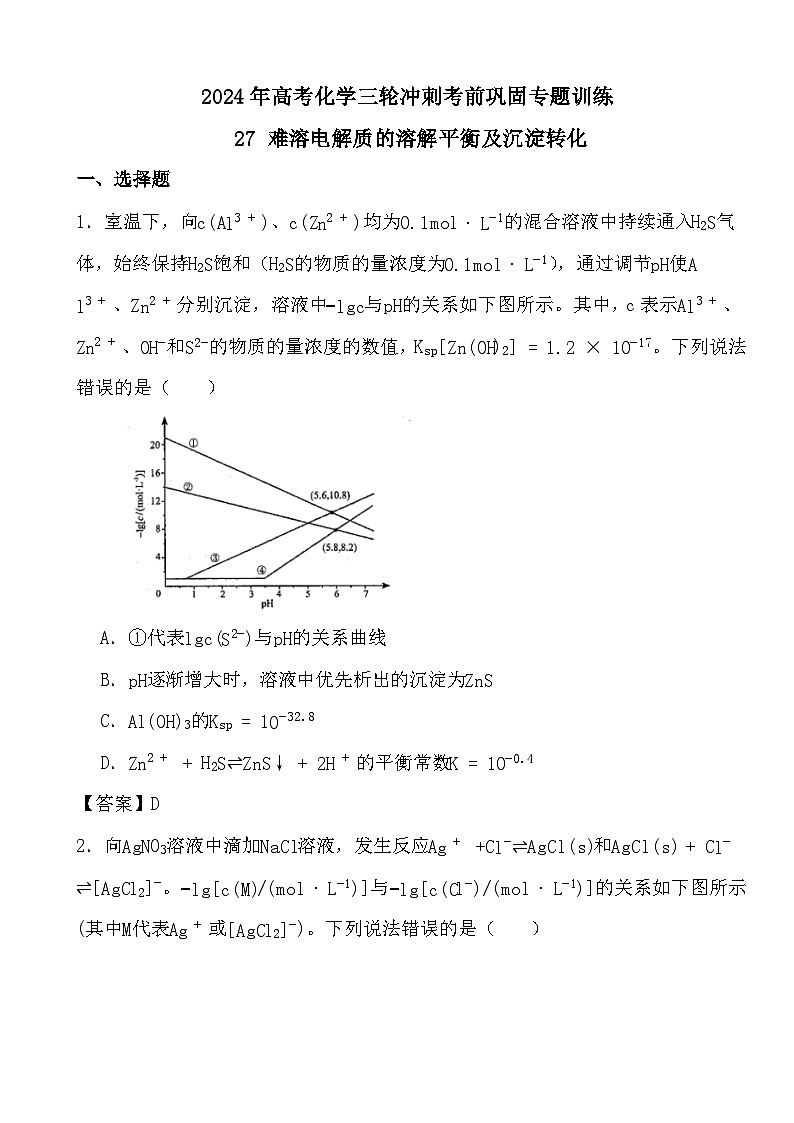
1.室温下,向c(Al3+)、c(Zn2+)均为0.1ml⋅L−1的混合溶液中持续通入H2S气体,始终保持H2S饱和(H2S的物质的量浓度为0.1ml⋅L−1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中−lgc与pH的关系如下图所示。其中,c表示Al3+、Zn2+、OH−和S2−的物质的量浓度的数值,Ksp[Zn(OH)2]=1.2×10−17。下列说法错误的是( )
A.①代表lgc(S2−)与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH)3的Ksp=10−32.8
D.Zn2++H2S⇌ZnS↓+2H+的平衡常数K=10−0.4
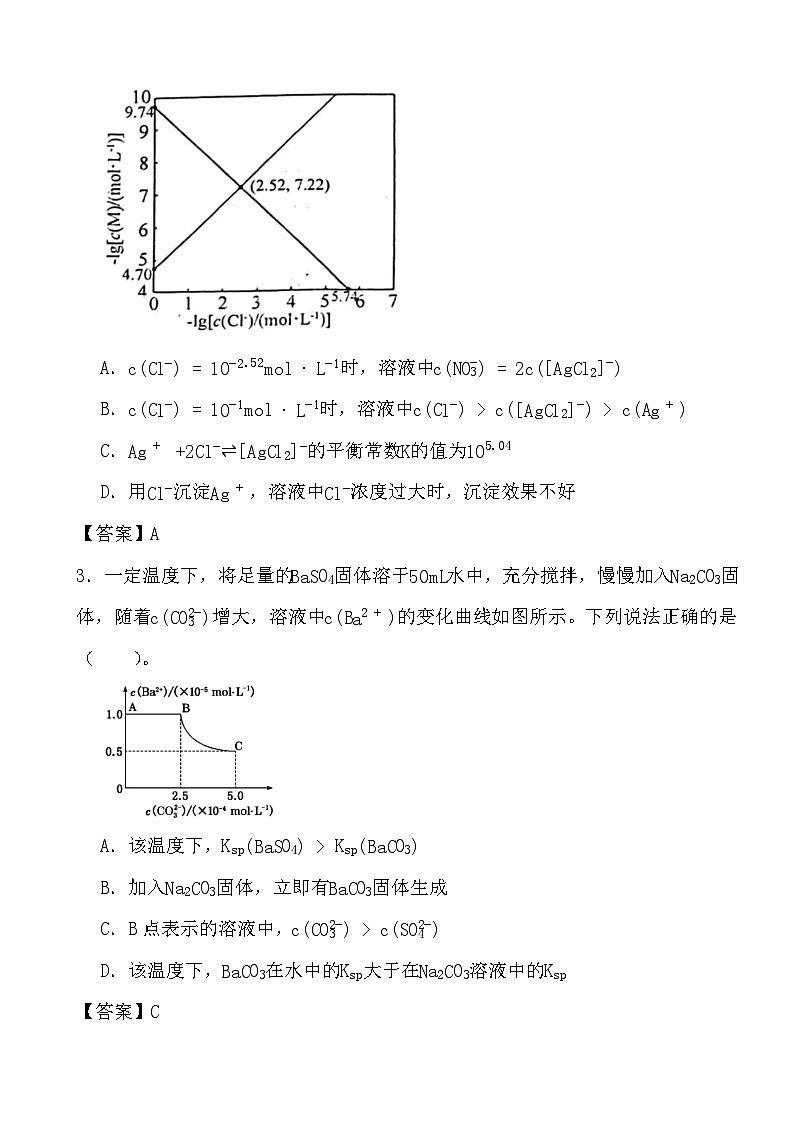
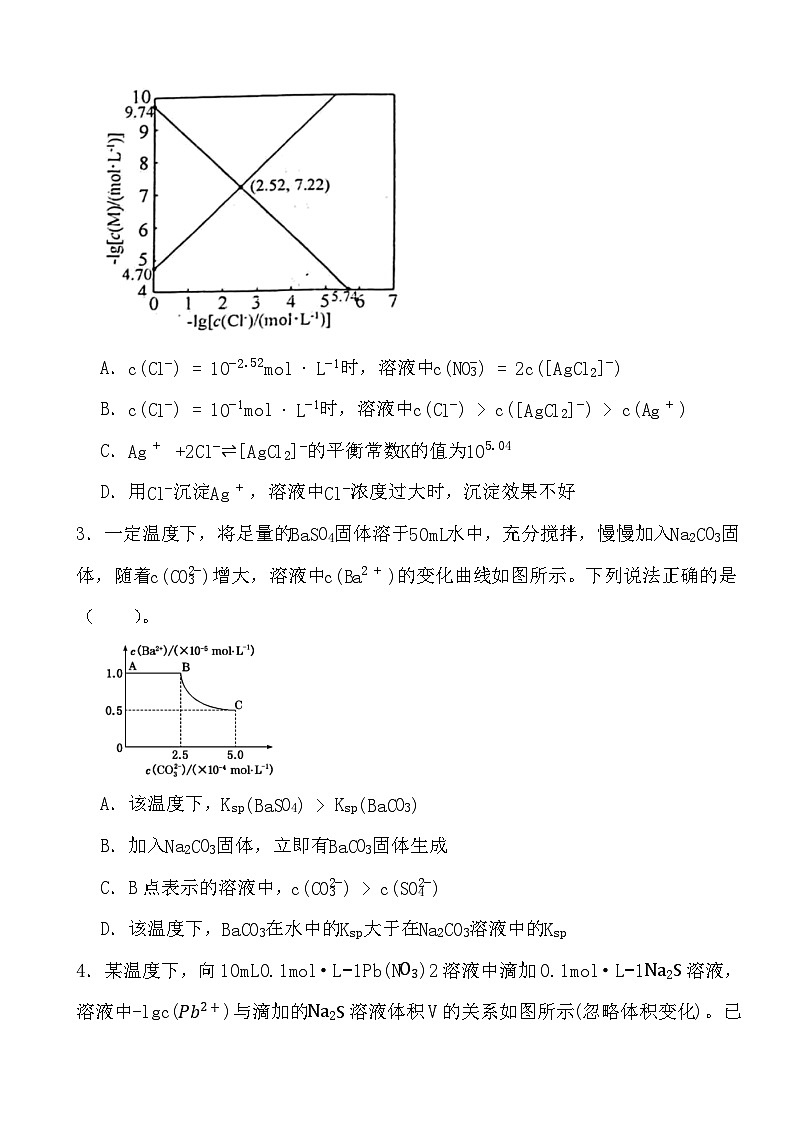
2.向AgNO3溶液中滴加NaCl溶液,发生反应Ag++Cl−⇌AgCl(s)和AgCl(s)+Cl−⇌[AgCl2]−。−lg[c(M)/(ml⋅L−1)]与−lg[c(Cl−)/(ml⋅L−1)]的关系如下图所示(其中M代表Ag+或[AgCl2]−)。下列说法错误的是( )
A.c(Cl−)=10−2.52ml⋅L−1时,溶液中c(NO3−)=2c([AgCl2]−)
B.c(Cl−)=10−1ml⋅L−1时,溶液中c(Cl−)>c([AgCl2]−)>c(Ag+)
C.Ag++2Cl−⇌[AgCl2]−的平衡常数K的值为105.04
D.用Cl−沉淀Ag+,溶液中Cl−浓度过大时,沉淀效果不好
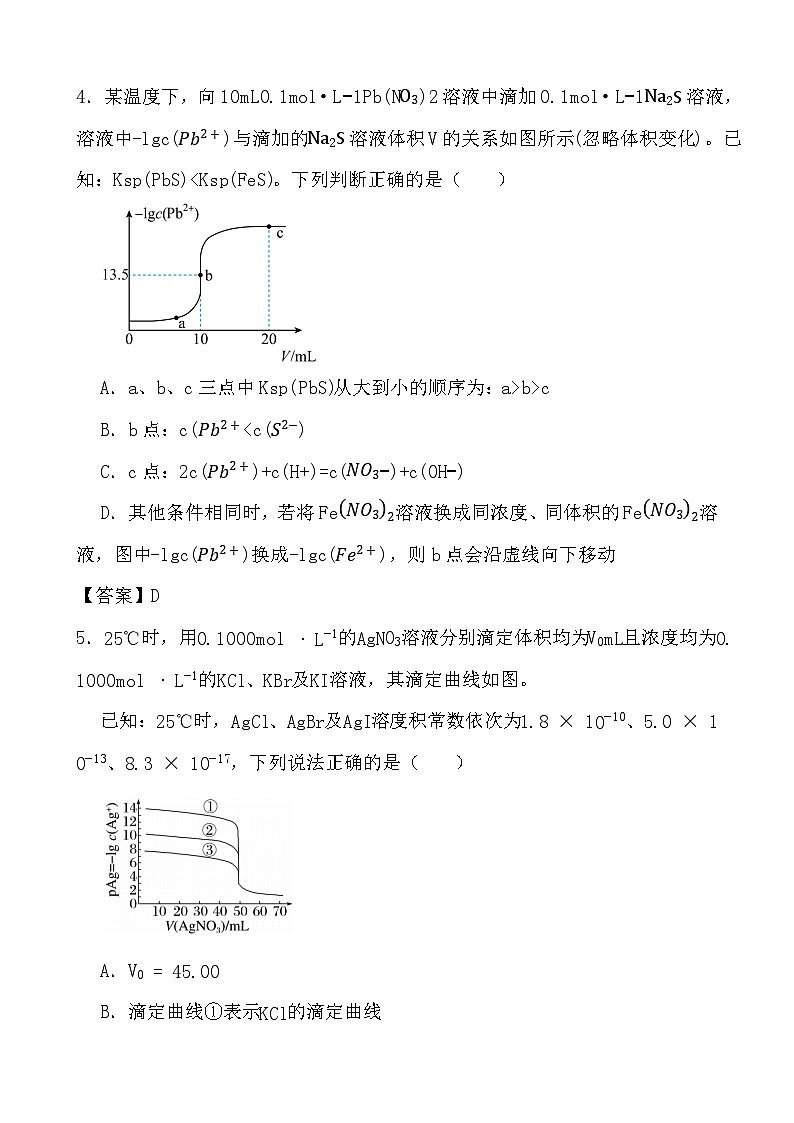
3.一定温度下,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(CO32−)增大,溶液中c(Ba2+)的变化曲线如图所示。下列说法正确的是( )。
A.该温度下,Ksp(BaSO4)>Ksp(BaCO3)
B.加入Na2CO3固体,立即有BaCO3固体生成
C.B点表示的溶液中,c(CO32−)>c(SO42−)
D.该温度下,BaCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
4.某温度下,向10mL0.1ml·L−1Pb(NO3)2溶液中滴加0.1ml·L−1Na2S溶液,溶液中-lgc(Pb2+)与滴加的Na2S溶液体积V的关系如图所示(忽略体积变化)。已知:Ksp(PbS)b>c
B.b点:c(Pb2+ν(溶解)
D.CuS(s)+2Ag+(aq)⇌Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全
20.难溶盐MgF2可溶于盐酸,常温下,用HCl气体调节:MgF2浊液的pH,测得体系中−lgc(F−)或−lgc(Mg2+)随lgc(H+)c(HF)的变化如图所示。下列说法正确的是( )
A.曲线N代表−lgc(F−)随lgc(H+)c(HF)的变化趋势
B.Y点溶液中存在c(Mg2+)=c(HF)
C.氢氟酸的Ka=10−4.4
D.难溶盐MgF2的溶度积Ksp=10−11.6
21.常温下,用HCl(g)调节SrF2浊液的pH,测得在通入HCl(g)的过程中,体系中−lgc(X)(X代表Sr2+或F−)与−lg[c(H+)c(HF)]的关系如图所示。下列说法正确的是( )。
已知:SrF2为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A.Ksp(SrF2)=10−10.2
B.随着HCl的加入,SrF2溶解度逐渐减小
C.p点对应的溶液中c(Sr2+)AgOH
D.反应2AgOH+Zn2+⇌2Ag++Zn(OH)2的平衡常数K=Ksp[Zn(OH)2]Ksp2(AgOH)
23.一定温度下,向含一定浓度金属离子M2+(M2+代表Fe2+、Zn2+和Mn2+)的溶液中通H2S气体至饱和c(H2S)为0.1ml⋅L−1时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的lg[c(M2+)]与pH关系如下图。下列说法不正确的是( )
A.a点所示溶液中,c(H+)>c(Zn2+)
B.该温度下,Ksp(ZnS)c(H+)>c(OH-)
C.若改用0.20ml/LNa2CO3溶液来滴定,则恰好反应点由b移至a
D.若把Na2CO3溶液换成等浓度Na2SO3溶液,则曲线变为Ⅰ
25.一定温度下,向足量的AgBr固体中加入100mL水,充分搅拌,慢慢加入NaCl固体,随着c(Cl−)增大,溶液中c(Ag+)的变化曲线如图所示。下列说法不正确的是( )
A.该温度下Ksp(AgBr)=6.4×10−13
B.从Y点到Z点发生的离子反应为Ag++Cl−=AgCl↓
C.AgBr与AgCl在一定条件下可以相互转化
D.P点溶液中c(Cl−)=625c(Br−)
26.下图为常温下Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM−pH关系图,图中pM=−lg[c(M)/(ml⋅L−1)];[c(M)≤10−5ml⋅L−1可认为M离子沉淀完全]。下列叙述正确的是( )
A.a点时,c(Fe3+)=2.5ml⋅L−1
B.由b点可求得Ksp[Al(OH)3]=10−15
C.浓度均为0.01ml⋅L−1的Al3+和Cu2+可以通过分步沉淀进行分离
D.Cu(OH)2在水中的沉淀溶解平衡可用离子方程式表示为Cu(OH)2=Cu2++2OH−
27.已知相同温度下,Ksp(BaSO4)105说明沉淀转化比较彻底。某温度下,饱和溶液中−lg[c(SO42−)]、−lg[c(CO32−)]与−lg[c(Ba2+)]的关系如图所示。下列说法错误的是( )。
A.图中各点对应的Ksp的关系为Ksp(a)=Ksp(b)=Ksp(c)>Ksp(d)
B.向c点的溶液加适量BaCl2固体,可使溶液变到b点
C.根据曲线数据计算可知Ksp(BaSO4)的数量级为10−10
D.根据曲线数据计算可知加入Na2CO3能使BaSO4比较彻底转化为BaCO3
28.向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3⇌[Ag(NH3)]+和[Ag(NH3)]++NH3⇌[Ag(NH3)2]+,lg[c(M)/(ml⋅L−1)]与lg[c(NH3)/(ml⋅L−1)]的关系如图所示{其中M代表Ag+、Cl−、[Ag(NH3)]+或[Ag(NH3)2]+}.
下列说法正确的是( )
A.曲线Ⅲ表示lgc{[Ag(NH3)2]+}随lgc(NH3)的变化曲线
B.随c(NH3)增大,c(Cl−)c(NH3)先增大后减小
C.反应AgCl+2NH3⇌[Ag(NH3)2]++Cl−的平衡常数为10−5.51
D.完全溶解0.1mlAgCl,至少需要含有(0.2+100.35)mlNH3的氨水
29.T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。
已知:pCd2+=−lgc(Cd2+),pN=−lgc(CO32−)或−lgc(OH−)。下列说法正确的是( )
A.曲线Ⅱ表示Cd(OH)2沉淀溶解平衡曲线
B.Z点对应的溶液中:c(H+)
相关试卷
这是一份2024年高考化学三轮冲刺考前巩固专题训练33 等电子原理,共4页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练28 离子共存答案,共18页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练28 离子共存,文件包含2024年高考化学三轮冲刺考前巩固专题训练28离子共存答案docx、2024年高考化学三轮冲刺考前巩固专题训练28离子共存docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。








