
所属成套资源:2024年高考化学三轮冲刺考前巩固专题训练
2024年高考化学三轮冲刺考前巩固专题训练34 晶体结构
展开
这是一份2024年高考化学三轮冲刺考前巩固专题训练34 晶体结构,文件包含2024年高考化学三轮冲刺考前巩固专题训练34晶体结构答案docx、2024年高考化学三轮冲刺考前巩固专题训练34晶体结构docx等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。
一、选择题
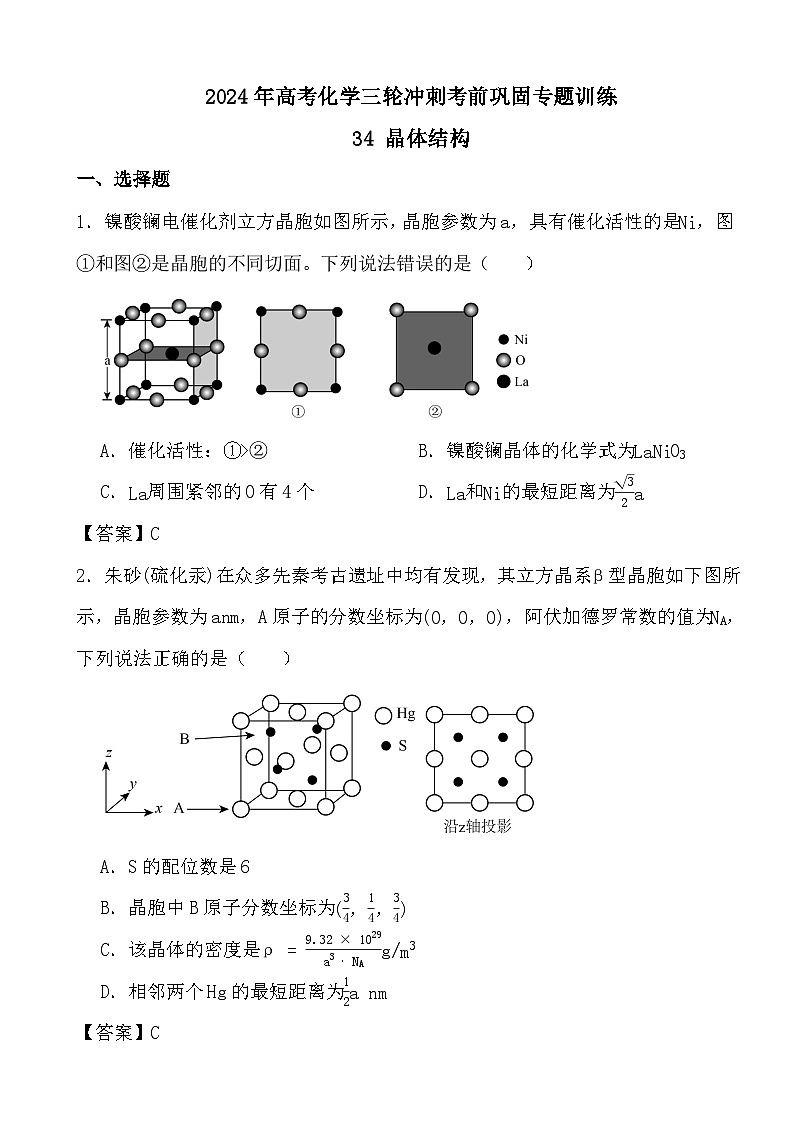
1.镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是Ni,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②B.镍酸镧晶体的化学式为LaNiO3
C.La周围紧邻的O有4个D.La和Ni的最短距离为32a
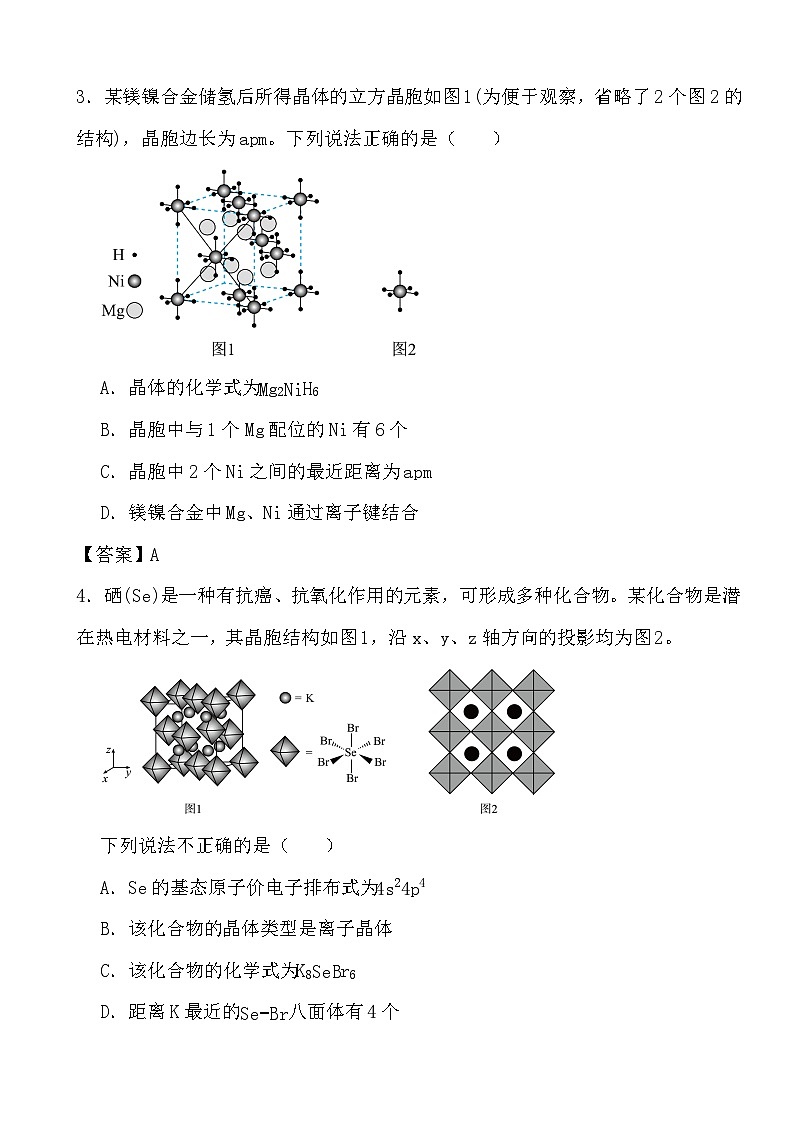
2.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系β型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为(0,0,0),阿伏加德罗常数的值为NA,下列说法正确的是( )
A.S的配位数是6
B.晶胞中B原子分数坐标为(34,14,34)
C.该晶体的密度是ρ=9.32×1029a3⋅NAg/m3
D.相邻两个Hg的最短距离为12a nm
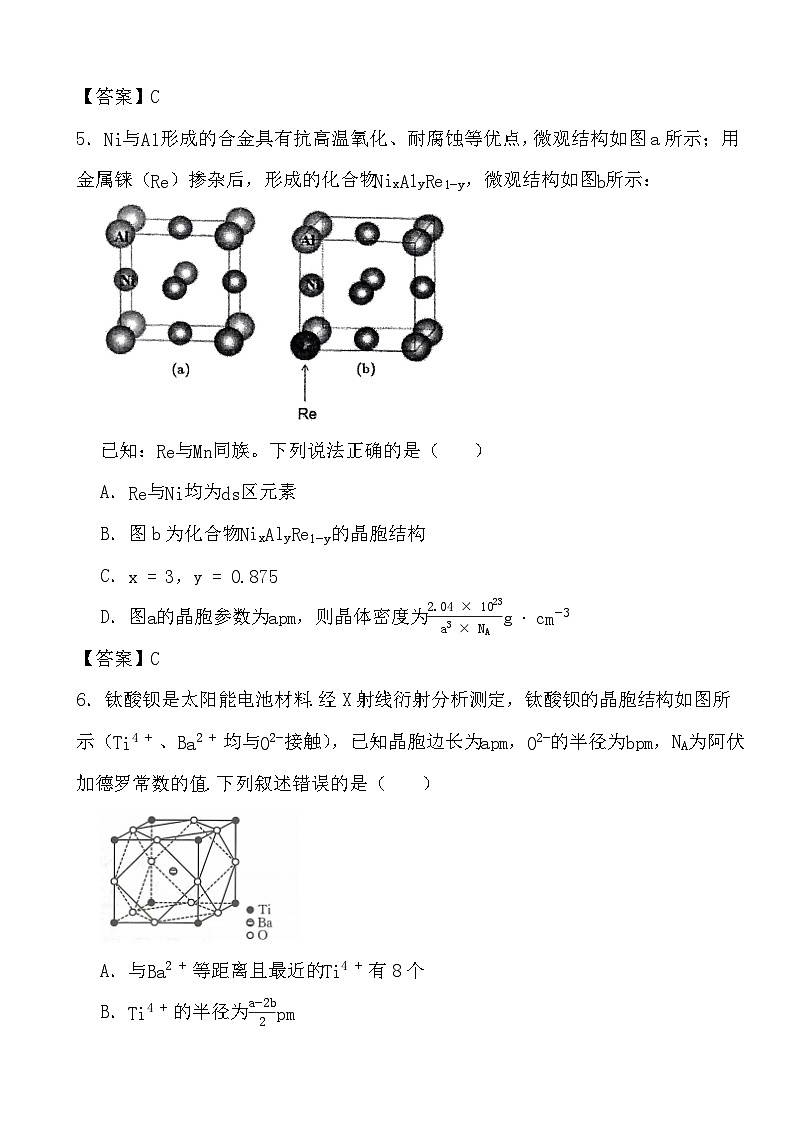
3.某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )
A.晶体的化学式为Mg2NiH6
B.晶胞中与1个Mg配位的Ni有6个
C.晶胞中2个Ni之间的最近距离为apm
D.镁镍合金中Mg、Ni通过离子键结合
4.硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
下列说法不正确的是( )
A.Se的基态原子价电子排布式为4s24p4
B.该化合物的晶体类型是离子晶体
C.该化合物的化学式为K8SeBr6
D.距离K最近的Se−Br八面体有4个
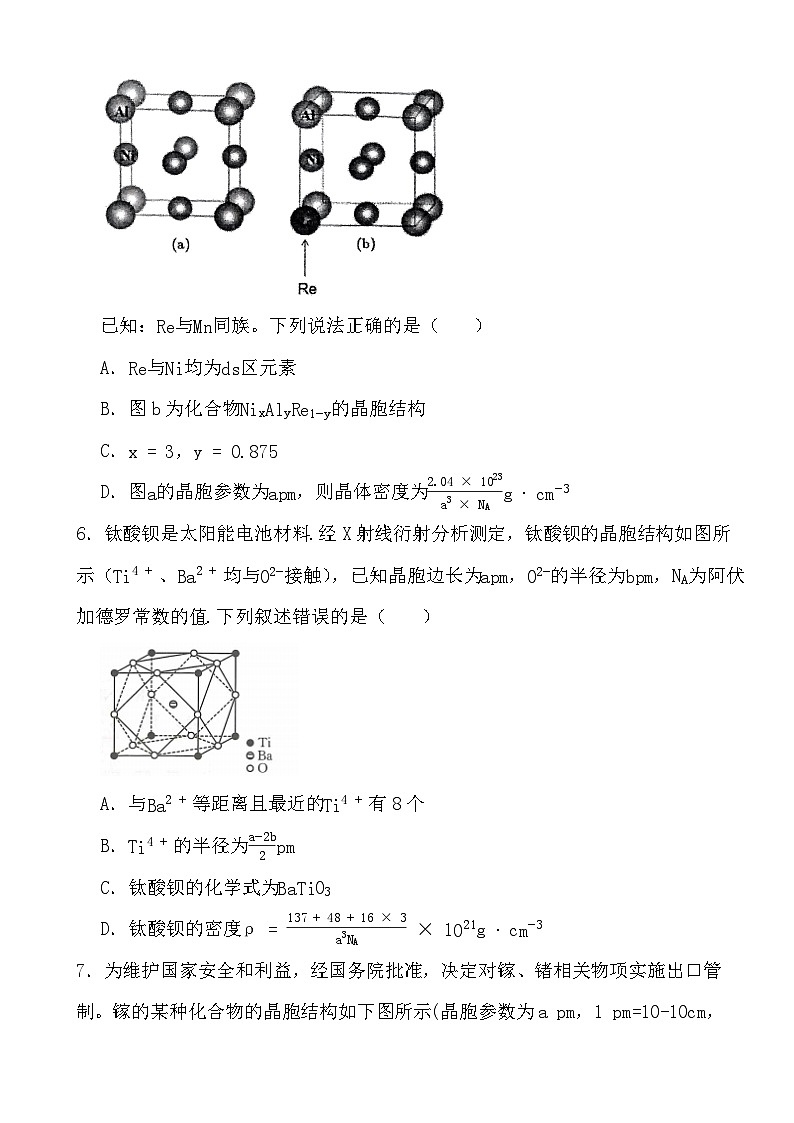
5.Ni与A1形成的合金具有抗高温氧化、耐腐蚀等优点,微观结构如图a所示;用金属铼(Re)掺杂后,形成的化合物NixA1yRe1−y,微观结构如图b所示:
已知:Re与Mn同族。下列说法正确的是( )
A.Re与Ni均为ds区元素
B.图b为化合物NixAlyRe1−y的晶胞结构
C.x=3,y=0.875
D.图a的晶胞参数为apm,则晶体密度为2.04×1023a3×NAg⋅cm−3
6.钛酸钡是太阳能电池材料.经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2−接触),已知晶胞边长为apm,O2−的半径为bpm,NA为阿伏加德罗常数的值.下列叙述错误的是( )
A.与Ba2+等距离且最近的Ti4+有8个
B.Ti4+的半径为a−2b2pm
C.钛酸钡的化学式为BaTiO3
D.钛酸钡的密度ρ=137+48+16×3a3NA×1021g⋅cm−3
7.为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是( )
A.Ga元素位于元素周期表的ds区
B.晶体结构中N的配位数为6
C.该物质的化学式为Ga4N4
D.该晶体的密度为4×84NA×(a×10−10)3g/cm3
8.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A.ZX4Y8B.ZX2Y6C.ZXY3D.ZX8Y12
9.已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6 = 3Na++ AlF63−。现有冰晶石的结构单元如图所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,是图中、中的一种。下列说法正确的是( )
A.冰晶石是共价晶体
B.大立方体的体心处代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度约为840NA×(a×10−3)3g•cm-3
10.FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的S22−(晶胞中的其他S22−已省略)。下列叙述正确的是( )
A.Fe2+的最高能层的电子排布式为3d6
B.基态Fe2+共有24种不同空间运动状态的电子
C.FeS2晶胞中距离每个S22−最近的S22−有8个
D.晶胞中Fe2+位于S22−所形成的正八面体的体心
11.一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR,用NA表示阿伏加德罗常数的值):
下列说法正确的是( )
A.基态47Ag失去4d能级上的一个电子转化为Ag+
B.若N点原子分数坐标为(14,14,0),则P点原子分数坐标为(0,0,c−sc)
C.M、N之间的距离为24a×10−7cm
D.晶体的密度为1192a2cNAg⋅pm−3
12.某种新型储氢材料的立方晶胞如图所示,该晶体由[Fe(NH3)6]n+和[BH4]−形成,晶胞参数为a pm。
下列说法中不正确的是( )
A.[Fe(NH3)6]n+中n=2
B.晶胞中[Fe(NH3)6]n+和[BH4]−的配位数分别为8和4
C.晶胞中距离最近的2个[Fe(NH3)6]n+之间的距离为3a4pm
D.[BH4]−中心原子的杂化方式为sp3杂化
13.下列有关晶体结构和性质的判断错误的是( )
A.AB.BC.CD.D
14.几种晶体的晶胞结构如图所示,下列说法错误的是( )
A.CsCl晶体中,每个Cs+周围紧邻8个Cl-
B.CaF2晶体中,每个Ca2+周围紧邻8个F-
C.干冰晶体中,每个CO2周围紧邻12个CO2
D.ZnS晶体中,每个S2-周围紧邻8个S2-
15.向FeCl3溶液中滴加黄血盐K4[Fe(CN)6]可制得普鲁士蓝,向FeCl2溶液中滴加赤血盐K3[Fe(CN)6]可制得滕氏蓝。经科学家研究发现,两者具有相同的结构。其晶胞由8个如图所示的小立方体构成(K+未标出),晶胞参数为2apm。下列关于普鲁士蓝和滕氏蓝说法错误的是( )
A.滕氏蓝和普鲁士蓝均为离子晶体
B.由图及滕氏蓝的化学式可知,K+应位于晶胞体心
C.测定晶体的结构常采用X射线衍射法
D.设滕氏蓝的式量为Mr,则滕氏蓝晶体的密度为Mr2NA(a×10−10)3g/cm3
16.CaF2是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,NA表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中lgc(HF)c(H+)与−lgc(X)(X为Ca2+或F−)的关系如图2所示。下列说法错误的是。( )
A.每个氟化钙晶胞中含有Ca2+的数目为4个
B.氟化钙的晶体密度为312a3×10−30NAgcm3
C.L1表示−lgc(F−)与lgc(HF)c(H+)的变化曲线
D.Ksp(CaF2)的数量级为10−10
17.(CH3NH3)PbI3是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示。已知:B代表Pb2+,A的原子分数坐标为(0,0,0),(CH3NH3)PbI3摩尔质量为M g/ml,晶胞边长为a pm,NA为阿佛伽德罗常数的值。下列说法正确的是( )
A.该晶体为共价晶体
B.Pb2+的配位数为8
C.C的原子分数坐标为(12,1,12)
D.该晶体的密度为MNAa3×1030g/cm3
18.有关晶体的结构如下图所示,下列说法中正确的是( )
A.在NaCl晶体中,阳离子的配位数为8,阴离子的配位数为6
B.该气态团簇分子的分子式为EF或FE,其晶体不导电
C.在金刚石晶体中,每个碳原子被6个六元环共同占有,每个六元环最多有4个碳原子共面
D.在CaF2晶体中,每个晶胞平均占有4个Ca2+,F-的配位数是4
19.下图为几种晶体或晶胞的结构示意图。下列说法错误的是( )
A.1ml冰晶体中含有氢键数目为2NA
B.四种晶体的熔点高低为:金刚石>MgO>冰>碘单质
C.碘晶体属于分子晶体,每个碘晶胞中实际占有8个碘原子
D.金刚石属于共价晶体,每个碳原子周围距离最近的碳原子数为4
20.钙钛矿(CaTiO3,晶胞如图a所示)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I−和有机碱离子CH3NH3+,其晶胞如图b所示:
下列说法中不正确的是( )
A.CaTiO3晶体所含化学作用力为离子键和共价键
B.有机碱CH3NH3+中N原子的杂化轨道类型是sp3
C.CaTiO3晶体Ca2+的配位数为12
D.Pb2+与图a中Ti4+的空间位置相同
21.某立方晶系的锑钾(Sb—K) 合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知NA为阿伏加德罗常数。下列说法正确的是( )
A.该合金的组成可表示为 K2Sb
B.该晶体是离子晶体
C.两个 Sb 之间最近的距离为2anm
D.该晶体的密度为2392a3NA×1021g⋅cm−3
22.下列有关物质结构的说法不正确的是( )
A.C-C 键比 Si-C 键键长短,故金刚石比金刚砂熔点更高、硬度更大
B.氯化钠晶体与氯化铯晶体中,Cl-的配位数均为 6
C.干冰晶体采用分子密堆积,每个 CO2周围紧邻 12 个 CO2
D.O3是极性分子,但由于极性微弱,它在 CCl4中的溶解度高于在水中的溶解度
23.某Ba-Ti-O晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞边长为a pm。设阿伏加德罗常数的值为NA,下列说法错误的是
A.化学式为BaTiO3
B.Ba2+和Ti4+间的最短距离为32a pm
C.该晶胞中与O2−等距离且最近的O2−有4个
D.晶体的密度为2.33×1032a3NAg/cm3
24.XeF2在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为(0,0,0)、(12,12,12)。已知:Xe—F键长为rpm°下列说法正确的是( )
A.XeF2中心原子上的孤电子对数为2
B.④号原子的分数坐标为(12,12−rc,12)
C.沿x、y、z任意一个方向投影,位于面中心的都只有Xe原子
D.晶胞中②③号原子间的距离d=c2+2a2pm
二、多选题
25.请仔细观察下列几种物质的结构示意图,下列说法错误的是( )
A.最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为TiC
B.锂的某种氧化物的晶胞如图2所示,则该氧化物的化学式为Li2O
C.某晶体的一部分如图3所示,则这种晶体中A、B、C三种粒子数目之比是1:4:2
D.Mn和Bi形成的某种晶体的结构如图4所示(白球均在六棱柱内),则该晶体物质的化学式为Mn2Bi
三、非选择题
26.Mg−Fe新型储氢合金的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。
(1)基态Fe原子共有 种空间运动状态的电子;基态Fe2+的价层电子排布式为 。
(2)下列说法正确的是____。
A.该晶胞与金刚石晶胞结构相似
B.铁原子之间最短距离为22anm
C.该合金储氢过程是化学吸附
D.储氢后材料中存在离子键、共价键和分子间作用力
(3)该晶体化学式为 ;设阿伏加德罗常数的值为NA,则该晶胞密度为 g⋅cm−3。(只需列出计算的表达式)
(4)每个Fe周围与它最近且等距的Mg有 个。
27.Li、B、C、Ga等元素的单质或化合物在很多领域有广泛的应用。请回答:
(1)基态31Ga原子的价电子排布式为 。
(2)一种含B化合物可用作吸附材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图1所示,其中[C(NH2)3]+为平面结构。
下列说法不正确的是____。
A.基态原子的第一电离能:C
相关试卷
这是一份2024年高考化学三轮冲刺考前巩固专题训练35 氢键,文件包含2024年高考化学三轮冲刺考前巩固专题训练35氢键答案docx、2024年高考化学三轮冲刺考前巩固专题训练35氢键docx等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练35 氢键,共6页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练34 晶体结构答案,共22页。试卷主要包含了选择题,多选题,非选择题等内容,欢迎下载使用。








