

所属成套资源:2024年高考化学三轮冲刺考前巩固专题训练
2024年高考化学三轮冲刺考前巩固专题训练49 化学原理综合
展开
这是一份2024年高考化学三轮冲刺考前巩固专题训练49 化学原理综合,共52页。试卷主要包含了非选择题等内容,欢迎下载使用。
一、非选择题
1.通过电化学、热化学等方法,将CO2转化为HCOOH等化学品,是实现“双碳”目标的途径之一。
请回答:
(1)某研究小组采用电化学方法将CO2转化为HCOOH,装置如图1。电极B上的电极反应式是 。
(2)该研究小组改用热化学方法,相关热化学方程式如下:
①ΔH3= kJ•ml﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0ml•L﹣1,平衡常数K=2.4×10﹣8,则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00ml•L﹣1氨水和0.18ml•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH= 。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的DMSO(有机溶剂)溶液,CO2和H2在溶液中反应制备HCOOH,反应过程中保持CO2(g)和H2(g)的压强不变,总反应CO2+H2⇌HCOOH的反应速率为v,反应机理如下列三个基元反应,各反应的活化能E2<E1<<E3(不考虑催化剂活性降低或丧失)。
①催化剂M足量条件下,下列说法正确的是 ____。
A.v与CO2(g)的压强无关
B.v与溶液中溶解H2的浓度无关
C.温度升高,v不一定增大
D.在溶液中加入N(CH2CH3)3,可提高CO2转化率
(4)②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因 。
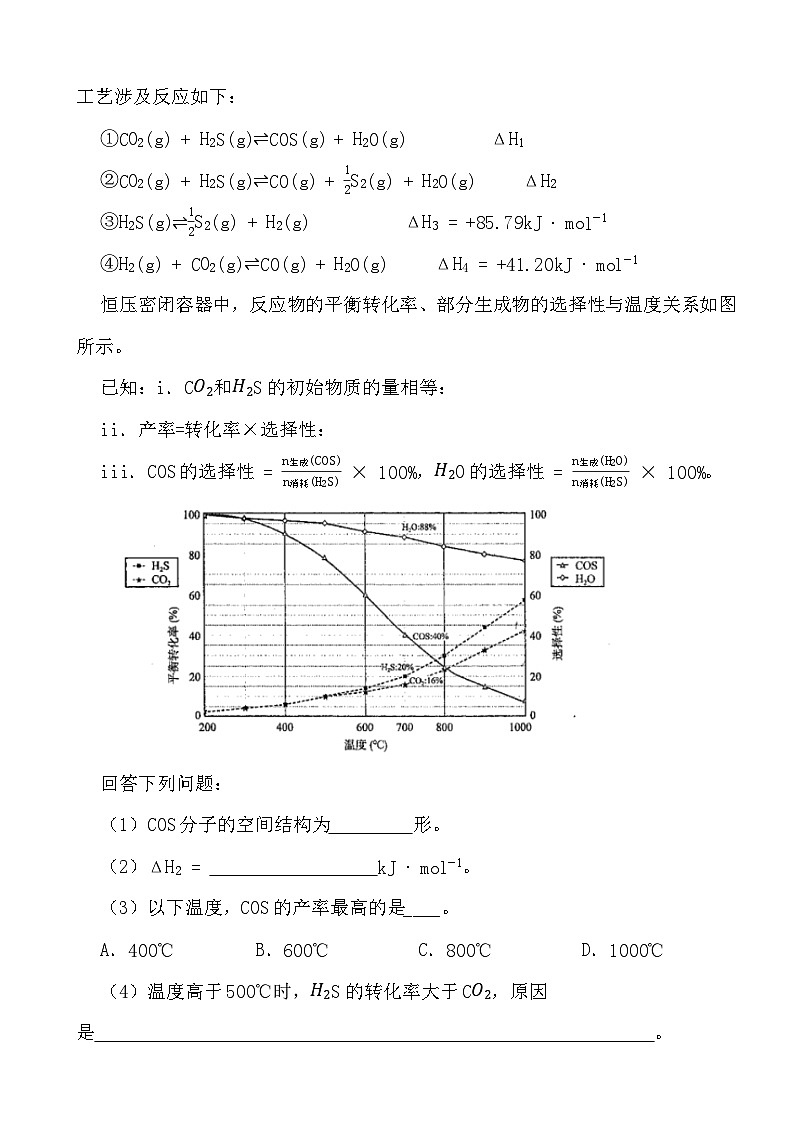
2.天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及反应如下:
①CO2(g)+H2S(g)⇌COS(g)+H2O(g) ΔH1
②CO2(g)+H2S(g)⇌CO(g)+12S2(g)+H2O(g) ΔH2
③H2S(g)⇌12S2(g)+H2(g) ΔH3=+85.79kJ⋅ml−1
④H2(g)+CO2(g)⇌CO(g)+H2O(g) ΔH4=+41.20kJ⋅ml−1
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:i.CO2和H2S的初始物质的量相等:
ii.产率=转化率×选择性:
iii.COS的选择性=n生成(COS)n消耗(H2S)×100%,H2O的选择性=n生成(H2O)n消耗(H2S)×100%。
回答下列问题:
(1)COS分子的空间结构为 形。
(2)ΔH2= kJ⋅ml−1。
(3)以下温度,COS的产率最高的是____。
A.400℃B.600℃C.800℃D.1000℃
(4)温度高于500℃时,H2S的转化率大于CO2,原因是 。
(5)可提高S2平衡产率的方法为____。
A.升高温度B.增大压强C.降低温度D.充入氩气
(6)700℃时反应①的平衡常数K= (精确到0.01)。
(7)催化剂CeO2-MgO对反应②具有高选择性,通过理论计算得到反应的主要路径如下图所示。表示状态2的为____。
A.B.C.
3.二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①CH4(g)+CO2(g)⇌2H2(g)+2CO(g) ΔH1
②CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH2=−90.2kJ⋅ml−1
③CH4(g)⇌C(s)+2H2(g) ΔH3=+74.9kJ⋅ml−1
④CO(g)+H2(g)⇌H2O(g)+C(s) ΔH4=−131.3kJ⋅ml−1
回答下列问题:
(1)ΔH1= ,反应① 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为5.00MPa、1.00MPa和0.50MPa时,CH4平衡转化率随反应温度变化如图所示,则代表反应体系总压强为5.00MPa的曲线是 (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是 。
(3)当反应体系总压强为0.1MPa时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,CO2的物质的量先增加后减少,主要原因是 。
(4)恒温恒压条件下,向容器中通入1mlCH4和1mlCO2,达到平衡时CH4的转化率为80%,CO2的转化率为50%,碳单质的物质的量为0.8ml,CO的物质的量为 ml,反应①用摩尔分数表示的平衡常数Kx= (结果保留两位小数)。
上述平衡时[c(H2)]2c(CH4)=a,向体系通入He气,重新达到平衡时,[c(H2)]2c(CH4)=b,则a b(填“>”“”“<”或“=”)。
②在210℃-270℃间,CH3OH的选择性随温度的升高而下降,可能原因为 。
③某条件下,达到平衡时CO2的转化率为15%,CH3OH的选择性为80%,则H2的平衡转化率为 ;反应II的平衡常数Kp= (列出算式即可)。
(3)利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:3CH3OH(g)⇌C3H6(g)+3H2O(g)。该反应的实验数据遵循Arhenius经验公式,如图乙中曲线a所示,已知Arthenius经验公式为Rlnk=-EaT+C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数),则反应的活化能 kJ·ml-1。当改变外界条件时,实验数据如图乙中的曲线b所示,则实验可能改变的外界条件是 ;此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大的 (填“越多”或“越少”)。
11.将CH4和CO2两种气体转化为合成气(H2和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
I.CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1 平衡常数K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2 平衡常数K2
Ⅲ.CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ΔH3 平衡常数K3
(1)ΔfHθm为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 ml该物质的焓变。对于稳定相态单质,其ΔfHθm为零。根据下表数据,计算反应Ⅱ的反应热ΔH2= ,该反应正反应活化能 逆反应活化能(填“大于”、“小于”或“等于”)。
(2)平衡常数K2= (用K1、K3表示)。
(3)一定温度下,维持压强p0,向一密闭容器中通入等物质的量的CH4和H2O(g)发生反应。已知反应Ⅱ的速率方程可表示为v正=k正⋅p(CO)⋅p(H2O),v逆=k逆⋅p(CO2)⋅p(H2),其中k正、k逆分别为正、逆反应的速率常数,则以物质的分压表示的反应Ⅱ的平衡常数KpII= (用k正、k逆表示),另lgk与1T的关系如图所示,①、②、③、④四条直线中,表示lgk正的是 (填序号),T1温度时,图中A、B、C、D点的纵坐标分别为a+1、a+0.48、a−0.3、a−1,达到平衡时,测得CH4的转化率为60%,且体系中p(CO2)=p(H2O),则p(CO2)= ,以物质的分压表示的反应I的平衡常数KpⅠ= 。(用含p0的代数式表示,已知:lg5=0.7)
12.二甲醚(DME)是一种重要的化工原料,可以通过CO2制备得到。制备方法和涉及反应如下:
方法a:“二步法”制二甲醚
I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=−49.5kJ/ml
Ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=−23.4kJ/ml
方法b:“一步法”制二甲醚
Ⅲ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH3
两种方法都伴随副反应:
Ⅳ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH4=+41.2kJ/ml
请回答:
(1)反应I自发进行的条件是 ;ΔH3= 。
(2)在一定温度下,向1L的恒容密闭容器中通入1mlCO2(g)和3mlH2(g)和利用方法a制备二甲醚。测得CO2的平衡转化率为30%,CH3OCH3(g)为aml,CO(g)为bml,反应I的平衡常数为 (用含a、b的式子表示,只需列出计算式)。
(3)恒压条件下,在密闭容器中利用方法b制备二甲醚。按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率和CO、CH3OCH3的选择性随温度变化如图1所示。
(CO的选择性=CO的物质的量参加反应的CO2的物质的量×100%,CH3OCH3的选择性=2×CH3OCH3的物质的量参加反应的CO2的物质的量×100%)
①下列说法正确的是
A.当反应达到平衡时,n(CO2):n(H2)=1:3
B.曲线①表示二甲醚的选择性
C.温度越低越有利于工业生产二甲醚
D.工业上引入双功能催化剂是为了降低反应Ⅲ的ΔH3
②在200∼350℃的范围内,CO2的平衡转化率先降低后升高的原因: 。
(4)有学者研究反应Ⅱ机理,利用磷酸硅铝分子筛催化甲醇制二甲醚,其中简化的分子筛模型与反应过渡态结构模型如图所示,下列说法正确的是____。(已知:磷酸硅铝分子筛中有酸性位点可以将甲醇质子化,题中的分子筛用“ZOH”符号表示)
A.制得的磷酸硅铝分子筛的孔径越大催化效率越高
B.该反应机理:2CH3OH+ZOH→[H|CH3O⋯CH3⋯OH2+⋯ZO−]→ZOH+(CH3)2O(g)+H2O(g)
C.改变分子筛组分比例适当提高其酸性,有利加快反应速率
D.温度越高,有利于水蒸气脱离分子筛,反应速率越快
13.甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:
反应1:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ΔH1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
请回答下列问题:
(1)在精选催化剂R作用下,反应Ⅰ可通过如图1所示的反应历程实现催化重整,则ΔH1= kJ/ml(用含字母a、b、c的代数式表示)。
(2)将一定量的甲醇气体和水蒸气混合反应,使用催化剂R,测得相同条件下,甲醇的转化率[(CH3OH)%]与CO的物质的量分数[(CO)%]变化如图2所示。反应Ⅱ为 反应(填“吸热”或“放热”),选择催化剂R的作用为 。
(3)将1 ml甲醇气体和1.2 ml水蒸气混合充入2 L恒容密闭容器中,控制反应温度为300℃、起始压强为2.5 MPa下进行反应。平衡时容器中n(CH3OH)=n(CO)=0.1 ml。此时H2O的浓度为 ,甲醇的转化率为 ,则反应Ⅱ的逆反应的压强平衡常数Kp= 。
(4)相同反应条件下,得到甲醇水蒸气重整反应各组分的实际组成与反应温度关系曲线图。
下列说法正确的是
A.升温对反应Ⅰ的化学反应速率影响更大
B.催化剂的选择应考虑提高生成CO2的选择性
C.催化剂的活性与温度有关,且反应前后化学性质保持不变
D.若容器内气体的平均摩尔质量保持不变,则反应Ⅱ一定处于平衡状态
14.丁二烯是生产丁苯橡胶SBR、ABS 树脂、聚丁二烯橡胶BR等的基本原料,也是生产氯丁二烯、乙烯基环己烯等化学品的关键中间体,工业上常在钼系催化剂作用下,用丁烯氧化脱氢制丁二烯。丁烯氧化脱氢制丁二烯的反应如下:
反应: 2C4H8 (g) +O2 (g) =2C4H6 (g) +2H2O (g) ΔH
副反应①: C4H8(g) +6O2 (g) =4CO2 (g) +4H2O (g) ΔH =-2542.6kJ·ml-1
副反应②: 2C4H6 (g) +11O2 (g) =8CO2 (g) +6H2O (g) ΔH2= -4886.6kJ·ml-1
(1)丁烯氧化脱氢制丁二烯反应的 ΔH = 。
(2)在钼系催化剂作用下,某恒压密闭容器中通入一定量的丁烯和氧气发生反应: 2C4H8 (g) +O2 (g) ⇌2C4H6(g) +2H2O (g),分别测得温度和氧烯比(氧气和丁烯的物质的量之比)对丁烯的转化率和丁二烯选择性的影响如下图所示:
氧烯比固定,温度升高,丁烯单位时间内转化率先增大后无明显变化的原因是 ; 丁
丁二烯最佳的温度和氧烯比分别为 ;
(3)400℃时,在体积为1L的恒容密闭容器中充入1ml C4H8和1ml O2发生丁烯氧化脱氢制丁二烯反应和副反应①和②,测得此时容器的压强为P0,平衡时容器内的压强为1.2P0,C4H8的转化率为70%,丁二烯的选择性为90%,则平衡后C4H6 (g)的体积分数为 ,丁烯氧化脱氢制丁二烯反应的平衡常数K= 。
(4)钼系催化剂上C4H8燃烧反应的速率方程为v (C4H8) =k·px (C4H8) ·Py (O2)。为确定x和y,通过实验获得如图3数据,则: x和y分别为 、 。
(5)一种以C4H8为主要原料的电池工作原理如图4所示。B上的电极反应式为 。
15.氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:
(1)已知:工业合成氨合成塔中每产生2mlNH3,放出92.2kJ热量,
则1mlN-H键断裂吸收的能量为 kJ。
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是____(填字母)
A.升高反应温度B.增大反应的压强
C.及时移走生成的NH3D.增加H2的物质的量
(3)将0.6mlN2和0.8mlH2充入恒容密闭容器中,在不同温度下,平衡时NH3的体积分数随压强变化的曲线如图。
甲、乙、丙中温度从高到低的顺序是 。d点N2的转化率是 ,d点Kp= (Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。
(4)催化氧化法消除NO反应原理为:6NO+4NH3催化剂__Δ5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是 。在温度超过1000℃时NO脱除率骤然下降的原因可能是 。
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是____(填字母)。
A.该反应历程中形成了非极性键和极性键
B.每生成2mlN2,转移的电子总数为8NA
C.Fe2+能降低总反应的活化能,提高反应速率
D.该反应历程中存在:NO+Fe2+-NH2=Fe2++N2↑+H2O
16.近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。二氧化碳加氢制甲醇已经成为研究热点,在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应如下:
Ⅰ. CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH10
回答下列问题:
(1)下列能说明反应Ⅰ一定达到平衡状态的是____(填标号)。
A.v正(CO2)=3v逆(H2)
B.平衡常数不再发生变化
C.混合气体的密度不再发生变化
D.混合气体中H2O(g)的百分含量保持不变
(2)CO2在催化剂作用下,将平均相对分子质量为16的CO2和H2的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率v正=k正x(CO2)⋅x(H2),v逆=k逆x(CO)⋅x(H2O),k正,k逆为速率常数,x为物质的量分数。
①当CO2转化率达到60%时,反应达到平衡状态,这时CO2和H2的平均相对分子质量为23,若反应Ⅱ的k正=20ml⋅L−1⋅s−1,平衡时反应速率v逆= ml⋅L−1⋅s−1;
②Arrℎenius经验公式为Rlnk=−EaT+C,其中Ea为活化能,T为热力学温度,k为速率常数,R和C为常数,则ΔH2= kJ⋅ml−1 (用含k正、k逆、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是 。
(3)其他条件相同时,反应温度对CH3OH选择性的影响如图所示:
由图可知,温度相同时CH3OH选择性的实验值略高于其平衡值,可能的原因是 。
(4)利用甲醇分解制取烯烃,涉及反应如下。
a. 2CH3OH(g)=C2H4(g)+2H2O(g)
b. 3CH3OH(g)=C3H6(g)+3H2O(g)
c. 3C2H4(g)⇌2C3H6(g)
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:
已知650K时,2x(C2H4)=x(C3H6),平衡体系总压强为P,则650K反应c的平衡常数Kp= 。
17.“O3氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:
(1)Ⅰ.O3氧化法
用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH1
b)2O3(g)⇌3O2(g) ΔH2=−286.6kJ⋅ml−1
c)2SO2(g)+O2(g)⇌2SO3(g) ΔH3=−196.6kJ⋅ml−1
根据盖斯定律,ΔH1= 。
(2)在密闭容器中充入1mlN2O4和1mlO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) ΔH4=+57kJ⋅ml−1
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) ΔH5
不同压强(p)下,N2O4的平衡转化率α(N2O4)随反应温度(T)的变化关系如下图所示:
①由图可知,ΔH5 0(填“大于”或“小于”下同),p1 p2。
②下列有关该反应体系的说法正确的是 (填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)”“
相关试卷
这是一份2024年高考化学三轮冲刺考前巩固专题训练49 化学原理综合,文件包含2024年高考化学三轮冲刺考前巩固专题训练49化学原理综合答案docx、2024年高考化学三轮冲刺考前巩固专题训练49化学原理综合docx等2份试卷配套教学资源,其中试卷共111页, 欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练42 化学计算综合答案,共6页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份2024年高考化学三轮冲刺考前巩固专题训练42 化学计算综合,文件包含2024年高考化学三轮冲刺考前巩固专题训练42化学计算综合docx、2024年高考化学三轮冲刺考前巩固专题训练42化学计算综合答案docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。








