

2022-2023学年广东省广州市天河区高二(下)期末化学试卷(含详细答案解析)
展开1.我国文化遗产众多,如图是北宋名画“千里江山图”的局部色彩。下列关于色彩所用颜料的化学成分不正确的是( )
A. 水墨底:炭黑
B. 赭石红:Fe3O4
C. 石绿:Cu2(OH)2CO3
D. 石青:Cu3(OH)2(CO3)2
2.北京冬奥会成功举办、“天宫课堂”授课、神舟十五号载人飞船发射成功以及“C919”飞机翱翔蓝天等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是( )
A. 冬奥会“飞扬”火炬所用的燃料H2为氧化性气体
B. “天宫课堂”中用到的乙酸钠过饱和溶液显酸性
C. 载人飞船的太阳能电池能将化学能转化为电能
D. “C919”机身使用的碳纤维属于新型无机非金属材料
3.劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )
A. AB. BC. CD. D
4.阿司匹林是三大经典药物之一,其结构简式如图所示。下列有关说法不正确的是( )
A. 分子式为C9H8O4
B. 与NaHCO3溶液反应产生气体
C. 与苯甲酸互为同系物
D. 1ml阿司匹林最多消耗3mlNaOH
5.一种高分子合成材料的单体结构如图所示。下列有关说法正确的是( )
A. 该有机物存在顺反异构体B. 分子中最多有4个碳原子在同一平面上
C. 它与互为同分异构体D. 它与H2加成后的产物名称是2−甲基己烷
6.桂皮中含有的肉桂醛()是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中。工业上制备肉桂醛可采用如图方法:
下列有关说法不正确的是( )
A. Ⅰ、Ⅱ都能发生加成反应B. Ⅱ、Ⅲ可用酸性KMnO4溶液鉴别
C. Ⅰ、Ⅱ、Ⅲ都能发生银镜反应D. 1ml肉桂醛完全燃烧消耗10.5mlO2
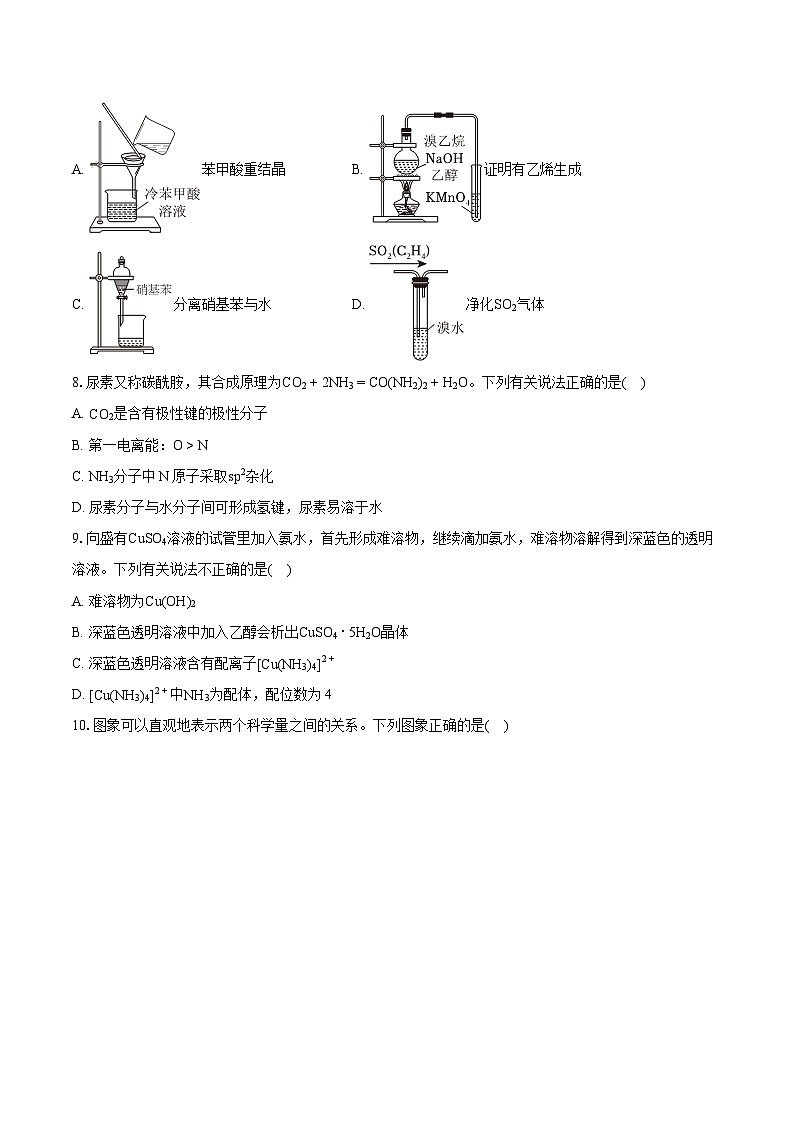
7.实验是化学研究的一种重要手段。下列实验能达到相应实验目的的是( )
A. 苯甲酸重结晶B. 证明有乙烯生成
C. 分离硝基苯与水D. 净化SO2气体
8.尿素又称碳酰胺,其合成原理为CO2+2NH3=CO(NH2)2+H2O。下列有关说法正确的是( )
A. CO2是含有极性键的极性分子
B. 第一电离能:O>N
C. NH3分子中N原子采取sp2杂化
D. 尿素分子与水分子间可形成氢键,尿素易溶于水
9.向盛有CuSO4溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液。下列有关说法不正确的是( )
A. 难溶物为Cu(OH)2
B. 深蓝色透明溶液中加入乙醇会析出CuSO4⋅5H2O晶体
C. 深蓝色透明溶液含有配离子[Cu(NH3)4]2+
D. [Cu(NH3)4]2+中NH3为配体,配位数为4
10.图象可以直观地表示两个科学量之间的关系。下列图象正确的是( )
A. B.
C. D.
11.NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.7g−OH含有的电子数为NA
B. 4.2g乙烯与丙烯的混合气体含碳原子数为0.3NA
C. 标准状况下,11.2LCH2Cl2所含分子数为0.5NA
D. 1mlCH4与1mlCl2在光照条件下完全反应生成2mlHCl
12.丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示。下列说法不正确的是( )
A. 曲线a表示反应2的能量变化B. 反应1和反应2都是放热反应
C. 反应1和反应2的决速步骤都是第1步D. 相同条件下反应2的速率比反应1大
13.近期,我国科学家提出了一种双极膜硝酸盐还原工艺,原理如图。双极膜中间层中的H2O解离为H+和OH−,在外加直流电场作用下分别向两极迁移。下列说法不正确的是( )
A. m是H+
B. b接电源正极
C. 产生的NH3与O2的物质的量之比为4:5
D. 左室电极反应为NO3−+6H2O+8e−=NH3↑+9OH−
14.一种麻醉剂的分子结构式如图所示。其中,X、Y、Z、W、E为原子序数依次增大的短周期元素,元素E的原子比W原子多8个电子。下列说法不正确的是( )
A. XEZ是一种强氧化性弱酸B. 电负性:W>Z>E>Y
C. 原子半径:Y>Z>W>XD. 该分子中所有原子均满足8电子稳定结构
15.磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等,其晶胞结构如图所示。下列说法不正确的是( )
A. 基态P原子的价层电子轨道表示式
B. 磷锡青铜合金具有各向异性的特点
C. 磷锡青铜合金的化学式为Cu3SnP
D. 该晶胞中与Sn原子最近且等距离的Cu原子有12个
16.常温下,向某浓度的H2A溶液中逐滴加入某浓度的KOH溶液,测得溶液中H2A、HA−、A2−三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法不正确的是( )
A. 曲线1代表δ(H2A),曲线3代表δ(A2−)
B. H2A的第一步电离常数Ka1=10−1.2
C. KHA溶液呈碱性
D. pH=4.2时,溶液中c(K+)+c(H+)=3c(HA−)+c(OH−)
二、流程题:本大题共1小题,共14分。
17.工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni、Pb等元素的杂质)与废硫酸亚铁制备高纯MnO2,其工艺流程和MnCO3煅烧时的条件如图所示。
25℃时溶度积常数:
(1)“焙烧”时,将低品位锰矿和废硫酸亚铁粉碎后填入焙烧炉内,同时鼓入大量空气使粉末呈沸腾状,目的是______,反应中的氧化剂是______。
(2)“除铝”的离子方程是______。
(3)“除重金属”是除去MnSO4溶液中极少量的Pb2+和Ni2+,若溶液中c(Mn2+)=0.1ml⋅L−1,则Pb2+和Ni2+完全除尽时,需控制S2−物质的量浓度的范围是______,实际操作中很难控制,可以用______ (填化学式)代替BaS。
(4)“沉锰”的化学反应方程式是______,“煅烧”时应采取的条件是______。
(5)基态Mn原子的价层电子排布式是______,锰的化合物LiMn2O4是一种锂电池材料,其晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为apm,则晶体密度为______ g⋅cm−3。
三、实验题:本大题共1小题,共14分。
18.1,2−二溴乙烷可制造杀虫剂、药品等,也是有机合成的重要中间体。实验室用乙醇和浓硫酸反应制乙烯(含少量CO2、SO2),再用溴与之反应生成1,2−二滇乙烷。实验中用到下列仪器(短接口或橡皮管均已略去),回答下列问题:
(1)气体流向从左到右:将B插入A①中,D接A②,A③接C,接______接______接______。
(2)A中温度计水银球的位置______,若用分液漏斗代替装置 D,可能会产生的问题是______。
(3)加热三颈烧瓶前,先将E与其前面连接装置断开,再加热,待温度升到约120℃时,连接E与其前面装置,并迅速升温至160∼180℃,从D中慢慢滴加乙醇-浓硫酸混合液,保持乙烯气体均匀地通入装有3.20mL液溴(ρ=3.0g⋅cm−3)和3mL水的E试管,直至反应结束。
①加热三颈烧瓶前将E与其前面连接装置断开的目的是______。
②判断反应结束的现象是______。
(4)将粗产品通过以下操作提纯得到1,2−二溴乙烷。
a.水洗涤
b.氢氧化钠溶液洗涤
c.过滤
d.用无水氯化钙干燥
e.蒸馏收集129∼133℃馏分,最后得到7.896g1,2−二溴乙烷。
①粗品提纯的顺序是a→b→a→______ (填序号)。
②1,2−二溴乙烷的产率为______。
(5)检验溴乙烷中含有溴元素,通常采用的实验方法与现象是:取少量溴乙烷于试管中,加入NaOH溶液并加热,静置冷却后,______。
四、简答题:本大题共2小题,共28分。
19.近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”,将CO2转化为高附加值化学品成为科学家研究的重要课题。
Ⅰ.Cu−ZnO催化CO2和H2生产甲醇。
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ⋅ml−1
(1)已知:CO(g)+2H2(g)⇌CH3OH(g)ΔH=−90.6kJ⋅ml−1,则ΔH1=______。
(2)已知:反应①的正反应速率可表示为v正=k正⋅c(CO2)⋅c3(H2),逆反应速率可表示为v逆=k逆⋅c(CH3OH)⋅c(H2O),其中k正、k逆为速率常数。图中能够代表k逆的曲线为______ (填“L1”,“L2”、“L3”或“L4”)。
(3)对于上述反应体系,下列说法正确的是______。
A.增大CO2的浓度,反应①、②的正反应速率均增加,逆反应速率均减小
B.恒容密闭容器中气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
D.温度为T1时,反应①的化学平衡常数K=1
(4)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图所示。
①压强p1、p2、p3由大到小的顺序是______,压强为p1时,温度高于570℃之后,随着温度升高CO2平衡转化率增大的原因是______。
②图中点M(500,60),此时压强p1为0.1MPa,CH3OH的选择性为23(选择性:转化的CO2中生成CH3OH占整个转化的CO2的百分比)。则该温度时反应①的平衡常数Kp=______ (MPa)−2(分压=总压×物质的量分数)。
Ⅱ.电化学法还原CO2制乙烯
在强酸性溶液中通入CO2,用情性电极进行电解可制得乙烯。其原理如图所示:
(5)阴极电极反应式为______。
20.苯氧乙酸()是一种重要的化工原料和制药中间体,有关苯氧乙酸衍生物的合成路线如下。回答下列有关问题:
已知:①RCH2COOH→催化剂Cl2
②R−ONa→△R′−ClR−O−R′
(1)试剂BrCH2COOCH3所含官能团的名称为______。
(2)A→B的反应类型为______, C的核磁共振氢谱图上峰的组数为______。
(3)B→C的化学方程式为______。
(4)D的分子式为______,D→△Cu/O2E,E的结构式为______。
(5)化合物B的芳香族同分异构体中,同时满足如下条件的有______种,写出其中任意一种的结构简式______。
a.苯环上只有两个取代基;
b.能与新制Cu(OH)2反应,产生砖红色沉淀;
c.与FeCl3发生显色反应;
d.最多能与2倍物质的量的NaOH反应。
(6)结合题中已知信息,设计由苯酚和乙醇为起始原料制备苯氧乙酸的合成路线(无机试剂任选)______。
答案和解析
1.【答案】B
【解析】解:A.炭黑为黑色,故A正确;
B.Fe3O4是黑色晶体,赭石红的主要成分是氧化铁,是红棕色固体,故B错误;
C.Cu2(OH)2CO3为绿色,故C正确;
D.Cu3(OH)2(CO3)2为青色。,故D错误;
故选:B。
A.炭黑为黑色;
B.Fe3O4是黑色晶体;
C.Cu2(OH)2CO3为绿色;
D.Cu3(OH)2(CO3)2为青色。
本题考查物质的颜色及组成,主要掌握最基本的概念是解题的关键,题目难度不大。
2.【答案】D
【解析】解:A.冬奥会“飞扬”火炬所用的燃料H2为还原性气体,故A错误;
B.乙酸钠为强碱弱酸盐,水溶液显碱性,故B错误;
C.载人飞船采用了太阳能刚性电池阵,消耗太阳能,产生电能,将太阳能转化为电能供飞船使用,故C错误;
D.“C919”飞机机身使用的材料碳纤维属于新型无机非金属材料,故D正确;
故选:D。
A.H2为还原性气体;
B.乙酸钠为强碱弱酸盐;
C.太阳能电池工作时,消耗太阳能,产生电能;
D.碳纤维属于新型无机非金属材料。
本题主要考查物质的分类与变化,为基础知识的考查,题目难度不大。
3.【答案】A
【解析】解:A.秸秆的主要成分是纤维素,用秸秆生产燃料乙醇,与淀粉水解产生葡萄糖没有关联,故A错误;
B.Cu2+是重金属离子,可使蛋白质变性,则波尔多液可用于防治农作物病害,故B正确;
C.油脂在碱性条件下水解为肥皂的主要成分--高级脂肪酸钠,即用废弃的植物油或动物脂肪制肥皂,油脂在碱性条件下的反应为皂化反应,故C正确;
D.聚合酶链反应可在生物体外扩增DNA片段,故可用核酸检测诊断新冠肺炎等传染病,故D正确;
故选:A。
A.秸秆的主要成分是纤维素;
B.重金属离子可使蛋白质变性;
C.油脂在碱性条件下水解为肥皂的主要成分--高级脂肪酸钠;
D.聚合酶链反应可在生物体外扩增DNA片段。
本题考查物质的性质及应用,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与运用能力的考查,题目难度不大。
4.【答案】C
【解析】解:A.由结构可知分子中含9个C原子、8个H原子、4个O原子,分子式为C9H8O4,故A正确;
B.分子中含羧基,与NaHCO3溶液反应产生气体,故B正确;
C.苯甲酸的同系物不含酯基,可知二者不互为同系物,故C错误;
D.羧基、酯基及水解生成的酚羟基均与NaOH反应,则1ml阿司匹林最多消耗3mlNaOH,故D正确;
故选:C。
A.由结构可知分子中含9个C原子、8个H原子、4个O原子;
B.分子中含羧基;
C.苯甲酸的同系物不含酯基;
D.羧基、酯基及水解生成的酚羟基均与NaOH反应。
本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大。
5.【答案】C
【解析】解:A.碳碳双键连接的一个碳原子连接相同的氢原子,所以该分子不存在顺反异构,故A错误;
B.碳碳双键为平面结构,与双键碳直接相连的碳与双键共面,且3个碳原子可确定1个平面,则最多共面的碳原子数一定大于4,故B错误;
C.与甲基环己烷分子式相同,但结构不同,互为同分异构体,故C正确;
D.该有机物与氢气完全加成后的产物为(CH3)2CHCH2CH(CH3)2,名称是2,4−二甲基戊烷,故D错误;
故选:C。
A.碳碳双键两端的碳原子连接2个不同的原子或原子团时,存在顺反异构;
B.碳碳双键为平面结构,与双键碳直接相连的碳与双键共面;
C.二者分子式相同、结构不同;
D.该有机物与氢气完全加成后的产物为(CH3)2CHCH2CH(CH3)2。
本题考查有机物的结构与性质,为高频考点,把握有机物的官能团、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大。
6.【答案】B
【解析】解:A.Ⅰ、Ⅱ均含醛基,都能与氢气发生加成反应,故A正确;
B.Ⅱ、Ⅲ均含醛基,均能被酸性高锰酸钾溶液氧化,不能鉴别,故B错误;
C.Ⅰ、Ⅱ、Ⅲ均含醛基,都能发生银镜反应,故C正确;
D.肉桂醛中含9个C原子、8个H原子、1个O原子,则1ml肉桂醛完全燃烧消耗O2为1ml×(9+84−12)=10.5ml,故D正确;
故选:B。
A.Ⅰ、Ⅱ均含醛基;
B.Ⅱ、Ⅲ均含醛基;
C.Ⅰ、Ⅱ、Ⅲ均含醛基;
D.肉桂醛中含9个C原子、8个H原子、1个O原子。
本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应为解答的关键,侧重分析与应用能力的考查,注意醛的性质,题目难度不大。
7.【答案】C
【解析】解:A.苯甲酸在水中的溶解度不大,重结晶法分离时应趁热过滤减少溶解损失,故A错误;
B.溴乙烷在NaOH醇溶液中发生消去反应,生成的乙烯及挥发的乙醇均可被酸性高锰酸钾溶液氧化,紫色褪去,不能证明生成乙烯,故B错误;
C.硝基苯与水分层,可选分液漏斗分离,下层为硝基苯,故C正确;
D.二氧化硫、乙烯均与溴水发生反应,将原物质除去,不能除杂,故D错误;
故选:C。
A.苯甲酸在水中的溶解度不大;
B.溴乙烷在NaOH醇溶液中发生消去反应,生成的乙烯及挥发的乙醇均可被酸性高锰酸钾溶液氧化;
C.硝基苯与水分层;
D.二氧化硫、乙烯均与溴水发生反应。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物的分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
8.【答案】D
【解析】解:A.CO2结构式为O=C=O,是直线形分子,正负电荷中心能重合,是含有极性键的非极性分子,故A错误;
B.N原子2p轨道为半充满结构,比较稳定,第一电离能比相邻的O元素大,即第一电离能:N>O,故B错误;
C.NH3分子中N原子的价层电子对数为3+5−32=4,VSEPR模型为四面体,N原子的杂化方式为sp3,故C错误;
D.尿素分子中含有N−H键、N的电负性大,水分子中含有O−H键、O原子电负性大,则尿素分子与水分子间可形成氢键,导致尿素易溶于水,故D正确;
故选:D。
A.CO2是对称结构的直线形分子,正负电荷中心能重合;
B.第二周期从左向右第一电离能呈增大的趋势,但N原子2p轨道为半满结构,比较稳定,第一电离能比相邻元素的大;
C.NH3分子中N原子的价层电子对数为3+5−32=4,VSEPR模型为四面体;
D.分子间氢键可使物质的溶解性增大。
本题考查原子轨道杂化方式及杂化类型的判断、元素性质,把握VSEPR模型的应用、电离能的规律性与特殊性、分子极性的判断方法、氢键对物质性质的影响即可解答,注意掌握价层电子对数的计算方法,题目难度中等。
9.【答案】B
【解析】解:A.起始时CuSO4和氨水反应生成Cu(OH)2沉淀和(NH4)2SO4,则首先形成的难溶物为Cu(OH)2,故A正确;
B.深蓝色透明溶液中溶质为[Cu(NH3)4]SO4,乙醇能降低[Cu(NH3)4]SO4的溶解度,所以深蓝色透明溶液中加入乙醇会析出[Cu(NH3)4]SO4晶体,故B错误;
C.[Cu(NH3)4]SO4溶液是深蓝色透明溶液,SO42−无色,则深蓝色透明溶液含有配离子[Cu(NH3)4]2+,故C正确;
D.NH3分子中N原子含有孤电子对,Cu2+具有空轨道,二者通过配位键形成Cu(NH3)4]2+离子,其中Cu2+是中心离子,NH3为配体,配位数为4,故D正确;
故选:B。
向盛有CuSO4溶液的试管里加入氨水,首先形成难溶物Cu(OH)2,反应为Cu2++2NH3⋅H2O=Cu(OH)2↓+2NH4+,继续滴加氨水,难溶物Cu(OH)2溶解得到深蓝色的透明溶液,反应为Cu(OH)2+4NH3⋅H2O=[Cu(NH3)4]2++4H2O+2OH−,配离子[Cu(NH3)4]2+中NH3为配体,配位数为4,据此分析解答。
本题考查配合物、配位键的形成等知识,把握物质性质、发生的反应、配位键的形成条件、配离子的构成为解答关键,试题侧重考查学生的分析与运用能力,题目难度不大。
10.【答案】D
【解析】解:A.卤素原子半径F
B.氧族元素的氢化物水分子间形成氢键,沸点反常的高,其它随相对分子质量增大而升高,沸点大小H2O>H2Se>H2S,故B错误;
C.SiH4中心原子价层孤电子对数为0,NH3孤对电子数1,H2O孤对电子2,键角大小:SiH4>NH3>H2O,故C错误;
D.H−X中X的非金属性越强,形成的共价键的极性越强,H−F>H−N>H−C,故D正确;
故选:D。
A.卤素原子半径越大,和氢原子形成的共价键越弱;
B.氧族元素的氢化物水分子间形成氢键,沸点反常的高,其它随相对分子质量增大而升高;
C.中心原子价层孤电子对数越多,键角越小;
D.非金属性C
11.【答案】B
【解析】解:−OH对应物质的量为0.1ml,每个−OH中含9电子,所以1.7g−OH中含有电子数为0.9NA,故A错误;
B.乙烯与丙烯最简式都为CH2,4.2g乙烯与丙烯的混合气体对应物质的量为0.3ml,即含碳原子数为0.3NA,故B正确;
C.标准状况下CH2Cl2非气体,不能利用气体摩尔体积进行计算,故C错误;
D.甲烷与氯气反应为连续反应,根据反应过程中的元素守恒可知,lmlCH4与lmlCl2在光照条件下完全反应生成lmlHCl,故D错误;
故选:B。
每个−OH中含9电子;乙烯与丙烯最简式都为CH2;标准状况下CH2Cl2非气体;lmlCH4与lmlCl2在光照条件下完全反应生成lmlHCl,以此答题。
本题主要考查了阿伏加德罗常数的有关计算,掌握阿伏加德罗常数的计算方法是解题关键,考查学生的计算能力,题目难度不大。
12.【答案】A
【解析】解:A.由图可知,曲线a的活化能大,化学反应速率小,表示反应1的能量变化,故A错误;
B.由图可知,反应1和反应2生成物的总能量均小于反应物的总能量,均为放热反应,故B正确;
C.慢反应为决速步骤,反应1和反应2第1步的活化能均较大,反应速率较小,因此反应1和反应2的决速步骤都是第1步,故C正确;
D.相同条件下反应2的活化能比反应1小,反应速率比反应1大,故D正确;
故选:A。
A.由图可知,曲线a的活化能大,化学反应速率小。
B.生成物的总能量小于反应物的总能量的反应为放热反应;
C.慢反应为决速步骤;
D.活化能越小,化学反应速率越大。
本题主要考查化学反应中能量的变化,为高频考点,题目难度不大。
13.【答案】C
【解析】解:A.根据分析可知,m是H+,故A正确;
B.根据分析可知,b接发生的是氧化反应,属于阳极,接外电源的正极,故B正确;
C.根据题意有关系式:NH3∼8e−∼2O2,则产生的NH3与O2的物质的量之比为1:2,故C错误;
D.根据分析可知,左室电极反应为NO3−+6H2O+8e−=NH3↑+9OH−,故D正确;
故选:C。
由题意可知,该工艺左室电极反应为:NO3−+6H2O+8e−=NH3↑+9OH−,右室电极反应为:4OH−−4e−=O2+2H2O,双极膜中间层中的H2O解离为H+和OH−,H+向左室移动,OH−向右室移动,据此分析作答。
本题主要考查电解原理的应用,侧重考查氧化还原反应原理的应用,属于基本知识的考查,难度不大。
14.【答案】D
【解析】【分析】
本题主要考查元素推断,涉及电负性、原子半径大小比较、8电子稳定结构等,难度一般。
【解答】
X、Y、Z、W、E为原子序数依次增大的短周期元素,元素E的原子比W原子多8个电子,WE均形成1个共价键,则为W为氟、E为氯;Y形成4个共价键,为碳;Z形成2个共价键,为氧;X形成1个共价键且原子序数最小,为氢;
A.HClO为次氯酸,是一种强氧化性弱酸,A正确;
B.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变大;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减小;电负性: W>Z>E>Y ,B正确;
C.一般电子层数越多原子半径越大,电子层数相同时,核电荷数越大,半径越小,原子半径:Y>Z>W>X,C正确;
D.该分子中氢原子不满足8电子稳定结构,D错误;
故选D。
15.【答案】A
【解析】【分析】
本题主要考查晶胞的有关知识,涉及轨道表达式、晶体的特点、计算等,难度一般。
【解答】
A.磷为15号元素,基态P原子的价电子排布式为3s23p3,价层电子轨道表示式,A错误;
B.磷锡青铜合金为金属晶体,具有各向异性的特点,B正确;
C.根据“均摊法”,晶胞中含 8×18=1 个Sn、 6×12=3 个Cu、1个P,则磷锡青铜合金的化学式为 Cu3SnP ,C正确;
D.以左下角的Sn为例,该晶胞中与Sn原子最近且等距离的Cu原子有 3×12×8=12 个,D正确;
故选A。
16.【答案】C
【解析】解:A.由分析可知,曲线1代表δ(H2A),曲线3代表δ(A2−),故A正确;
B.由1、2交点可知,H2A的第一步电离常数Kal=c(H+)c(HA−)c(H2A)=c(H+)=10−1.2,故B正确;
C.KHA溶液中带A微粒AH+浓度最大,由图可知,溶液中HA⁻分数最大时,溶液pH<7,显酸性,故C错误;
D.由图可知,pH=4.2时c(HA⁻)=(A2−),溶液中由电荷守恒可知,c(K⁺)+c(H⁺)=2c(A2−)+c(HA⁻)+c(OH⁻),则c(K⁺)+c(H⁺)=3c(HA⁻)+c(OH⁻),故D正确;
故选:C。
向某浓度的H2A溶液中逐滴加入某浓度的KOH溶液,随着氢氧化钾加入,溶液中H2A一直减小、HA先增大后减小、A2−会增大,故1、2、3分别为H2A、HA⁻、A2−的曲线;
本题考查弱电解质的电离,题目难度不大,明确图示曲线变化的意义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题侧重考查学生的分析能力及综合应用能力。
17.【答案】加快反应速率提高焙烧效果 MnO2、O2 Al3++3NH3⋅H2O=Al(OH)3↓+3NH4+ 2.5×10−9ml/L∼3.2×10−14ml/LMnSMnSO4+NH3⋅H2O+NH4HCO3=MnCO3↓+(NH4)2SO4+H2O煅烧4h、翻动10min3d54s2 181a3NA×1030
【解析】解:(1)“焙烧”时,将低品位锰矿和废硫酸亚铁粉碎后填入焙烧炉内,同时鼓入大量空气使粉末呈沸腾状,目的是增加反应物接触面积,加快反应速率提高焙烧效果;反应中锰元素、氧气中氧元素化合价降低,故氧化剂是MnO2、O2,
故答案为:加快反应速率提高焙烧效果;MnO2、O2;
(2)“除铝”反应为铝离子和氨水生成氢氧化铝沉淀,离子方程是Al3++3NH3⋅H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3⋅H2O=Al(OH)3↓+3NH4+;
(3)由表格数据可知,PbS 较NiS更难溶,当NiS完全沉淀时c(S2−)=Ksp(NiS)c(Ni2+)=3.2×10−1910−5ml/L=3.2×10−14ml/L;溶液中c(Mn2+)=0.1ml/L,当锰离子开始沉淀时c(S2−)=Ksp(MnS)c(Mn2+)=2.5×10−100.1ml/L=2.5×10−9ml/L,需控制S2−物质的量浓度的范围是2.5×10−9ml/L∼3.2×10−14ml/L;MnS溶解度大于PbS、Nis,实际操作中很难控制,可以用MnS代替BaS,
故答案为:2.5×10−9ml/L∼3.2×10−14ml/L;MnS;
(4)“沉锰”的化学反应为硫酸锰、氨水、碳酸氢铵反应生成碳酸锰沉淀、硫酸铵、水,方程式是MnSO4+NH3⋅H2O+NH4HCO3=MnCO3↓+(NH4)2SO4+H2O;由图可知,“煅烧”时应采取的条件是煅烧4h、翻动10min,此时得到二氧化锰含量已经较高了,
故答案为:MnSO4+NH3⋅H2O+NH4HCO3=MnCO3↓+(NH4)2SO4+H2O;煅烧4h、翻动10min;
(5)锰为25号元素,基态Mn原子价电子排布为3d54s2;该晶胞参数为apm,根据“均摊法”,晶胞中含8×18+6×12=4个O,结合化学式可知该晶胞含有1个LiMn2O4,则晶体密度为MNAa3×103g/cm=181a3NA×1030g/cm,
故答案为:3d54s2;181a3NA×1030。
增加反应物接触面积,加快反应速率提高焙烧效果;)“除铝”反应为铝离子和氨水生成氢氧化铝沉淀;MnS溶解度大于PbS、Nis;沉锰”的化学反应为硫酸锰、氨水、碳酸氢铵反应生成碳酸锰沉淀、硫酸铵、水;锰为25号元素,基态Mn原子价电子排布为3d54s2,以此答题。
本题主要考查了制备实验方案的设计,属于高频考点,需要边思考、边分析,熟悉制备流程是解题关键,侧重考查分析能力,题目难度一般。
18.【答案】F E G 伸入液面以下 由于装置中压强原因,分液漏斗中液体不能顺利滴下 防止气流促进溴的挥发,减少溴的损失 E试管中溶液颜色褪色 d、c、e70%加入硝酸酸化,再加入硝酸银溶液,生成淡黄色沉淀,说明溴乙烷中含有溴元素
【解析】解:(1)由分析可知,气体流向从左到右:将B插入A①中,D接A②,A③接C,接F接E接G,
故答案为:F;E;G;
(2)A中温度计需要测定反应液的温度,故水银球的位置伸入液面以下;D为恒压滴液漏斗,若用分液漏斗代替装置D,可能会产生的问题是由于装置中压强原因,分液漏斗中液体不能顺利滴下,
故答案为:伸入液面以下;由于装置中压强原因,分液漏斗中液体不能顺利滴下;
(3)①溴具有挥发性,加热三颈烧瓶前将E与其前面连接装置断开的目的是防止气流促进溴的挥发,减少溴的损失;
故答案为:防止气流促进溴的挥发,减少溴的损失;
②溴水为橙色,乙烯和溴生成无色l,2−二溴乙烷,則判断反应结束的现象是E试管中溶液颜色褪色,说明反应结束,
故答案为:E试管中溶液颜色褪色;
(4)①粗产品a.水洗涤后,用b.氢氧化钠溶液洗涤除去乙醇、溴等杂质,再a.水洗涤后使用d.用无水氯化钙干燥除去水分,c.过滤除去固体干燥剂,c.蒸馏收集129∼133℃馏分得到l,2−二溴乙烷,即粗品提纯的顺序是a→b→a→d、c、e
故答案为:d、c、e
②3.20mL液溴(ρ=3.0g⋅cm−3)的物质的量为3.0×3.280×2ml,理论上生成I,2−二溴乙烷3.0×3.280×2ml,故1,2−二溴乙烷的产率为7.896g3.0×3.280×2ml×188g/ml×100%=70%,
故答案为:70%;
(5)澳离子和银离子生成溴化银沉淀,故采用的实验方法与现象是:取少量溴乙烷于试管中,加入NaOH溶液并加热,静置冷却后,加入硝酸酸化,再加入硝酸银溶液,生成淡黄色沉淀,说明溴乙烷中含有溴元素,
故答案为:加入硝酸酸化,再加入硝酸银溶液,生成淡黄色沉淀,说明溴乙烷中含有溴元素。
将B插入A①中,D接A②,A③接C,A中加入乙醇和浓硫酸控制温度加热反应制乙烯,生成气体通过F除去二氧化硫、二氧化碳杂质,纯净乙烯进入E中和溴生成1,2−二溴乙烷,尾气使用G处理防止污染空气。
本题主要考查了物质的制备与性质,题目难度不大,掌握基础知识,结合题给信息是解答的关键。
19.【答案】−49.4kJ/mlL4 CDp3>p2>p1 温度高于570℃之后,反应②是吸热反应,以反应②为主,温度升高平衡正向移动 1502CO2+12H++12e−=CH2=CH2+4H2O
【解析】解:(1)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ⋅ml−1
③CO(g)+2H2(g)⇌CH3OH(g)ΔH=−90.6kJ⋅ml−1
根据盖斯定律:②+③得①,则ΔH1=(−90.6+41.2)kJ/ml=−49.4kJ/ml,
故答案为:−49.4kJ/ml;
(2)反应①为放热反应,升高温度,反应速率加快,速率常数也增大,且平衡逆向移动,则逆反应速率增大的幅度大于正反应速率,则图中能代表k逆的曲线为L4,
故答案为:L4;
(3)A.增大CO2的浓度,反应①、②的正反应速率和逆反应速率均增加,故A错误;
B.根据质量守恒,混合气体的质量始终不变,容器体积不变,则气体的密度始终不变,当气体的密度不再改变,不能表明反应已达到平衡状态,故B错误;
C.加入催化剂不改变化学平衡,则H2的平衡转化率不变,故C正确;
D.温度为T1时,反应达到平衡状态,正逆反应速率相等,则v正=k正⋅c(CO2)⋅c3(H2)=v逆=k逆⋅c(CH3OH)⋅c(H2O),反应①的化学平衡常数K=c(CH3OH)⋅c(H2O)c(CO2)⋅c3(H2)=k正k逆=1,故D正确;
故答案为:CD;
(4)①反应②反应前后气体分子数不变,反应①反应前后气体分子数减少,增大压强反应①的平衡正向移动,CO2的平衡转化率增大,则p3>p2>p1,反应①是放热反应,反应②是吸热反应,温度高于570℃之后,以反应②为主,反应②是吸热反应,温度升高平衡正向移动,CO2的平衡转化率增大,
故答案为:p3>p2>p1;温度高于570℃之后,反应②是吸热反应,以反应②为主,温度升高平衡正向移动;
②按照n(CO2):n(H2)=1:3投料,M点(500,60),即CO2的平衡转化率为60%,又甲醇的选择性为23,则按投入1mlCO2计算,有0.6ml×23=0.4ml转化为甲醇,0.2ml转化为CO,列出三段式:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
开始(ml)1300
变化(ml)
平衡(ml)
CO2(g)+H2(g)⇌CO(g)+H2O(g)
开始(ml)1300
变化(ml)
平衡(ml)
平衡时n(总)=(0.4+1.6+0.4+0.2+0.6)ml=3.2ml,p(CO2)=0.43.2×0.1MPa=0.0125MPa,同理p(H2)=0.05MPa,p(CH3OH)=0.0125MPa,p(H2O)=0.01875MPa,则反应①的压强平衡常数Kp=p(CH3OH)⋅p(H2O)p(CO2)⋅p3(H2)=0.0125××0.053(MPa)−2=150(MPa)−2,
故答案为:150;
(4)由图可知,在阴极上CO2被还原为乙烯,酸性介质,则阴极电极反应式为2CO2+12H++12e−=CH2=CH2+4H2O,
故答案为:2CO2+12H++12e−=CH2=CH2+4H2O。
(1)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ⋅ml−1
③CO(g)+2H2(g)⇌CH3OH(g)ΔH=−90.6kJ⋅ml−1
根据盖斯定律:②+③得①;
(2)反应①为放热反应,升高温度,反应速率加快,速率常数也增大,且平衡逆向移动,则逆反应速率增大的幅度大于正反应速率;
(3)A.反应物浓度增大,反应速率加快;
B.变量不变即为平;
C.加入催化剂不改变化学平衡;
D.温度为T1时,反应达到平衡状态,正逆反应速率相等,则v正=k正⋅c(CO2)⋅c3(H2)=v逆=k逆⋅c(CH3OH)⋅c(H2O),反应①的化学平衡常数K=c(CH3OH)⋅c(H2O)c(CO2)⋅c3(H2)=k正k逆;
(4)①反应②反应前后气体分子数不变,反应①反应前后气体分子数减少,增大压强反应①的平衡正向移动,CO2的平衡转化率增大;反应①是放热反应,反应②是吸热反应,温度高于570℃之后,以反应②为主;
②按照n(CO2):n(H2)=1:3投料,M点(500,60),即CO2的平衡转化率为60%,又甲醇的选择性为23,则按投入1mlCO2计算,有0.6ml×23=0.4ml转化为甲醇,0.2ml转化为CO,列出三段式计算;
(5)由图可知,在阴极上CO2被还原为乙烯,酸性介质,由此可写出阴极电极反应式。
本题考查化学反应原理,涉及反应热的计算、平衡状态的判定、平衡的移动、有关化学平衡的计算及电极反应式的书写等,题目中等难度。
20.【答案】碳溴键、酯基 取代反应 8 C10H14O3 6 (任写一种)
【解析】解:(1)试剂BrCH2COOCH3所含官能团的名称为碳溴键、酯基,
故答案为:碳溴键、酯基;
(2)A→B的反应类型为取代反应,C的分子中含有8种氢原子,所以C的核磁共振氢谱图上峰的组数为8,
故答案为:取代反应;8;
(3)B→C的化学方程式为,
故答案为:;
(4)D的分子式为C10H14O3,D→△Cu/O2E,E的结构式为,
故答案为:C10H14O3;;
(5)化合物B的芳香族同分异构体同时满足如下条件:
a.苯环上只有两个取代基;
b.能与新制Cu(OH)2反应,产生砖红色沉淀,说明含有醛基;
c.与FeCl3发生显色反应,说明含有酚羟基;
d.最多能与2倍物质的量的NaOH反应,应该含有HCOOCH2CH2−或HCOOCH(CH3)−,符合条件的同分异构体有,所以有6种,
故答案为:6;(任写一种);
(6)以苯酚和乙醇为起始原料制备苯氧乙酸,乙醇被氧化生成乙酸,乙酸发生信息①的反应生成ClCH2COOH,苯酚和NaOH反应生成苯酚钠,ClCH2COOH和苯酚钠发生A→B类型的反应得到目标产物,合成路线为,
故答案为:。
A发生取代反应生成B,B发生加成反应生成C,C发生还原反应生成D;
(6)以苯酚和乙醇为起始原料制备苯氧乙酸,乙醇被氧化生成乙酸,乙酸发生信息①的反应生成ClCH2COOH,苯酚和NaOH反应生成苯酚钠,ClCH2COOH和苯酚钠发生A→B类型的反应得到目标产物。
本题考查有机物的合成,侧重考查分析、判断及知识综合运用能力,正确推断各物质的结构简式是解本题关键,采用知识迁移、逆向思维方法进行合成路线设计,题目难度中等。选项
劳动项目
化学知识
A
用秸秆生产燃料乙醇
淀粉水解产生葡萄糖
B
用波尔多液防治农作物灾害
重金属离子可使蛋白质变性
C
用废弃的植物油或动物脂肪制肥皂
油脂在碱性条件下可以水解
D
用核酸检测诊断新冠肺炎等传染病
聚合酶链反应可在生物体外扩增DNA片段
物质
Ksp
MnS
2.5×10−10
PbS
8.0×10−28
NiS
3.2×10−19
2022-2023学年陕西省西安市高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年陕西省西安市高二(下)期末化学试卷(含详细答案解析),共30页。试卷主要包含了单选题,简答题,推断题等内容,欢迎下载使用。
2022-2023学年甘肃省兰州市等5地高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年甘肃省兰州市等5地高二(下)期末化学试卷(含详细答案解析),共19页。试卷主要包含了单选题,流程题,简答题等内容,欢迎下载使用。
2022-2023学年广东省广州市三校高二(下)期末联考化学试卷(含解析): 这是一份2022-2023学年广东省广州市三校高二(下)期末联考化学试卷(含解析),共25页。试卷主要包含了单选题,实验题,简答题,推断题等内容,欢迎下载使用。












