

2022-2023学年福建省福州市八县(市)协作校高二(下)期末化学试卷(含详细答案解析)
展开1.镁在二氧化碳中燃烧的化学方程式为2Mg+CO22MgO+C。下列说法正确的是( )
A. 二氧化碳的电子式为
B. 基态氧原子的价层电子排布式为1s22s22p4
C. 二氧化碳分子中的碳原子采取sp2杂化方式
D. 元素的电负性:Mg
A. H2O2和C2H2均为直线形的非极性分子
B. SiO32−和SO32−的空间结构均为平面三角形
C. 邻羟基苯甲酸沸点比对羟基苯甲酸沸点高
D. H2S和NH3均是极性分子,且H2S分子的键角较小
3.下列有机物的命名正确的是( )
A. 2−乙基丙烷
B. 3,4,4−三甲基己烷
C. 2−甲基−4−戊炔
D. 2−甲基−1,4−戊二烯
4.一种熔融碳酸盐燃料电池原理如图所示。下列说法正确的是( )
A. 电子从电极A经熔融碳酸盐转移到电极BB. 熔融碳酸盐中CO32−向电极A移动
C. CH4在电极A放电生成CO2D. 反应过程熔融盐中CO32−的物质的量增加
5.维生素C可参与机体的代谢过程,俗称抗坏血酸,结构如图。下列说法正确的是( )
A. 维生素C的分子式为C6H4O6
B. 维生素C分子中含有3个手性碳原子
C. 维生素C分子中C原子有sp2、sp3两种杂化方式
D. 维生素C含碳原子较多,故难溶于水
6.如图是CaF2晶胞的结构。下列说法正确的是( )
A. 一个CaF2晶胞中含有8个F−
B. 一个CaF2晶胞中含有8个Ca2+
C. 在CaF2晶胞中Ca2+的配位数为4
D. 在CaF2晶胞中,每个Ca2+周围距离最近且等距离的Ca2+有8个
7.己二酸是一种重要的化工原料,合成途径有如下两种:
途径一:
途径二:
下列说法不正确的是( )
A. 苯与溴水混合充分振荡后静置,上层溶液呈橙红色
B. 环己醇与乙醇互为同系物
C. 苯分子中所有原子共平面
D. 与途径一相比,途径二可减少污染物排放
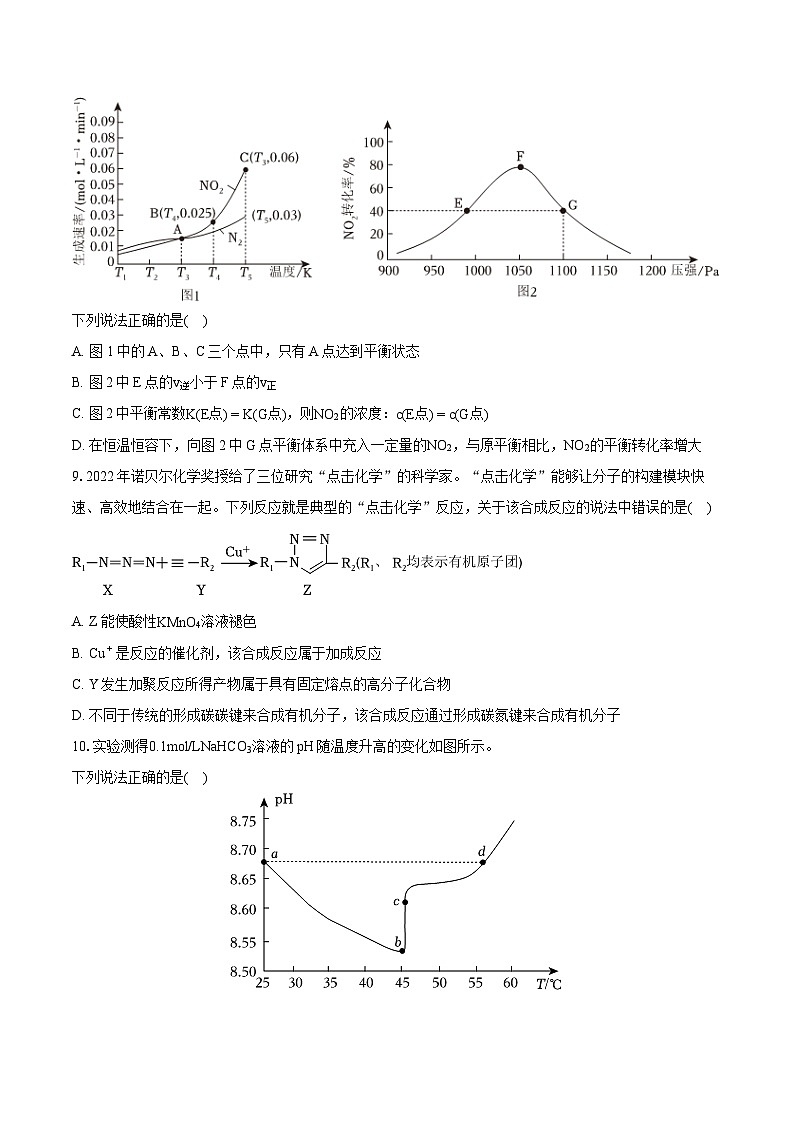
8.用活性炭还原NO2可防止空气污染,其反应原理为2C(s)+2NO2(g)⇌N2(g)+2CO2(g)。在密闭容器中,1mlNONO2和足量碳发生该反应,反应相同时间内,测得NO2的生成速率与N2的生成速率随温度变化的关系如图1所示。维持温度不变,反应相同时间内,测得NO2的转化率随压强的变化如图2所示。
下列说法正确的是( )
A. 图1中的A、B、C三个点中,只有A点达到平衡状态
B. 图2中E点的v逆小于F点的v正
C. 图2中平衡常数K(E点)=K(G点),则NO2的浓度:c(E点)=c(G点)
D. 在恒温恒容下,向图2中G点平衡体系中充入一定量的NO2,与原平衡相比,NO2的平衡转化率增大
9.2022年诺贝尔化学奖授给了三位研究“点击化学”的科学家。“点击化学”能够让分子的构建模块快速、高效地结合在一起。下列反应就是典型的“点击化学”反应,关于该合成反应的说法中错误的是( )
A. Z能使酸性KMnO4溶液褪色
B. Cu+是反应的催化剂,该合成反应属于加成反应
C. Y发生加聚反应所得产物属于具有固定熔点的高分子化合物
D. 不同于传统的形成碳碳键来合成有机分子,该合成反应通过形成碳氮键来合成有机分子
10.实验测得0.1ml/LNaHCO3溶液的pH随温度升高的变化如图所示。
下列说法正确的是( )
A. a∼b,HCO3−的水解程度增大
B. 由a点可知Ka1(H2CO3)⋅Ka2(H2CO3)>Kw
C. b∼c,可能发生反应:HCO3−⇌CO32−+CO2↑+H2O
D. a点溶液和d点溶液的c(OH−)相同
二、实验题:本大题共1小题,共17分。
11.碳化镁(MgC2)可用于制备乙炔(C2H2)。
制备MgC2的原理是Mg+C2H4 500℃MgC2+2H2以海水为原料制备碳化镁的工艺如图:
(1)该流程从海水转化为MgCl2溶液的目的是______。
(2)电解熔融MgCl2时,阳极的电极反应式为______。
(3)实验室制备HCl的一种原理是2NaCl+H2SO4(浓)Na2SO4+2HCl↑,从图1中选择装置制备并收集一瓶纯净的氯化氢。
①C装置中盛放NaCl的仪器名称为______。
②按气流从左至右,装置中导管口连接顺序为e→______ (填管口字母代号)。
③D装置中球形干燥管的作用是______;本实验利用利用浓硫酸的性质有______ (填字母)。
a.难挥发性
b.强氧化性
c.吸水性
(4)制备碳化镁的装置如图2所示(装置中试剂均足量)。已知:,副产物有CO2、SO2等。
①B装置的作用是______。 C装置中盛装的试剂是______。 F装置中集气瓶收集的气体有(除水蒸气外)______ (填化学式)。
②根据下列“物理量”可以计算MgC2质量的是______ (填字母)。
a.乙醇的体积和密度
b.乙烯体积(标准状况)
c.镁的质量
d.浓硫酸的体积和密度
三、简答题:本大题共3小题,共43分。
12.镍与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为______,占据最高能级的电子云轮廓图形状为______。
(2)镓失去电子的逐级电离能(单位:kJ/ml)的数值依次为577、1984.5、2961.8、6192,由此可推知镓的主要化合价为______和+3。
(3)Ga、As、Se的第一电离能由大到小的顺序是______。
(4)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:______。
(5)AsH3的沸点比NH3低,原因是______。
(6)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______。
(7)砷化镓晶胞结构如图所示,晶胞参数为a=565pm,熔点为1238℃。其固体属于______晶体,晶体的密度为______ g/cm3(设NA为阿伏加德罗常数的数值,列出算式即可)。
13.三氧化钼(MO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MS2(s)⇌M(s)+S2(g)△H1
②S2(g)+2O2(g)=2SO2(g)△H2
③2M(s)+3O2(g)=2MO3(s)△H3
则2MS2(s)+7O2(g)=2MO3(s)+4SO2(g)的△H=______ (用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MS2(s)=M(s)+S2(g)。
①下列说法不正确的是______ (填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MS2的质量,平衡向正反应方向移动
②达到平衡时S:x(g)的浓度为1.4ml/L,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______ 1.4ml/L(填“>”“<“或“=”)。
(3)在2L恒容密闭容器中充入1.0mlS2(g)和1.5mlO2(g),若仅发生反应S2+2O2⇌2SO2,5min后反应达到平衡,此时容器压强为起始时的80%,则0∼5min内,O2的反应速率为______ ml/(L⋅min),S2的平衡转化率为______。
(4)在密闭容器中,加入足量的MS2和O2,仅发生反应:2MS2(s)+7O2(g)=2MO3(s)+4SO2(g)△H。测得氧气的平衡转化率与压强、温度的关系如图所示。
①△H______ 0(填“>”、“<“或“=“);比较p1、p2、p3的大小:______。
②若初始时通入7.0mlO2,p2为7.0kPa,则A点平衡常数Kp=______ (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
14.温度感受器的发现与辣椒素有关。辣椒素1的一种合成路线如图(部分试剂或产物略)。
已知:R1−CH2Br→Witting反应R2−CHOR1−CH=CH−R2,请回答下列问题:
(1)①A的分子式为______;
②由A生成B的反应类型为______;
(2)①D中的官能团名称为______;
②C的结构简式为______。
(3)F→G的化学反应方程式为______。
(4)G的同分异构体中,同时符合下列条件的有______种(不含立体异构),其中核磁共振氢谱为五组峰的同分异构体的结构简式为______。
①能与FeCl3溶液发生显色反应;
②能与饱和碳酸氢钠溶液反应放出气体;
③苯环上只有两个取代基。
答案和解析
1.【答案】D
【解析】解:A.二氧化碳的电子式为:,故A错误;
B.基态氧原子的价层电子排布式为:2s22p4,故B错误;
C.二氧化碳分子中中心原子的价电子对数为4+02=2,因此碳原子采取sp杂化方式,故C错误;
D.同一周期从左到右元素的电负性逐渐增大,同一主族从上到下元素的电负性逐渐减小,因此元素的电负性:Mg
A.二氧化碳的电子式中O原子不满足8电子稳定结构;
B.题中给出的是基态氧原子的核外电子排布式而不是价电子排布式;
C.二氧化碳分子为直线形分子,采取sp杂化方式;
D.同一周期从左到右元素的电负性逐渐增大,同一主族从上到下元素的电负性逐渐减小。
本题主要考查原子核外电子排布式、电子式的书写及原子轨道杂化类型等知识,为高频考点,题目难度不大。
2.【答案】D
【解析】解:A.H2O2是极性分子,故A错误;
B.SiO32−的空间结构为三角锥形,故B错误;
C.邻羟基苯甲酸易形成分子内氢键,而对羟基苯甲酸易形成分子内氢键,故邻羟基苯甲酸沸点比对羟基苯甲酸沸点低,故C错误;
D.H2S和NH3均是极性分子,且H2S分子的键角较小,故D正确,
故选:D。
A.H2O2是极性分子;
B.SiO32−的空间结构为三角锥形;
C.邻羟基苯甲酸易形成分子内氢键,而对羟基苯甲酸易形成分子内氢键;
D.H2S和NH3均是极性分子,且H2S分子的键角较小。
本题主要考查微粒的结构和性质,题目难度不大,掌握基础知识是解答该题的关键。
3.【答案】D
【解析】解:A.命名为:2−甲基丁烷,故A错误;
B.应命名为:3,3,4−三甲基己烷,故B错误;
C.应命名为:4−甲基−1−戊炔,故C错误;
D.命名为:2−甲基−1,4−戊二烯,故D正确;
故选:D。
A.选择最长的碳链(含4个碳)做主链,从左至右给碳编号1−4,主链命名为丁烷;
B.选择最长的碳链(含6个碳)做主链,从左至右给碳编号1−6,主链命名为己烷,3号碳两个甲基,4号碳一个甲基;
C.选择官能团碳碳三键及最长的碳链从左至右给碳编号1−5,主链命名为戊炔,支链甲基在4号碳上;
D.选择官能团碳碳双键且带支链的一端给最长的碳链从右至左给碳编号1−5,主链命名为戊二烯。
本题考查有机物的系统命名法,选择最长的碳链(无官能团)确定主链并给碳原子标序号是关键,有官能团需根据主要官能团确定最长的碳链做主链再进行编号,再确定支链,最后准确的对有机物进行命名,题目难度不大。
4.【答案】B
【解析】解:A.电子从负极流向正极,故电子从电极A经导线转移到电极B,不能通过熔融碳酸盐,故A错误;
B.阴离子向负极移动,即熔融碳酸盐中CO32−向电极A移动,故B正确;
C.CO和H2在负极反应,被氧化生成二氧化碳和水,故C错误;
D.负极电极A反应为H2+CO+2CO32−−4e−=H2O+3CO2,正极为氧气得电子生成CO32−,反应为O2+2CO2+4e−=2CO32−,电子守恒可知电池工作时,电池内部CO32−的物质的量不变,故D错误;
故选:B。
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由−4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2在负极发生反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32−,电子从负极流向正极,阴离子向负极移动,以此解答该题。
本题考查了化学电源新型电池,侧重分析和灵活运用能力的考查,把握电极的判断、电子或离子的移动方向、电极反应及电极反应式的书写为解题关键,注意结合电解质的酸碱性条件下写出电极反应式,题目难度中等。
5.【答案】C
【解析】解:A.由图可知,维生素C的分子式为C6H8O6,故A错误;
B.分子中连四个不同的基团的碳原子是手性碳原子,维生素C分子中的手性碳原子如图所示,,含有2个手性碳,故B错误;
C.维生素C分子中C原子形成4个单键是sp3杂化,形成一个双键两个单键的是sp2杂化,所以C原子有sp2、sp3两种杂化方式,故C正确;
D.维生素C含羟基较多,羟基具有亲水性故易溶于水,故D错误;
故选:C。
A.由图可知,维生素C的分子式;
B.分子中连四个不同的基团的碳原子是手性碳原子;
C.维生素C分子中C原子形成4个单键是sp3杂化,形成一个双键两个单键的是sp2杂化;
D.维生素C含羟基较多。
本题考查有机物的结构与性质,侧重考查学生有机基础知识的掌握情况,试题难度中等。
6.【答案】A
【解析】解:A.氟离子在该晶胞的内部,所以氟离子个数是8,故A正确;
B.在CaF2晶胞中,钙离子位于顶点和面心,该晶胞中含有钙离子个数=8×18+6×12=4,故B错误;
C.在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,故C错误;
D.在CaF2晶胞中,钙离子位于顶点和面心,每个Ca2+周围距离最近且等距离的Ca2+有12个,故D错误;
故选:A。
利用均摊法确定每个晶胞中含有的钙离子、氟离子个数,采用沿X、Y、Z三轴切割法确定每种离子的配位数。
本题考查了晶胞中离子个数的判断及配位数的计算,会利用均摊法确定晶胞中含有原子或离子的个数,会利用采用沿X、Y、Z三轴切割法确定每种微粒的配位数,难度较大。
7.【答案】D
【解析】解:A.苯的密度小于水,所以苯萃取溴水中的溴后分层,上层溶液呈橙红色,故A错误;
B.环己醇为环状结构、乙醇为链状结构,二者结构不相似,所以二者不互为同系物,故B错误;
C.环己烷中所有碳原子都采用sp3杂化,导致所有碳原子都具有甲烷结构特点,甲烷分子中最多有3个原子共平面,则环己烷中所有原子一定不共平面,故C错误;
D.途径一中步骤多,且反应中还生成N的化合物,途径二步骤少且可减少污染物排放,故D正确;
故选:D。
A.苯的密度小于水;
B.结构相似,在分子组成上相差一个或n个CH2原子团的有机物互为同系物;
C.环己烷中所有碳原子都采用sp3杂化,导致所有碳原子都具有甲烷结构特点,甲烷分子中最多有3个原子共平面;
D.途径一中步骤多,且反应中还生成N的化合物。
本题考查有机物的结构和性质,侧重考查分析、判断及知识综合运用能力,明确萃取原理、同系物概念内涵、原子共平面判断的方法等知识点是解本题关键,题目难度不大。
8.【答案】B
【解析】解:A.反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),即平衡时,NO2的生成速率应是N2的生成速率的2倍,只有C点满足条件,达到平衡状态,故A错误;
B.该反应是气体体积增大的反应,增大压强,平衡逆向移动,NO2的转化率减小,故图2中E到F段曲线还未达到平衡状态,v逆逐渐增大,F恰好达到平衡状态,此时v正=v逆,故E点的v逆小于F点的v正,故B正确;
C.平衡常数K只与温度有关,温度不变,K不变,E点和G点温度相同,故K(E)=K(G),但E点和G点压强不同,气体浓度与压强有关,压强越大,容器体积越小,浓度越大,即c(E)
故选:B。
A.反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质);
B.该反应是气体体积增大的反应,增大压强,平衡逆向移动,NO2的转化率减小,据此分析图2中E点和F点的反应状态,从而得到速率的变化;
C.平衡常数K只与温度有关,温度不变,K不变,而气体浓度与压强有关,压强越大,容器体积越小,浓度越大;
D.反应物浓度增大,平衡正向移动,但与原平衡相比,等效于加压。
本题考查化学平衡图象、平衡移动原理等,锻炼学生的理解、分析、判断能力,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响,明确图象中纵横坐标及点、线、面的意义,题目难度中等。
9.【答案】C
【解析】解:A.碳碳双键能使酸性高锰酸钾褪色,Z中含有碳碳双键,能使酸性KMnO4溶液褪色,故A正确;
B.由方程式可知Cu+是反应的催化剂,该合成反应是通过形成碳氮键来合成有机分子的,属于加成反应,故B正确;
C.Y发生加聚反应所得产物为高聚物,属于混合物,没有固定熔点的高分子化合物,故C错误;
D.由图可知,该反应为加成反应,该合成反应是通过形成碳氮键来合成有机分子的,故D正确;
故选:C。
A.碳碳双键能使酸性高锰酸钾褪色;
B.由方程式可知Cu+是反应的催化剂,该合成反应是通过形成碳氮键来合成有机分子的;
C.Y发生加聚反应所得产物为高聚物,属于混合物;
D.由图可知,该反应为加成反应,通过形成碳氮键来合成。
本题考查有机反应,侧重考查学生反应机理的掌握情况,试题难度中等。
10.【答案】B
【解析】解:A.由图可知,a∼b段pH减小,升高温度促进水的电离,HCO3−的水解程度受抑制,故A错误;
B.a点水解显碱性,则Ka2(H2CO3)>Kh(HCO3−)=KWKa1(H2CO3),即Ka1(H2CO3)⋅Ka2(H2CO3)>Kw,故B正确;
C.b点升高温度时部分碳酸氢钠分解生成碳酸钠,则b∼c,可能发生的离子反应为2HCO3−⇌CO32−+CO2↑+H2O,故C错误;
D.a点溶液含碳酸氢钠,d点溶液含碳酸氢钠、碳酸钠,且碳酸钠的水解程度大,则a点溶液和d点溶液的c(OH−)不同,故D错误;
故选:B。
A.由图可知,a∼b段pH减小,升高温度促进水的电离;
B.a点水解显碱性,则Ka2(H2CO3)>Kh(HCO3−);
C.b点升高温度时部分碳酸氢钠分解生成碳酸钠;
D.a点溶液含碳酸氢钠,d点溶液含碳酸氢钠、碳酸钠,且碳酸钠的水解程度大。
本题考查盐类水解,为高频考点,把握图中pH的变化、盐类水解的规律及影响因素为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大。
11.【答案】氯化镁富集 2Cl−−2e−=Cl2 圆底烧瓶 b→a→c→d→f防倒吸 a 除CO2、SO2 浓硫酸 H2、C2H4 c
【解析】解:(1)海水中氯化镁的浓度低,从海水转化为MgCl2溶液的目的是使氯化镁富集,
故答案为:氯化镁富集;
(2)电解池的阳极发生氧化反应,电解熔融MgCl2时,阳极氯离子失电子生成氯气,电极反应式为:2Cl−−2e−=Cl2,
故答案为:2Cl−−2e−=Cl2;
(3)①根据仪器构造,C装置中盛放NaCl的仪器名称为圆底烧瓶,
故答案为:圆底烧瓶;
②C制取氯化氢,A干燥氯化氢,B收集氯化氢,D吸收氯化氢,防止污染,按气流从左至右,装置中导管口连接顺序为e→b→a→c→d→f,
故答案为:b→a→c→d→f;
③氯化氢极易溶于水,氯化氢溶于水易引起倒吸,D装置中球形干燥管的作用是防倒吸;本实验利用的是高沸点酸制低沸点酸的原理,利用浓硫酸的难挥发性,选a,
故答案为:防倒吸;a
(4)①A生成的乙烯气体中含有CO2、SO2等杂质,B中盛放氢氧化钠溶液,B装置的作用是除CO2、SO2。C的作用是干燥乙烯气体,装置中盛装的试剂是浓硫酸。镁和乙烯反应生成MgC2和氢气,所以F装置中集气瓶收集的气体有(除水蒸气外)H2、C2H4,
故答案为:除CO2、SO2;浓硫酸;H2、C2H4;
②a.乙醇和浓硫酸反应有副产物生成,所以不能用乙醇的体积和密度计算MgC2质量;b.乙烯只有部分参与和镁的反应,不能根据乙烯体积计算MgC2质量;c.根据元素守恒,根据镁的质量可计算MgC2质量;d.浓硫酸作催化剂,不能根据浓硫酸的体积和密度计算MgC2质量,故选c,
故答案为:c。
镁和纯净的乙烯反应生成碳化镁,A生成的乙烯气体中含有CO2、SO2等杂质,B中盛放氢氧化钠溶液除CO2、SO2,C干燥乙烯,D中镁和乙烯反应生成MgC2和氢气,E防止F中水蒸气进入D,所以F装置收集氢气、乙烯。
本题主要考查了制备实验方案的设计,属于高频考点,需要边思考、边分析,熟悉制备流程、实验装置图是解题关键,侧重考查分析能力,题目难度一般。
12.【答案】[Ar]3d104s24p1 哑铃形 +1As>Se>GaGaCl3、GaBr3、GaI3的熔、沸点依次升高,它们均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强 NH3分子之间存在氢键 4sp2 共价 580NA×(5.65×10−8)3
【解析】解:(1)Ga为31号元素,位于周期表中第四周期第ⅢA族,核外电子排布式为[Ar]3d104s24p1;,最高能级为4p,电子云轮廓图为哑铃形,
故答案为:[Ar]3d104s24p1;哑铃形;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3,
故答案为:+1;
(3)同一周期元素从左向右第一电离能呈增大趋势,但第ⅡA族、第ⅤA族第一电离能大于其相邻元素,故第一电离能由大到小顺序是:As>Se>Ga,
故答案为:As>Se>Ga;
(4)根据三种卤化物的熔沸点分析,三种卤化物的熔沸点均较低,说明都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,
故答案为:GaCl3、GaBr3、GaI3的熔、沸点依次升高,它们均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强;
(5)NH3分子之间存在氢键,所以AsH3的沸点比NH3低,
故答案为:NH3分子之间存在氢键;
(6)从二水合草酸镓的结构图可知,镓原子与4个O原子成键,配位数为4;草酸根中碳原子形成3个σ键,价层电子对数为3,为sp2杂化,
故答案为:4;sp2;
(7)由砷化镓晶胞可知,As和Ga形成空间网状结构,熔点为1238℃,比较高,砷化镓晶体为共价晶体;4个As位于体内,Ga位于顶点和面心,个数为8×18+6×12=4,晶胞的质量为4×(70+75)NAg,晶胞的体积为(5.65×10−8)3cm3,晶体密度ρ=mV=4×(70+75)NA(5.65×10−8)3g/cm3=580NA×(5.65×10−8)3g/cm3,
故答案为:共价;580NA×(5.65×10−8)3。
(1)Ga为31号元素,位于周期表中第四周期第ⅢA族;最高能级为4p;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难;
(3)同一周期元素从左向右第一电离能呈增大趋势,但第ⅡA族、第ⅤA族第一电离能大于其相邻元素;
(4)三种卤化物的熔沸点均较低,说明都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;
(5)NH3分子之间存在氢键;
(6)从二水合草酸镓的结构图可知,镓原子与4个O原子成键;草酸根中碳原子形成3个σ键;
(7)根据砷化镓晶体结构和熔点判断晶体类型;由砷化镓晶胞可知,有4个As位于体内,Ga位于顶点和面心,个数为8×18+6×12=4,晶胞的质量为4×(70+75)NAg,晶胞的体积为(5.65×10−8)3cm3,根据ρ=mV计算晶体密度。
本题考查物质结构和性质,侧重考查分析、判断及知识综合运用能力,明确原子结构、元素周期律、原子杂化类型判断方法、晶胞计算方法是解本题关键,难点是晶胞密度的计算,题目难度中等。
13.【答案】2△H1+2△H2+△H3 c=0.0550%
【解析】解:(1)①MS2(s)⇌M(s)+S2(g)△H1;②S2(g)+2O2(g)⇌2SO2(g)△H2;③2M(s)+3O2(g)⇌2MO3(s)△H3将方程式2(①+②)+③得方程式2MS2(s)+7O2(g)⇌2MO3(s)+4SO2(g)△H=2△H1+2△H2+△H3,
故答案为:2△H1+2△H2+△H3;
(2)①a.反应前后气体总质量增加、容器体积不变,则反应前后气体的密度增大,当气体密度不变时反应达到平衡状态,故a正确;
b.气体的相对分子质量始终不变,所以气体的相对分子质量不变,反应不定处于 平衡状态,故b正确;
c.MS2是固体,不影响平衡移动,故c错误;
故答案为:c;
②K=c(S2),温度不变化学平衡常数不变,则c(S2)不变,
故答案为:=;
(3)恒温恒容条件下气体压强之比等于气体物质的量之比,平衡时混合气体总物质的量=2.5ml×80%=2ml,根据方程式知,混合气体在反应前后减少的物质的量等于参加反应的n(S2)=(2.5−2)ml=0.5ml,0∼5min内,v(S2)=△nV△t;=0.525ml/(L.min)=0.05ml/(L.min),S2的转化率为0.5ml1ml×100%=50%,
故答案为:0.05;50%;
(4)①升高温度氧气转化率降低,说明平衡逆向移动,则正反应为放热反应,△H<0;增大压强平衡正向移动,氧气转化率增大,则压强p1>p2>p3,
故答案为:<;p1>p2>p3;
②若初始时通入7.0mlO2,p2为7.0kPa,A点氧气转化率为50%,则消耗的n(O2)=7ml×50%=3.5ml,
可逆反应2MS2(s)+7O2(g)⇌2MO3(s)+4SO2(g)
开始(ml)70
反应(ml)3.52
平衡(ml)3.52
恒温恒容时氧气之比等于气体物质的量之比,则平衡压强为5.5kPa,P(O2)=×5.5kPa=3.5kPa,P(SO2)=2ml5.5ml×5.5kPa=2kPa,则A点平衡常数Kp=P4(SO2)P7(O2)=(2kPa)4(3.5kPa)7=21177(kPa)−3,
故答案为:21177(kPa)−3。
(1)①MS2(s)⇌M(s)+S2(g)△H1;②S2(g)+2O2(g)⇌2SO2(g)△H2;③2M(s)+3O2(g)⇌2MO3(s)△H3将方程式2(①+②)+③得方程式2MS2(s)+7O2(g)⇌2MO3(s)+4SO2(g)△H进行相应的改变;
(2)①a.反应前后气体总质量增加、容器体积不变,则反应前后气体的密度增大;
b.气体的相对分子质量始终不变;
c.MS2是固体,不影响平衡移动;
②K=c(S2),温度不变化学平衡常数不变;
(3)恒温恒容条件下气体压强之比等于气体物质的量之比,平衡时混合气体总物质的量=2.5ml×80%=2ml,根据方程式知,混合气体在反应前后减少的物质的量等于参加反应的n(S2)=(2.5−2)ml=0.5ml,S2的转化率为变化量比上起始量,0∼5min内,v(S2)=△nV△t;
(4)①升高温度氧气转化率降低,说明平衡逆向移动,则正反应为放热反应;增大压强平衡正向移动,氧气转化率增大;
②若初始时通入7.0mlO2,p2为7.0kPa,A点氧气转化率为50%,则消耗的n(O2)=7ml×50%=3.5ml,列三段式计算,利用恒温恒容时氧气之比等于气体物质的量之比,则平衡压强为5.5kPa,P(O2)=×5.5kPa=3.5kPa,P(SO2)=2ml5.5ml×5.5kPa=2kPa,则A点平衡常数Kp=P4(SO2)P7(O2)。
本题考查化学平衡计算、盖斯定律等知识点,侧重考查化学平衡常数含义及其计算方法,明确化学平衡常数影响因素、压强化学平衡常数计算方法是解本题关键,注意(4)中计算Kp时要用平衡压强,为解答易错点。
14.【答案】C6H12O3 取代反应 碳碳双键、羧基 (CH3)2CHCHO 13
【解析】解:(1)①由A的结构简式可得A的分子式为:C6H12O3,
故答案为:C6H12O3;
②A与溴单质发生加成反应生成B,
故答案为:取代反应;
(2)①由D的结构简式可知其含有碳碳双键和羧基两种官能团,
故答案为:碳碳双键、羧基;
②由以上分析知C为(CH3)2CHCHO,
故答案为:(CH3)2CHCHO;
(3)F与CH3ONa发生取代反应生成,反应为,
故答案为:;
(4)G的同分异构体中,同时符合①能与FeCl3溶液发生显色反应,说明存在酚羟基结构;②能与饱和碳酸氢钠溶液反应放出气体,说明存在羧基,若苯环上两个支链则为−OH、−CH2COOH,有邻、间、对三种结构;若苯环上有三个支链则为−OH、−CH3、−COOH,结合定二移一的方法,先固定−OH、−CH3有邻、间、对三种结构,再分别连接−COOH,分别有4、4、2种位置,可知存在10种结构,共计13种符合;其中核磁共振氢谱为五组峰的结构简式,
故答案为:13;。
A发生取代反应生成B,B与C发生已知反应生成D,结合B和D的结构以及已知反应的成键断键结构可得C为:(CH3)2CHCHO,结合E、G的结构特点可知E与溴单质发生取代反应生成,F与CH3ONa发生取代反应生成,G在一定条件下转化成H,D和H发生取代反应生成I,据此分析解答。
本题考查有机物的合成,涉及有机物命名、有机反应类型、有机反应方程式书写、限制条件同分异构体书写等,注意根据结构变分析分析发生的反应,熟练掌握官能团的结构与性质。镓的卤化物
GaCl3
GaBr3
GaI3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
2022-2023学年安徽省合肥市六校联考高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年安徽省合肥市六校联考高二(下)期末化学试卷(含详细答案解析),共19页。试卷主要包含了单选题,多选题,简答题等内容,欢迎下载使用。
2022-2023学年陕西省西安市蓝田县两校联考高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年陕西省西安市蓝田县两校联考高二(下)期末化学试卷(含详细答案解析),共31页。试卷主要包含了单选题,实验题,简答题等内容,欢迎下载使用。
01,福建省福州市八县(市)协作校2023-2024学年高二上学期2月期末化学试题: 这是一份01,福建省福州市八县(市)协作校2023-2024学年高二上学期2月期末化学试题,共8页。











