

人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体达标测试
展开
这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体达标测试,共13页。试卷主要包含了单选题,填空题,解答题等内容,欢迎下载使用。
一、单选题
1.下列叙述正确的是()
A.金属受外力作用时常常发生变形而不易折断,这是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
2.铝钠合金有着广泛的应用,现有三种晶体:①铝、②钠、③铝钠合金,它们的熔点从低到高的顺序是()
A.①②③B.②①③C.③②①D.③①②
3.下列有关金属键和金属性质的叙述中,错误的是()
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的相互作用
C.自由电子吸收可见光后又迅速释放,使金属具有不透明性和金属光泽
D.金属的导热性和导电性都是通过自由电子的定向运动实现的
4.根据下列晶体的相关性质,判断可能属于金属晶体的是()
A.AB.BC.CD.D
5.下列关于金属晶体的叙述正确的是()
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体
C.Al、Na、Mg的熔点逐渐升高
D.温度越高,金属的导电性越好
6.物质结构理论推出:金属键越强,其金属的硬度越大,熔、沸点越高。且研究表明,一般来说,金属阳离子半径越小,所带电荷越多,则金属键越强,由此判断下列说法错误的是()
A.硬度:Mg>AlB.熔、沸点:Mg>Ca
C.硬度:Mg>KD.熔、沸点:Ca>K
7.下列叙述正确的是()
A.任何晶体中,若含有阳离子,就一定含有阴离子
B.金属晶体的形成是因为晶体中存在金属阳离子间的相互作用
C.价电子数越多,金属元素的金属性越强
D.含有金属元素的离子不一定是阳离子
8.要使金属熔化必须破坏其中的金属键,而原子化热是衡量金属键强弱的依据之一。下列说法正确的是()
A.金属镁的硬度大于金属铝
B.金属镁的熔点低于金属钙
C.金属镁的原子化热大于金属钠的原子化热
D.碱金属单质的熔点从到是逐渐升高的
9.下列生活中的问题,不能用金属键理论知识解释的是()
A.用铁制品做炊具B.铁易生锈
C.用铂金做首饰D.金属铝制成导线
10.金晶体的晶胞如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是()
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属于最密堆积,配位数是12
C.一个晶胞的体积是16d3
D.金晶体的密度是
11.下列叙述正确的是()
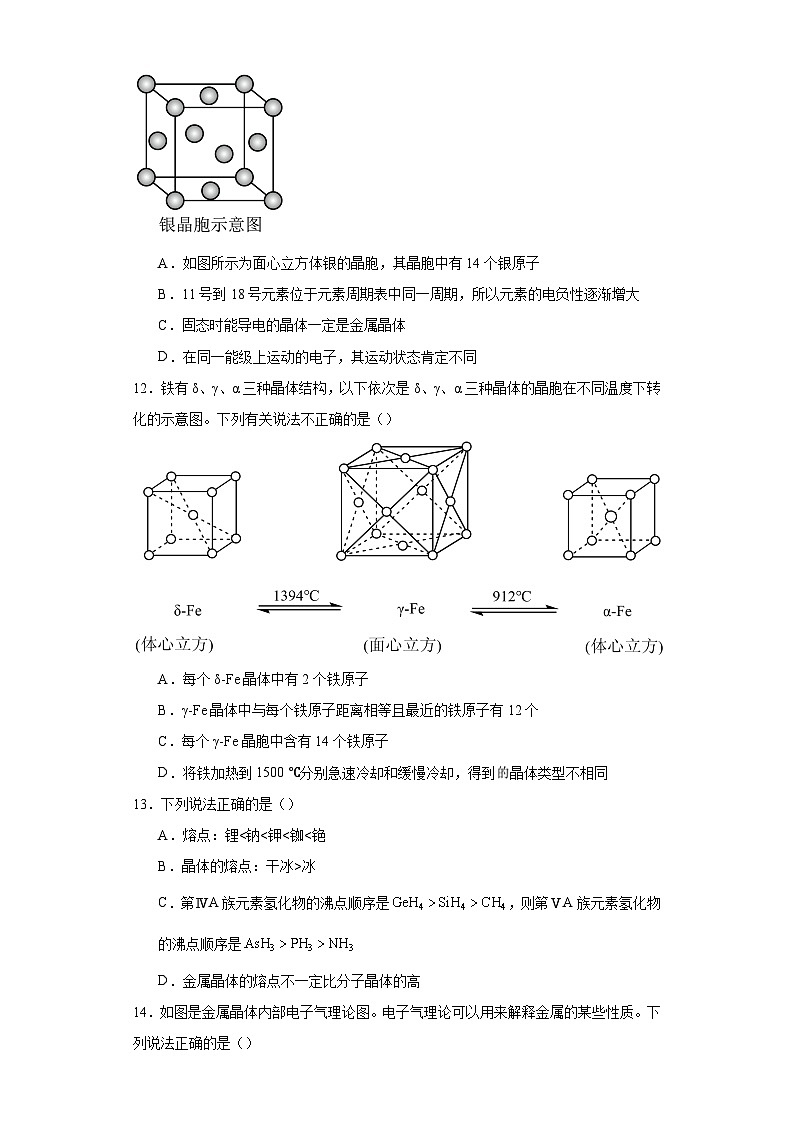
A.如图所示为面心立方体银的晶胞,其晶胞中有14个银原子
B.11号到18号元素位于元素周期表中同一周期,所以元素的电负性逐渐增大
C.固态时能导电的晶体一定是金属晶体
D.在同一能级上运动的电子,其运动状态肯定不同
12.铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体的晶胞在不同温度下转化的示意图。下列有关说法不正确的是()
A.每个δ-Fe晶体中有2个铁原子
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.每个γ-Fe晶胞中含有14个铁原子
D.将铁加热到1500 ℃分别急速冷却和缓慢冷却,得到晶体类型不相同
13.下列说法正确的是()
A.熔点:锂Na,其熔点的高低顺序为Al>Mg>Na,C错误;
D.金属的导电性随温度的升高而降低,温度越高,其导电性越差,D错误;
故选:B。
6.A
【分析】根据题目信息可知金属键越强,其金属的硬度越大,熔沸点越高,一般来说,金属离子半径越小,价电子数越多,金属键越强。
【详解】A、Mg、Al的电子层数相同,核电荷数大的离子半径小,价电子数Al>Mg,离子半径A13+<Mg2+,所以金属键Al>Mg,故Al的硬度大于Mg,A错误;
B、Mg、Ca价电子数相同,Ca的电子层数多,离子半径Ca2+>Mg2+,所以金属键Mg>Ca,故熔点Mg>Ca,B正确;
C、离子半径Mg2+<Na+<K+,所以金属键Mg>K,故硬度Mg>K,C正确;
D、Ca、K位于同一周期,价电子数Ca>K,离子半径K+>Ca2+,金属键Ca>K,故熔点Ca>K,D正确;
故选A。
7.D
【详解】A.金属晶体中存在阳离子,没有阴离子,A错误;
B.金属晶体的形成是因为晶体中存在金属阳离子与自由电子之间的相互作用,B错误;
C.价电子数多的金属元素的金属性不一定强,如Fe的价电子数比Na多,但Fe的金属性却没有Na的强,C错误;
D.含有金属元素的离子不一定是阳离子,如AlO是阴离子,D正确;
故选D。
8.C
【详解】A.镁离子比铝离子的半径大而所带的电荷数少,所以金属镁比金属铝的金属键弱,硬度小,A错误;
B.因镁离子的半径小而所带电荷数与钙离子相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔点高,B错误;
C.因镁离子的半径小而所带电荷数多,使金属镁比金属钠的金属键强,原子化热比钠大,C正确;
D.碱金属单质从到,其离子的半径是逐渐增大的,所带电荷数相同,金属键逐渐减弱,熔点逐渐降低,D错误;
故选C。
9.B
【详解】A.用铁制品做炊具是利用了金属的导热性,金属容易导热是因为自由电子在运动时经常与金属离子碰撞而引起热传递进行能量交换,能用金属键理论解释,故A不符合题意;
B.铁易生锈,是由于其易失去电子,与金属键无关,故B符合题意;
C.用铂金做首饰是因为有金属光泽,金属有金属光泽是因为自由电子能够吸收可见光,能用金属键理论解释,故C不符合题意;
D.金属铝制成导线是利用金属的导电性,金属中存在金属阳离子和自由移动的电子,当给金属通电时,自由电子发生定向移动产生电流而导电,能用金属键理论解释,故D不符合题意;
故选B。
10.C
【详解】A.金原子处于顶点与面心上,算晶胞中含有的金原子数目为8×+6×=4,A说法正确;
B.金晶体中,金属键无方向性,金原子采取面心立方最密堆积,配位数是12,B说法正确;
C.在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为×2d=d,故晶胞的体积为(d)3=2d3,C说法错误;
D.晶胞中含有4个原子,故晶胞质量为,晶胞的体积为2d3,故晶胞密度=,D说法正确;
答案为C。
11.D
【详解】A.用均摊法计算可知,银的晶胞中有8×+6×=4个银原子,故A错误;
B.11号到17号元素位于元素周期表中同一周期,同周期自左向右电负性逐渐增大,所以元素的电负性逐渐增大,但稀有气体元素的电负性不满足,故B错误;
C.固态时能导电的晶体不一定是金属晶体,例如石墨能导电,但石墨不是金属晶体,故C错误;
D.在同一能级上运动的电子,其自旋状态不同,故其运动状态肯定不同,故D正确;
故选D。
12.C
【详解】A.δ-Fe晶胞中,有8个铁原子位于顶点处,一个位于晶胞内,根据均摊法,一个晶胞中含有铁原子个数为,A正确;
B.γ-Fe位于顶点的Fe原子,被晶胞的三个平面共有,每个平面上有四个铁原子与顶点处铁原子距离最短,则共有3×4=12个,B正确;
C.γ-Fe晶胞中,有8个铁原子位于顶点,6个铁原子位于面心,根据均摊法,一个晶胞含有铁原子个数为,C错误;
D.依据得到晶体的条件可知,在急速冷却时(立即降温到912℃)得到α-Fe,缓慢冷却时(缓慢冷却到1394℃)得到γ-Fe,两种晶体类型不同,D正确;
故答案选C。
13.D
【详解】A.锂、钠、钾、铆、铯属于碱金属,其半径逐渐增大,其熔点应逐渐降低,A错误;
B.冰晶体中存在氢键,晶体的熔点:干冰;低于;NH3分子间能形成氢键,而PH3不能;
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为:棱长,Sn原子:8×=1,Cu原子:6×=3,P为1,化学式为:SnCu3P,摩尔质量为:342g/ml,1ml时的体积为:,晶胞的体积为:,棱长=cm,P与最近的Cu原子的核间距为××107nm,故答案为:正八面体;××107;
相关试卷
这是一份化学选择性必修1第三节 盐类的水解精品同步训练题,文件包含331盐类水解的原理-2023-2024学年高二化学同步精品讲义+习题人教版2019选择性必修1解析版docx、331盐类水解的原理-2023-2024学年高二化学同步精品讲义+习题人教版2019选择性必修1原卷版docx等2份试卷配套教学资源,其中试卷共44页, 欢迎下载使用。
这是一份高中化学实验活动3 糖类的性质精品巩固练习,文件包含第02单元烃B卷•提升能力-2022-2023学年高二化学同步单元AB卷人教版2019选择性必修3解析版doc、第02单元烃B卷•提升能力-2022-2023学年高二化学同步单元AB卷人教版2019选择性必修3原卷版doc等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体优秀随堂练习题,文件包含331金属键金属晶体基础过关A练-2022-2023学年高二化学课时过关提优AB练人教版2019选择性必修2解析版docx、331金属键金属晶体基础过关A练-2022-2023学年高二化学课时过关提优AB练人教版2019选择性必修2原卷版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。










