

东营市第一中学2023-2024学年高二下学期开学收心考试化学试卷(含答案)
展开
这是一份东营市第一中学2023-2024学年高二下学期开学收心考试化学试卷(含答案),共20页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
一、单选题
1.“嫦娥石”是中国首次在月球上发现的新矿物,其主要由Ca、Fe、P、O和Y(钇,原子序数比Fe大13)组成,下列说法正确的是( )
A.Y位于元素周期表的第ⅢB族
B.基态Ca原子的核外电子填充在6个轨道中
C.5种元素中,第一电离能最小的是Fe
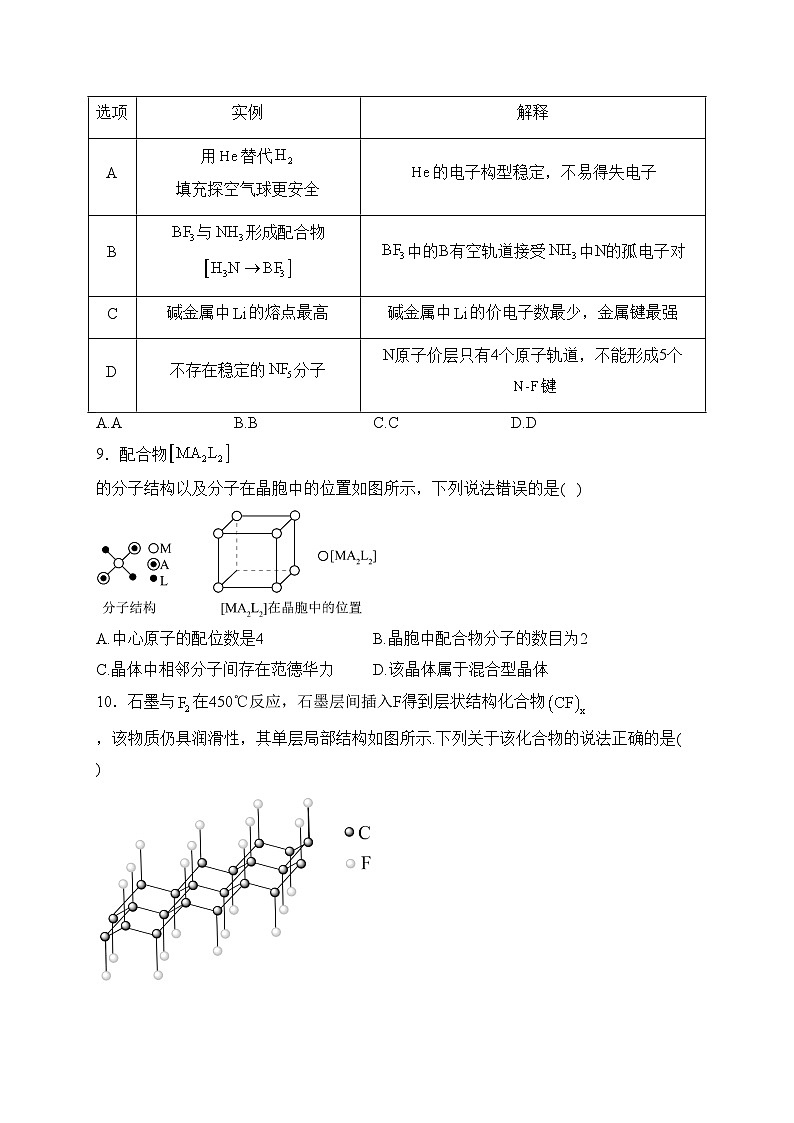
D.5种元素中,电负性最大的是P
2.下列有关元素单质或化合物的叙述正确的是( )
A.分子呈正四面体,键角为
B.NaCl焰色试验为黄色,与Cl电子跃迁有关
C.Cu基态原子核外电子排布符合构造原理
D.是由极性键构成的极性分子
3.X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正确的是( )
A.沸点:
B.M与Q可形成化合物、
C.化学键中离子键成分的百分数:
D.与离子空间结构均为三角锥形
4.某含锰着色剂的化学式为,Y、X、Q、Z为原子序数依次增大的短周期元素,其中具有正四面体空间结构,结构如图所示。下列说法正确的是( )
A.键角:B.简单氢化物沸点:
C.第一电离能:D.最高价氧化物对应的水化物酸性:
5.下列有关构造原理的说法错误的是( )
A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
B.某基态原子部分核外电子的排布式为
C.所有基态原子的核外电子排布都遵循构造原理
D.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序
6.元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )
A.原子半径:
B.第一电离能:
C.碳单质、晶体硅、SiC均为共价晶体
D.可在周期表中元素Si附近寻找新半导体材料
7.锆是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,为阿伏加德罗常数的值。下列说法错误的是( )
A.该氧化物的化学式为
B.该氧化物的密度为
C.Zr原子之间的最短距离为
D.若坐标取向不变,将p点Zr原子平移至原点,则q点Zr原子位于晶胞面的面心
8.物质的结构决定其性质。下列实例与解释不相符的是( )
A.AB.BC.CD.D
9.配合物的分子结构以及分子在晶胞中的位置如图所示,下列说法错误的是( )
A.中心原子的配位数是4B.晶胞中配合物分子的数目为2
C.晶体中相邻分子间存在范德华力D.该晶体属于混合型晶体
10.石墨与在450℃反应,石墨层间插入F得到层状结构化合物,该物质仍具润滑性,其单层局部结构如图所示.下列关于该化合物的说法正确的是( )
A.与石墨相比,抗氧化性增强
B.与石墨相比,导电性增强
C.中的键长比短
D.中含有共价单键
11.镧La和H可以形成一系列晶体材料,在储氢和超导等领域具有重要应用。属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是( )
A.晶体中La的配位数为8
B.晶体中H和H的最短距离:
C.在晶胞中,H形成一个顶点数为40的闭合多面体笼
D.单位体积中含氢质量的计算式为
12.关于性质的解释合理的是( )
A.AB.BC.CD.D
13.下列对有关事实的解释正确的是( )
A.AB.BC.CD.D
14.(无机苯)的结构与苯类似,也有大π键。下列关于的说法错误的是( )
A.其熔点主要取决于所含化学键的键能B.形成大π键的电子全部由N提供
C.分子中B和N的杂化方式相同D.分子中所有原子共平面
15.下列有关物质结构与性质的说法不正确的是( )
A.分子中存在配位键,N原子提供孤电子对
B.(结构如图)中B原子、O原子均采用杂化
C.中与氮原子相连的氢带部分正电荷,与硼原子相连的氢带部分负电荷
D.与的原子总数、电子总数均相等,熔点比低
16.砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,其中砷化镓是一种重要的半导体材料,晶胞结构如图所示,其熔点为1238℃,以下说法正确的是( )
A.一个晶胞中As原子的个数为4个GaAs分子
B.砷化镓晶体中每个原子均形成4个共价键
C.As的配位数是2
D.砷化镓、砷化铝、砷化硼的熔沸点逐渐降低
17.邻二氮菲(phen)与生成稳定的橙红色邻二氨菲亚铁离子,可用于的测定,邻二氮菲的结构简式如图所示。下列说法错误的是( )
A.邻二氮菲的一氯代物有4种
B.中的配位数为6
C.邻二氮菲分子不具有旋光性
D.用邻二氨菲测定的浓度与溶液的酸碱性无关
18.含Tp配体的钉(Ru)配合物催化氢化生成甲酸的机理如图所示。下列叙述错误的是( )
A.循环中Ru的成键数目不变
B.循环中物质所含氢键均为分子间氢键
C.Tp配体中,含有,N原子为杂化
D.该催化反应的原子利用率为100%
19.日光灯中用到的某种荧光粉的主要成分为。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和D轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3.下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:XMn,C正确;D.Z的最高价氧化物对应的水化物为,X最高价氧化物对应的水化物为,前者为中强酸而后者为强酸,D错误;故选C。
5.答案:C
解析:根据构造原理可判断,A项和B项正确;绝大多数基态原子的核外电子排布都遵循构造原理,但也有少数例外,如Cu,C项错误;构造原理中电子填入能级的顺序即各能级能量由低到高的顺序,D项正确。
6.答案:D
解析:A.同主族从上到下,原子半径增大,则原子半径:,故A错误;
B.C、Si、Ge最外层电子数相同,原子半径依次增大,第一电离能:,故B错误;
C.碳元素的单质有多种,金刚石为共价晶体石墨为混合晶体,为分子晶体,故C错误;
D.金属和非金属分界线处的元素既具有金属性又具有非金属性,可以制造半导体,可在周期表中元素Si附近寻找新半导体材料,故D正确;
故选:D。
7.答案:B
解析:A.根据“均摊法”,晶胞中含4个Zr、个O,所以立方氧化锆的化学式为,故A正确;
B.结合A分析可知,晶体密度为,故B错误;
C.Zr原子之间的最短距离为两个四分之一晶胞的体心的距离,为整个晶胞对角线距离的一半,即,故C正确;
D.若坐标取向不变,将p点Zr原子平移至原点,则垂直向下,q点Zr原子位于晶胞面的面心,故D正确;
故选:B。
8.答案:C
解析:A.氦气是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的氦气填充气球更加安全可靠,而氢气具有可燃性,使用氢气填充气球存在一定的安全隐患,故A正确;
B.三氟化硼分子中硼原子具有空轨道,能与氨分子中具有孤对电子的氮原子形成配位键,所以三氟化硼能与氨分子形成配合物,故B正确;
C.碱金属元素的价电子数相等,都为1,锂离子的离子半径在碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,故C错误;
D.氮原子价层只有4个原子轨道,3个不成对电子,由共价键的饱和性可知,氮原子不能形成5个氮氟键,所以不存在稳定的五氟化氮分子,故D正确;
故选:C。
9.答案:D
解析:解:A.根据图知,与中心原子距离最近且距离相等的分子有4个,所以其配位数是4,故A正确;
B.晶胞中配合物分子个数为,B正确;
C.该物质由分子构成的晶体,属于分子晶体,晶体中存在范德华力,故C正确;
D.各物质是由分子构成的晶体,属于分子晶体,故D错误;
故选:D。
10.答案:A
解析:A.中C原子的所有价键均参与成键,未有未参与成键的孤电子或者不饱和键,故与石墨相比,抗氧化性增强,A正确;
B.石墨晶体中每个碳原子上未参与杂化的1个2p轨道上电子在层内离域运动,故石墨晶体能导电,而中没有未参与杂化的2p轨道上的电子,故与石墨相比,导电性减弱,B错误;
C.已知C的原子半径比F的大,故可知中的键长比长,C错误;
D.由题干结构示意图可知,在中C与周围的3个碳原子形成共价键,每个键被2个碳原子共用,和1个F原子形成共价键,即中含有共价单键,D错误;故选A。
11.答案:C
解析:以上底面的La为研究对象,晶体中距离该La最近且相等的H原子分别位于其上方和下方,共8个,故La的配位数为8,A正确;由和的晶胞结构及题干知,H与H的最短距离;大于,B正确;在晶胞中,共有个H原子,将分成8个小立方体,在每个小立方体内,有5个H形成正四面体结构,则整个晶胞中40个H原子不全在闭合多面体曲面上,C错误;每个晶胞中含40个H原子,H原子密度为,D正确。
12.答案:C
解析:
13.答案:C
解析:A.金属的焰色反应是金属在加热时电子由低能轨道跃迁到高能轨道后,又从高能轨道向低能跃迁,释放出不同波长的光,故A错误;B.与分子的空间构型不同,但两者中心原子杂化轨道类型均为,故B错误;C.HF的热稳定性比HCl强,因为F的非金属性强于Cl, H - F比H - Cl的键能大,故C正确:D.为原子晶体,不存在范德华力,干冰为分子晶体,原子晶体的熔点高于分子晶体的熔点,故D错误。
14.答案:A
解析:本题以无机苯()为载体,考查分子结构和杂化方式等知识。根据无机苯()的结构与苯类似,也有大π键,可知其与苯一样,具有平面结构,的结构为,分子中所有原子共平面,D项正确;
根据题意可知,属于分子晶体,化学键的键能大小决定物质的稳定性强弱,而分子晶体的熔点高低取决于分子间作用力的大小,A项错误;
B-H与H-N都是σ键,无机苯中存在一个6原子6电子的大π键,由于B最外层只有三个电子,故形成大π键的电子全部由氮原子提供,B项正确;
无机苯与苯结构类似,分子中键角为120°,故B是杂化,N也是杂化,C项正确。
15.答案:B
解析:A.分子中存在配位键,N原子提供孤电子对,A正确;B.中,B原子形成了3个键,B原子的最外层无孤对电子,所以B的价层电子对数为3,B原子采用杂化,而O原子形成2个键,O的最外层上有2对孤对电子,所以O的价层电子对数为2+2=4,所以O采用杂化,B错误;C.在中,电负性N>H>B,使与N相连的H常带部分正电荷,与B相连的H带部分负电荷,C正确;D.的极性强于,分子的极性越强,分子间作用力越强,熔沸点越高,因此的熔点更高,D正确;故答案为:B。
16.答案:B
解析:
17.答案:D
解析:
18.答案:B
解析:B由图可知,生成的同时生成的另一种中间产物存在分子内氢键,故B错误。
19.答案:C
解析:基态X原子S轨道上电子数和P轨道上电子数相等,推知X为O元素;根据X、Y原子的未成对电子数之比为2:1:3,可知Y为F元素,Z为P元素,W为Ca元素。元素电负性:F>O>P>Ca,A项错误;原子半径F;N的核外电子排布是半充满的,比较稳定,失去1个电子比较困难,故第一电离能较高
(4)分子与分子间能形成氢键;根据“相似相溶”规律,是极性分子,易溶于极性溶剂水中;与能发生反应生成
(5)杂化
(6)7;BC
解析:
22.答案:(1)B
(2)NaF与为离子晶体,为分子晶体,故的熔点低,的半径比的半径小,中离子键更强,熔点更高;正四面体;109°28′
(3)非金属性;;第六周期ⅠA族;;元素在地壳中含量
(4)
解析:
23.答案:(1)8
(2);平面三角形(或)
(3)是离子晶体,是分子晶体,离子晶体熔点高
(4);
解析:
24.答案:(1);V、C
(2)平面三角形
(3)①418.8;242.4
(4)12;(或);
(5)氮的电负性较大,相互平行且重叠p轨道上的电子在很大程度上被定域在氮的周围,不能自由流动,所以六方BN无法导电;(,,);
解析:
25.答案:(1)
(2);>;分子中既存在σ键,又存在大π键,原子轨道重叠的程度较大,因此其中Cl-O键的键长较小,而只存在普通的σ键
(3)>;两金属离子配合物中,中心离子带电荷数相同,半径小,与配体距离近,分裂能大
(4);
解析:
选项
实例
解释
A
用替代填充探空气球更安全
的电子构型稳定,不易得失电子
B
与形成配合物
中的B有空轨道接受中N的孤电子对
C
碱金属中的熔点最高
碱金属中的价电子数最少,金属键最强
D
不存在稳定的分子
N原子价层只有4个原子轨道,不能形成5个键
选项
性质
解释
A
比容易液化
分子间的范德华力更大
B
熔点高于
键的键能比大
C
能与以配位键结合
中氮原子有孤电子对
D
氨水中存在
是离子化合物
事实
解释
A
某些金属盐灼烧呈现不同焰色
电子从低能轨道跃迁至高能轨道时吸收光波长不同
B
与分子的空间构型不同
二者中心原子杂化轨道类型不同
C
HF的热稳定性比HCl强
HF比H-Cl的键能大
D
的熔点比干冰高
分子间的范德华力大
氟化物
熔点/℃
1266
1534
183
相关试卷
这是一份永州市第一中学2023-2024学年高二下学期开学考试化学试卷(含答案),共13页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份眉山市彭山区第一中学2023-2024学年高二下学期开学考试化学试卷(含答案),共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份济宁市实验中学2023-2024学年高二下学期开学考试化学试卷(含答案),共14页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。








