






所属成套资源:人教版高中化学选修二课件PPT(含课件、教案、学案、作业)
- 高二化学(人教版)选择性必修第2册 第一章 第二节 第一课时 原子结构与元素周期表-教学课件、教案、学案、作业 课件 2 次下载
- 高二化学(人教版)选择性必修第2册 第一章 第二节 第二课时 元素周期律1-教学课件、教案、学案、作业 课件 2 次下载
- 第一章 原子结构与性质-【知识清单】2023-2024学年高二化学单元复习知识清单(人教版2019选择性必修2) 学案 3 次下载
- 高二化学(人教版)选择性必修第2册 第二章 第一节 第一课时 共价键-教学课件、教案、学案、作业 课件 3 次下载
- 高二化学(人教版)选择性必修第2册 第二章 第一节 第二课时 键参数--键能 键长与键角-教学课件、教案、学案、作业 课件 2 次下载
高二化学(人教版)选择性必修第2册 第一章 第二节 第三课时 元素周期律2-教学课件、教案、学案、作业
展开
这是一份高二化学(人教版)选择性必修第2册 第一章 第二节 第三课时 元素周期律2-教学课件、教案、学案、作业,文件包含第一章第二节第3课时元素周期律2-教学课件pptx、第一章第二节第3课时元素周期律2-教学设计docx、第一章第二节第3课时元素周期律2-作业设计docx、第一章第二节第3课时元素周期律2-学案设计docx等4份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
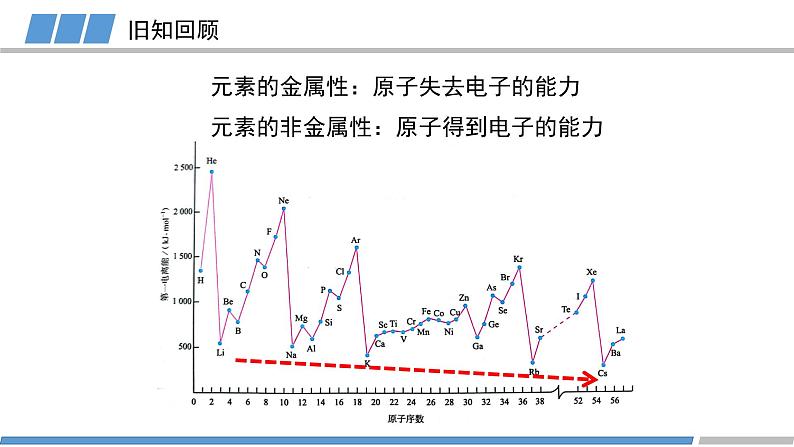
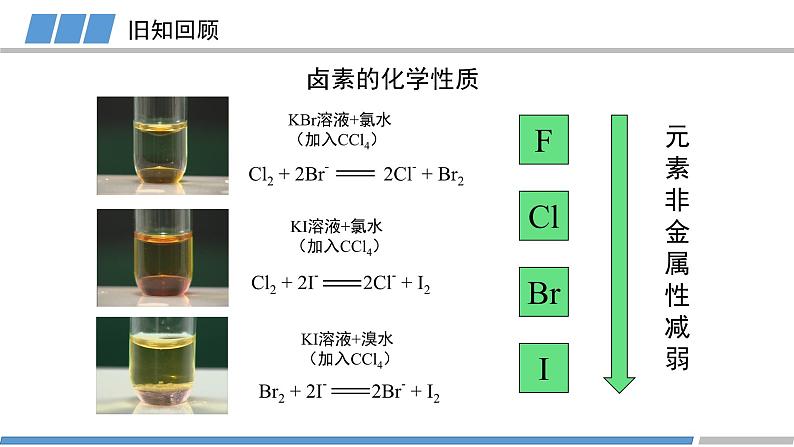
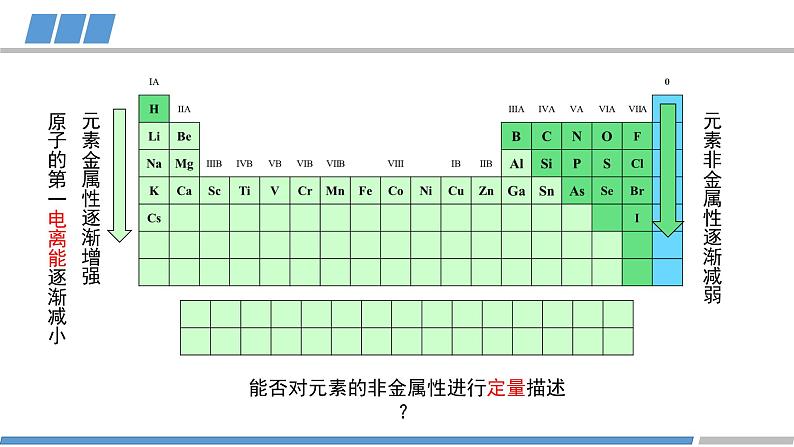
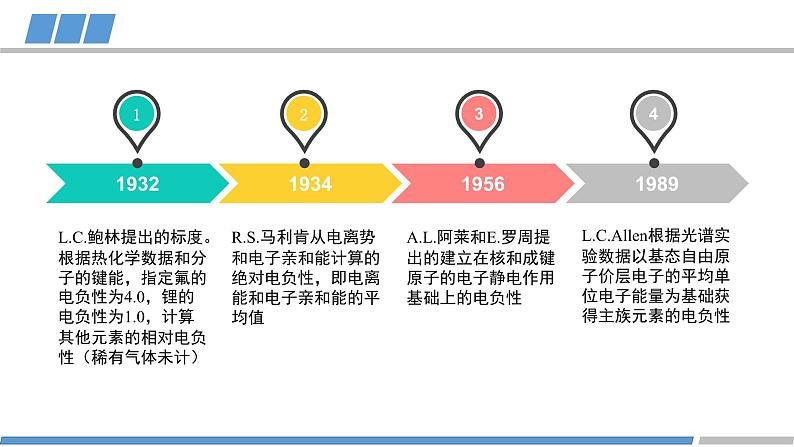
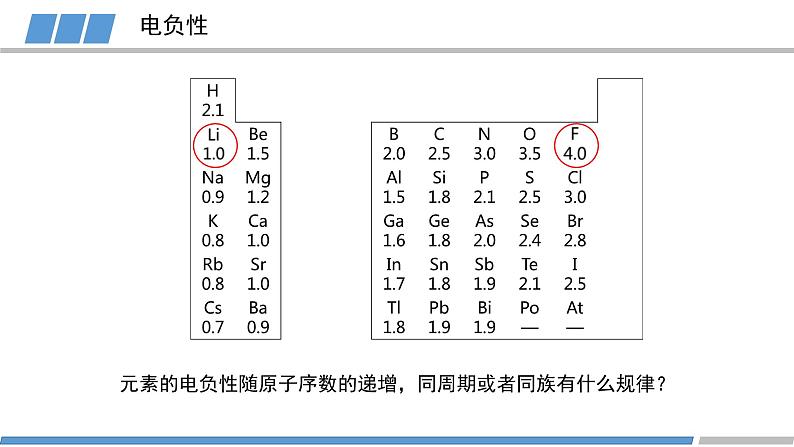
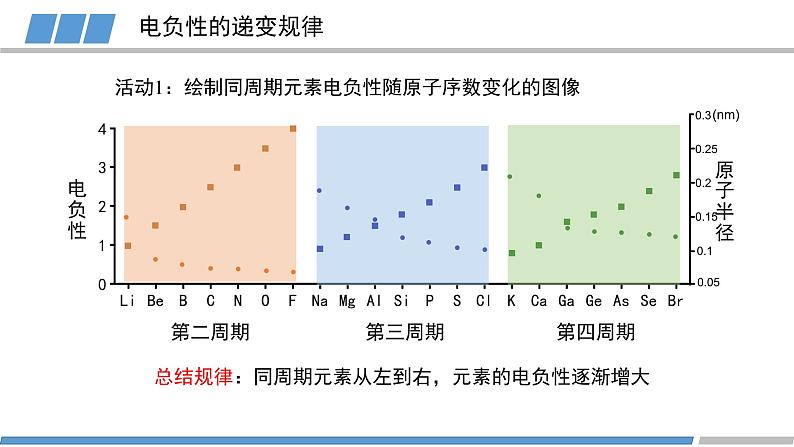
人教版 选择性必修2第一章 第二节 第3课时原子结构与元素的性质元素的金属性:原子失去电子的能力旧知回顾元素的非金属性:原子得到电子的能力KBr溶液+氯水(加入CCl4)KI溶液+氯水(加入CCl4)KI溶液+溴水(加入CCl4)卤素的化学性质FClBrI元素非金属性减弱旧知回顾元素金属性逐渐增强原子的第一电离能逐渐减小元素非金属性逐渐减弱能否对元素的非金属性进行定量描述?电负性越大的原子,对键合电子的吸引力越大鲍林描述不同元素的原子对键合电子吸引力的大小键合电子原子中用于形成化学键的电子电负性键合电子电负性1932193419561989L.C.Allen根据光谱实验数据以基态自由原子价层电子的平均单位电子能量为基础获得主族元素的电负性A.L.阿莱和E.罗周提出的建立在核和成键原子的电子静电作用基础上的电负性R.S.马利肯从电离势和电子亲和能计算的绝对电负性,即电离能和电子亲和能的平均值L.C.鲍林提出的标度。根据热化学数据和分子的键能,指定氟的电负性为4.0,锂的电负性为1.0,计算其他元素的相对电负性(稀有气体未计)元素的电负性随原子序数的递增,同周期或者同族有什么规律?电负性第二周期第三周期第四周期电负性电负性的递变规律活动1:绘制同周期元素电负性随原子序数变化的图像总结规律:同周期元素从左到右,元素的电负性逐渐增大(nm)电负性第IA族第VIA族第VIIA族活动2:绘制同主族元素电负性随原子序数变化的图像电负性的递变规律总结规律:同族元素从上到下,元素的电负性逐渐减小(nm)电负性电负性呈现周期性递变电负性不同元素的原子对键合电子吸引力的大小电负性的应用1:判断元素的金属性与非金属性电负性 > 1.8 非金属元素电负性 < 1.8 金属元素电负性 ≈ 1.8 类金属元素成键原子之间的电负性差值可作化学键类型的判断依据电负性的应用2: 判断化学键的类型电负性的应用2: 判断化学键的类型电负性的应用3:判断元素化合价的正负HCCHHHHH电负性的应用3:判断元素化合价的正负活动3 判断乙烷中各元素的化合价CH3CH3-3+1-3+1原子半径/电离能/电负性呈现周期性的递变总结电负性不同元素的原子对键合电子吸引力的大小概念:应用:金属性与非金属性/化学键类型/元素化合价He科学史话NeArKrXeOg稀有气体发现史稀有气体化学性质是惰性的吗?Rn课堂练习下列元素电负性随原子序数的递增而增强的是 Na、K、Rb N、P、As O、S、Cl Si、P、Cl2. 下列关于电负性的叙述不正确的是 电负性越大的主族元素,其原子的第一电离能越大 电负性是以氟为 4.0 作为标准的相对值 元素的电负性越大,元素的非金属性越强 同一周期元素从左到右,电负性逐渐变大课堂练习3. 下列判断正确的是 第一电离能:B>Al>Ga 电负性:F>N>O 最高正化合价:F>S>Si 原子半径:P>N>C课堂练习4. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:①原子半径AB, ③原子序数A>B, ④原子最外层电子数A






