资料中包含下列文件,点击文件名可预览资料内容









还剩21页未读,
继续阅读
成套系列资料,整套一键下载
- 高二化学(人教版)选择性必修第2册 第三章 第二节 第二课时 分子晶体和共价晶体-教学课件、教案、学案、作业 课件 3 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第二节 第三课时 共价晶体2-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第三节 第二课时 离子晶体-教学课件、教案、学案、作业 课件 2 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第三节 第三课时 过渡晶体与混合型晶体-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第四节 第一课时 配合物与超分子-教学课件、教案、学案、作业 课件 1 次下载
高二化学(人教版)选择性必修第2册 第三章 第三节 第一课时 金属晶体-教学课件、教案、学案、作业
展开
这是一份高二化学(人教版)选择性必修第2册 第三章 第三节 第一课时 金属晶体-教学课件、教案、学案、作业,文件包含第三章第三节第1课时金属晶体-教学课件pptx、第三章第三节第1课时金属晶体-教学设计docx、第三章第三节第1课时金属晶体-作业设计docx、第三章第三节第1课时金属晶体-学案设计docx等4份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
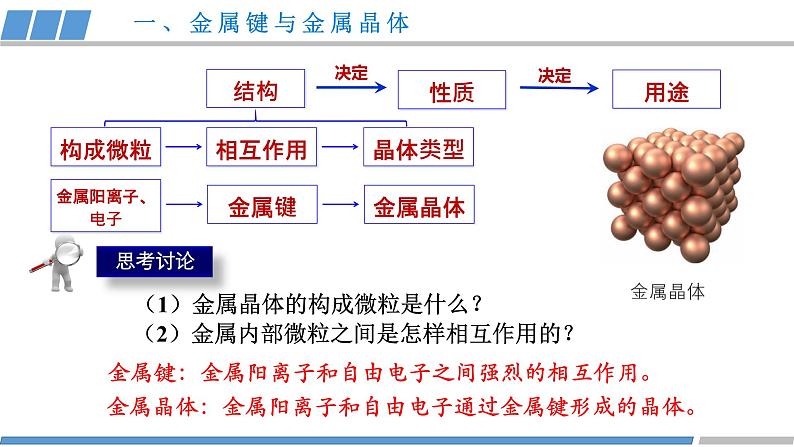
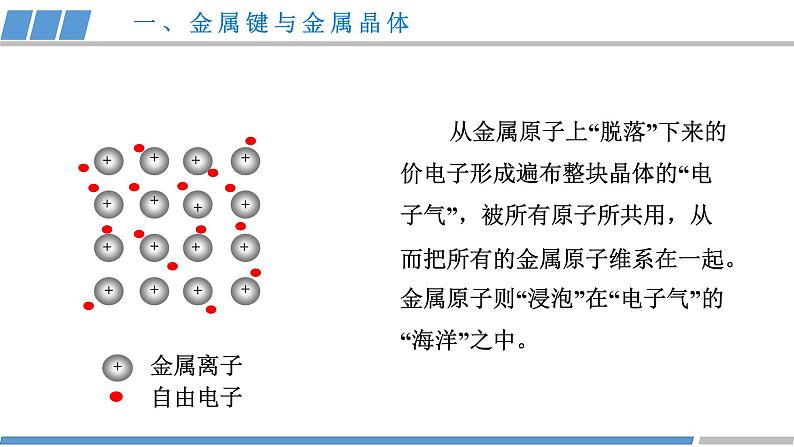
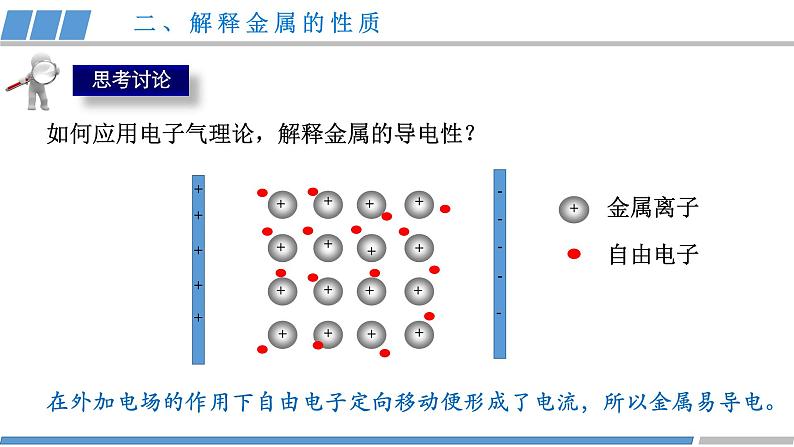
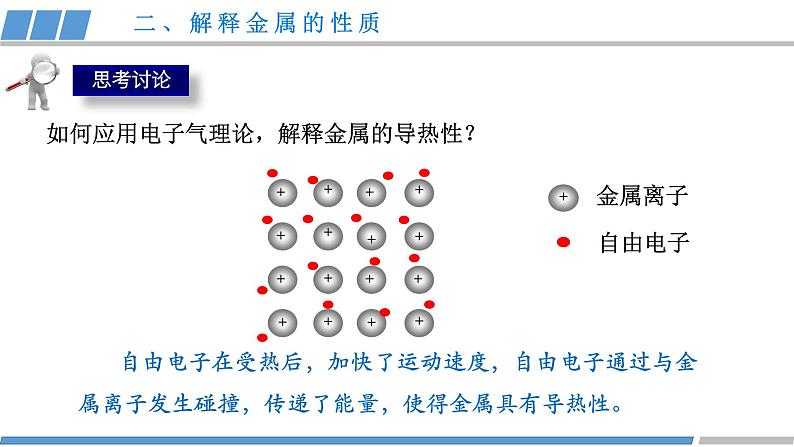
第三章 第三节 第1课时 《金属晶体》人教版 选择性必修2金属共同的物理性质有哪些?金属为什么具有这些性质?结构性质决定构成微粒相互作用晶体类型(1)金属晶体的构成微粒是什么?金属键:金属阳离子和自由电子之间强烈的相互作用。(2)金属内部微粒之间是怎样相互作用的?金属阳离子、电子金属键金属晶体一、金属键与金属晶体金属晶体:金属阳离子和自由电子通过金属键形成的晶体。 从金属原子上“脱落”下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。金属原子则“浸泡”在“电子气”的“海洋”之中。一、金属键与金属晶体++++++++++++++++(1)金属键是否像共价键一样,具有方向性和饱和性?金属键无方向性和饱和性(2)哪些类物质中含有金属键?金属和合金一、金属键与金属晶体金属键越强、金属的熔沸点越高,硬度越大。结构性质决定金属阳离子自由电子导电性导热性延展性金属键金属晶体金属光泽结构决定性质,如何应用电子气理论,解释金属的性质?二、解释金属的性质在外加电场的作用下自由电子定向移动便形成了电流,所以金属易导电。金属离子自由电子+++++++++++++++++如何应用电子气理论,解释金属的导电性?二、解释金属的性质 自由电子在受热后,加快了运动速度,自由电子通过与金属离子发生碰撞,传递了能量,使得金属具有导热性。金属离子自由电子+++++++++++++++++如何应用电子气理论,解释金属的导热性?二、解释金属的性质错位 当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子之间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属具有良好的延展性。如何应用电子气理论,解释金属的延展性?二、解释金属的性质因为自由电子可吸收所有频率的光,很快释放出去,绝大多数块状金属具有光泽。某些金属因易吸收某些频率光而呈特殊颜色。如何应用电子气理论,解释金属光泽?二、解释金属的性质(1)对比锂、钠、镁、铝、钾的原子结构和熔沸点的数据,晶体的熔沸点与哪些因素有关? 金属阳离子半径越小,所带电荷越多,金属键越强,熔沸点就相应越高,硬度也越大。二、解释金属的性质 ①碱金属熔沸点随原子序数增大而递减,原因:同主族元素,电荷数相同,从上到下离子半径依次增大,金属键依次减弱。(2)根据数据,你能总结出什么规律? ②同周期金属晶体的熔沸点:钠<镁<铝 ,原因: 同周期从左到右,离子半径依次减小,电荷数增多,金属键增强。二、解释金属的性质常见的金属晶体的结构如下图所示三、常见的金属晶体结构观察 Cu的晶体结构请回答(1)描述Cu原子的空间位置?(2)一个晶胞中含有多少个Cu原子?(3)每个Cu原子周围距离最近的原子数是多少?12三、常见的金属晶体结构(1)描述K原子的空间位置?(2)一个晶胞中含有多少个K原子?观察K的晶体结构请回答(3)每个K原子周围距离最近的原子数是多少?8三、常见的金属晶体结构(1)描述Mg原子的空间位置?(2)一个晶胞中含有多少个Mg原子?观察Mg的晶体结构请回答三、常见的金属晶体结构同学甲答案同学乙答案晶胞:晶体结构中基本的重复单元,晶胞的形状为六面体。三、常见的金属晶体结构√×(1)描述Mg原子的空间位置?(2)一个晶胞中含有多少个Mg原子?观察Mg的晶体结构请回答三、常见的金属晶体结构(3)每个Mg原子周围距离最近的原子 数是多少?12结构性质决定纯铜延展性好,但是质软,机械性能和耐磨性差,是否可以改变晶体结构从而优化晶体的性质?掺杂锌机械性能好硬度大、强度大四、合金铜镍合金:强度高、硬度大,用于造船、化工设备等。银铝合金:耐高温、耐磨性好,用于航空耐热材料等。铁铬合金:耐腐蚀、耐高温,用于餐具、建筑材料等。四、合金 钠钾合金常温下为液态,可用作冷却剂、催化剂、干燥剂。其晶胞结构如图所示,观察晶体结构请回答:(1)合金的化学式是什么?K:8个顶角Na:12个在棱心 此钠钾合金的化学式为KNa3或Na3K(2)晶胞中K 原子周围距离最近的Na原子数是多少?6四、合金活动·探究活动·探究动手活动 请利用身边的材料如橡皮泥、面团、牙签等材料,尝试拼插出铜、钾、镁的晶体结构模型。 K Cu Mg课堂小结结构性质决定构成微粒相互作用晶体类型金属阳离子、自由电子金属键金属晶体导电性导热性延展性金属光泽解释决定Cu K Mg1.下列有关金属键的叙述错误的是( )A.金属键很强,金属键属于化学键B.金属键的成键微粒是金属阳离子和自由电子C.金属键中的自由电子属于整块金属D.金属键是一种电性吸引作用课堂练习2.下列说法不正确的是( )A.温度越高,金属的导电性越好B.镁晶体中一个Mg2+与周围电子都在强烈的相互作用C.在金属晶体发生形变时,其内部金属离子与“自由电子”之间的相互作用仍然存在D.一种晶体固态时能导电,一定是金属晶体课堂练习3.金属晶体具有延展性的原因( )A.金属键很微弱B.金属键没有饱和性C.金属阳离子之间存在斥力D.密堆积层的阳离子容易滑动,但不会破坏密堆积的排列方式,也不会破坏金属键课堂练习4.下列对于金属熔、沸点的高低判断正确的是( )A.金属镁的熔点高于金属铝B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的C.金属镁的硬度小于金属钙D.金属铝的硬度大于金属钠课堂练习5.铁镁合金的晶胞结构如图所示,请计算晶胞中含有的Fe、Mg原子个数分别为( )A.4 4 B.4 8 C.14 4 D.14 8课堂练习课堂练习正确答案:D D D D B课堂练习
第三章 第三节 第1课时 《金属晶体》人教版 选择性必修2金属共同的物理性质有哪些?金属为什么具有这些性质?结构性质决定构成微粒相互作用晶体类型(1)金属晶体的构成微粒是什么?金属键:金属阳离子和自由电子之间强烈的相互作用。(2)金属内部微粒之间是怎样相互作用的?金属阳离子、电子金属键金属晶体一、金属键与金属晶体金属晶体:金属阳离子和自由电子通过金属键形成的晶体。 从金属原子上“脱落”下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。金属原子则“浸泡”在“电子气”的“海洋”之中。一、金属键与金属晶体++++++++++++++++(1)金属键是否像共价键一样,具有方向性和饱和性?金属键无方向性和饱和性(2)哪些类物质中含有金属键?金属和合金一、金属键与金属晶体金属键越强、金属的熔沸点越高,硬度越大。结构性质决定金属阳离子自由电子导电性导热性延展性金属键金属晶体金属光泽结构决定性质,如何应用电子气理论,解释金属的性质?二、解释金属的性质在外加电场的作用下自由电子定向移动便形成了电流,所以金属易导电。金属离子自由电子+++++++++++++++++如何应用电子气理论,解释金属的导电性?二、解释金属的性质 自由电子在受热后,加快了运动速度,自由电子通过与金属离子发生碰撞,传递了能量,使得金属具有导热性。金属离子自由电子+++++++++++++++++如何应用电子气理论,解释金属的导热性?二、解释金属的性质错位 当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子之间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属具有良好的延展性。如何应用电子气理论,解释金属的延展性?二、解释金属的性质因为自由电子可吸收所有频率的光,很快释放出去,绝大多数块状金属具有光泽。某些金属因易吸收某些频率光而呈特殊颜色。如何应用电子气理论,解释金属光泽?二、解释金属的性质(1)对比锂、钠、镁、铝、钾的原子结构和熔沸点的数据,晶体的熔沸点与哪些因素有关? 金属阳离子半径越小,所带电荷越多,金属键越强,熔沸点就相应越高,硬度也越大。二、解释金属的性质 ①碱金属熔沸点随原子序数增大而递减,原因:同主族元素,电荷数相同,从上到下离子半径依次增大,金属键依次减弱。(2)根据数据,你能总结出什么规律? ②同周期金属晶体的熔沸点:钠<镁<铝 ,原因: 同周期从左到右,离子半径依次减小,电荷数增多,金属键增强。二、解释金属的性质常见的金属晶体的结构如下图所示三、常见的金属晶体结构观察 Cu的晶体结构请回答(1)描述Cu原子的空间位置?(2)一个晶胞中含有多少个Cu原子?(3)每个Cu原子周围距离最近的原子数是多少?12三、常见的金属晶体结构(1)描述K原子的空间位置?(2)一个晶胞中含有多少个K原子?观察K的晶体结构请回答(3)每个K原子周围距离最近的原子数是多少?8三、常见的金属晶体结构(1)描述Mg原子的空间位置?(2)一个晶胞中含有多少个Mg原子?观察Mg的晶体结构请回答三、常见的金属晶体结构同学甲答案同学乙答案晶胞:晶体结构中基本的重复单元,晶胞的形状为六面体。三、常见的金属晶体结构√×(1)描述Mg原子的空间位置?(2)一个晶胞中含有多少个Mg原子?观察Mg的晶体结构请回答三、常见的金属晶体结构(3)每个Mg原子周围距离最近的原子 数是多少?12结构性质决定纯铜延展性好,但是质软,机械性能和耐磨性差,是否可以改变晶体结构从而优化晶体的性质?掺杂锌机械性能好硬度大、强度大四、合金铜镍合金:强度高、硬度大,用于造船、化工设备等。银铝合金:耐高温、耐磨性好,用于航空耐热材料等。铁铬合金:耐腐蚀、耐高温,用于餐具、建筑材料等。四、合金 钠钾合金常温下为液态,可用作冷却剂、催化剂、干燥剂。其晶胞结构如图所示,观察晶体结构请回答:(1)合金的化学式是什么?K:8个顶角Na:12个在棱心 此钠钾合金的化学式为KNa3或Na3K(2)晶胞中K 原子周围距离最近的Na原子数是多少?6四、合金活动·探究活动·探究动手活动 请利用身边的材料如橡皮泥、面团、牙签等材料,尝试拼插出铜、钾、镁的晶体结构模型。 K Cu Mg课堂小结结构性质决定构成微粒相互作用晶体类型金属阳离子、自由电子金属键金属晶体导电性导热性延展性金属光泽解释决定Cu K Mg1.下列有关金属键的叙述错误的是( )A.金属键很强,金属键属于化学键B.金属键的成键微粒是金属阳离子和自由电子C.金属键中的自由电子属于整块金属D.金属键是一种电性吸引作用课堂练习2.下列说法不正确的是( )A.温度越高,金属的导电性越好B.镁晶体中一个Mg2+与周围电子都在强烈的相互作用C.在金属晶体发生形变时,其内部金属离子与“自由电子”之间的相互作用仍然存在D.一种晶体固态时能导电,一定是金属晶体课堂练习3.金属晶体具有延展性的原因( )A.金属键很微弱B.金属键没有饱和性C.金属阳离子之间存在斥力D.密堆积层的阳离子容易滑动,但不会破坏密堆积的排列方式,也不会破坏金属键课堂练习4.下列对于金属熔、沸点的高低判断正确的是( )A.金属镁的熔点高于金属铝B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的C.金属镁的硬度小于金属钙D.金属铝的硬度大于金属钠课堂练习5.铁镁合金的晶胞结构如图所示,请计算晶胞中含有的Fe、Mg原子个数分别为( )A.4 4 B.4 8 C.14 4 D.14 8课堂练习课堂练习正确答案:D D D D B课堂练习
相关资料
更多









