资料中包含下列文件,点击文件名可预览资料内容



还剩8页未读,
继续阅读
成套系列资料,整套一键下载
- 高二化学(人教版)选择性必修第2册 第三章 第二节 第三课时 共价晶体2-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第三节 第一课时 金属晶体-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第三节 第三课时 过渡晶体与混合型晶体-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第四节 第一课时 配合物与超分子-教学课件、教案、学案、作业 课件 1 次下载
- 高二化学(人教版)选择性必修第2册 第三章 第四节 第二课时 配合物与超分子-教学课件、教案、学案、作业 课件 2 次下载
高二化学(人教版)选择性必修第2册 第三章 第三节 第二课时 离子晶体-教学课件、教案、学案、作业
展开
这是一份高二化学(人教版)选择性必修第2册 第三章 第三节 第二课时 离子晶体-教学课件、教案、学案、作业,文件包含第三章第三节第2课时离子晶体-教学课件pptx、第三章第三节第2课时离子晶体-教学设计docx、第三章第三节第2课时离子晶体-作业设计docx、第三章第三节第2课时离子晶体-学案设计docx等4份课件配套教学资源,其中PPT共16页, 欢迎下载使用。
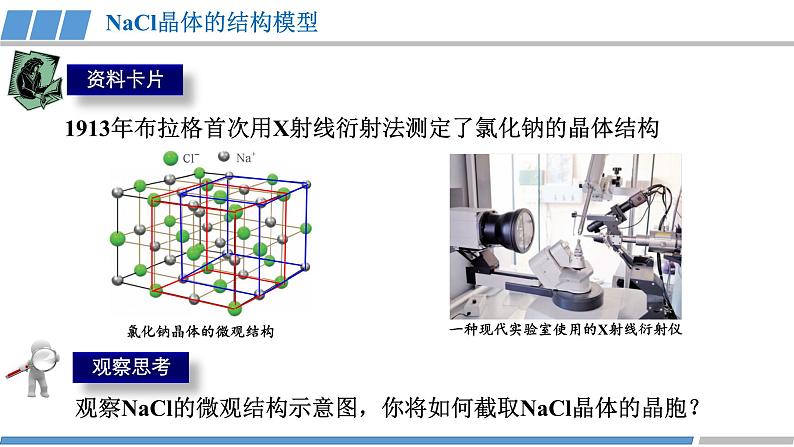
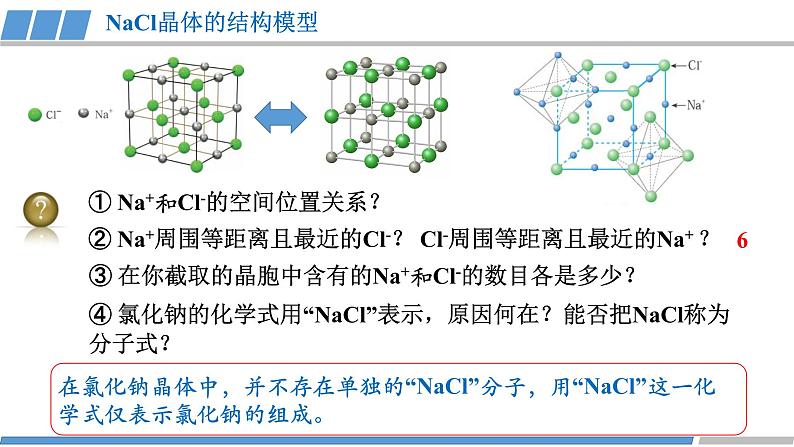
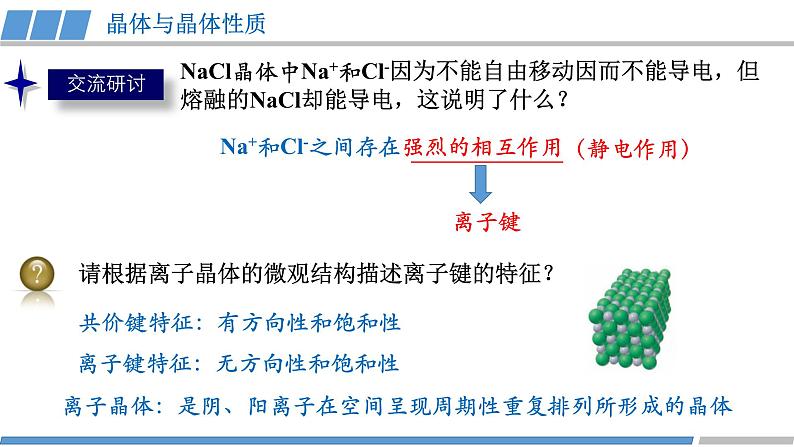
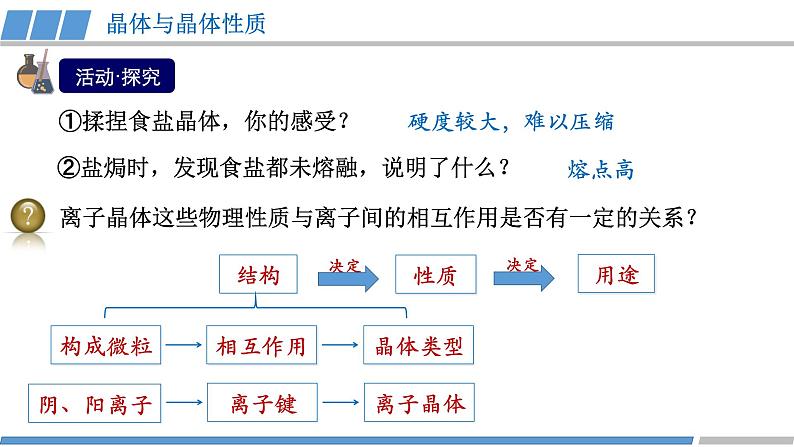
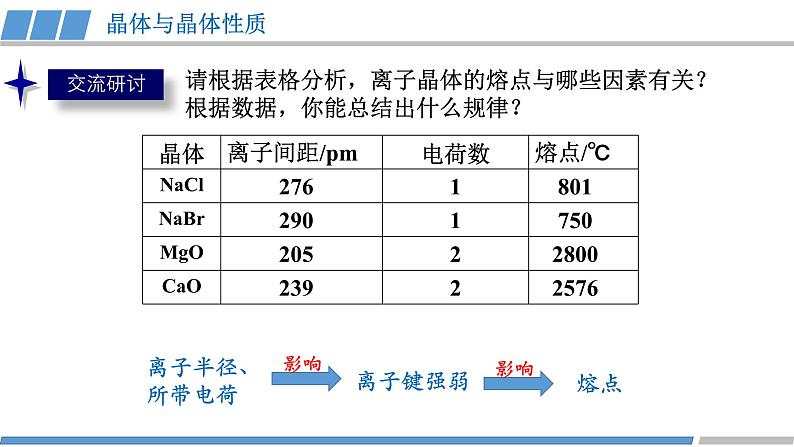
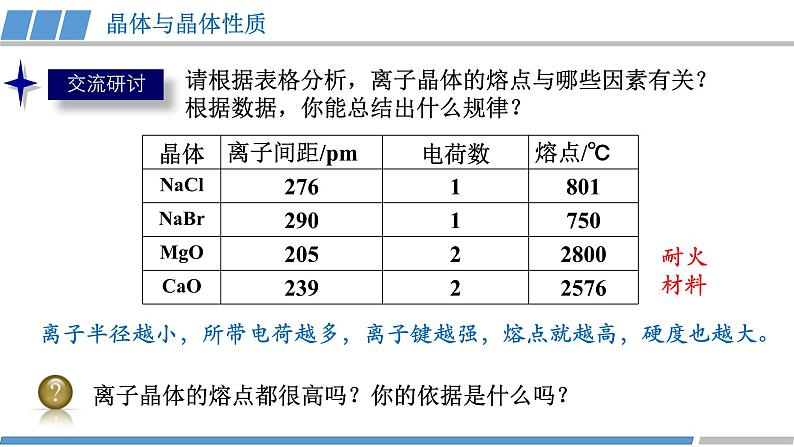
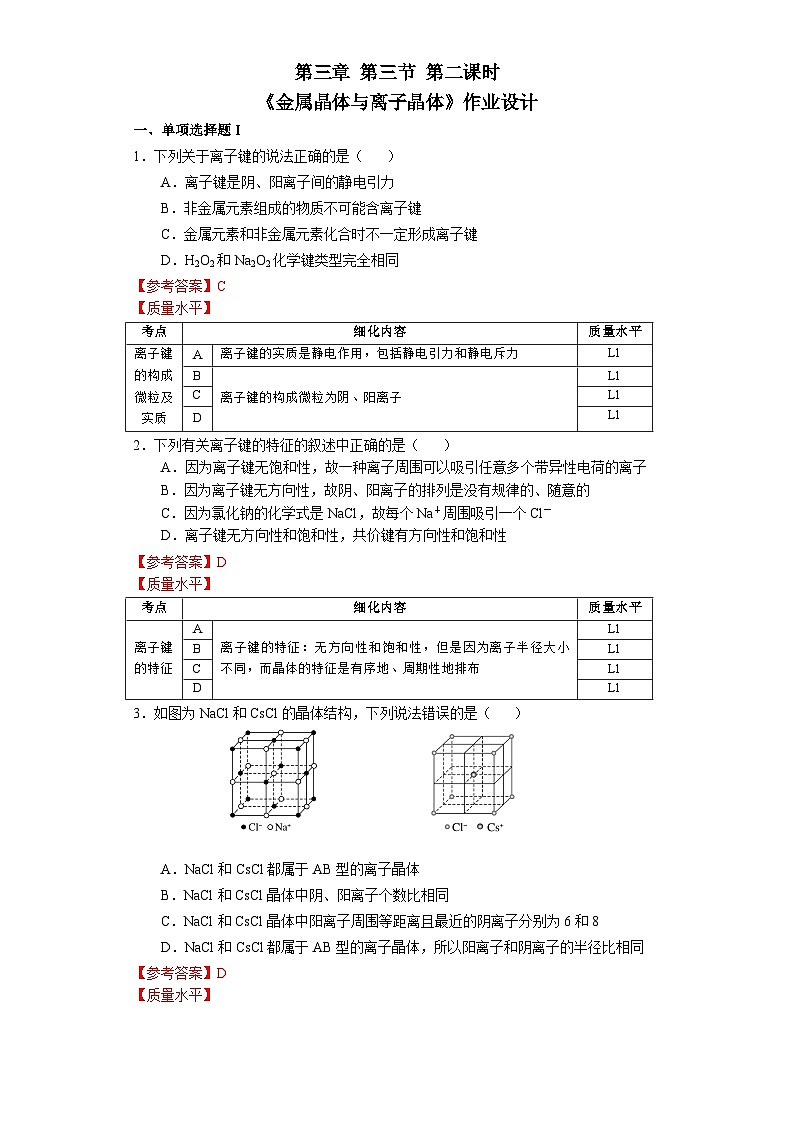
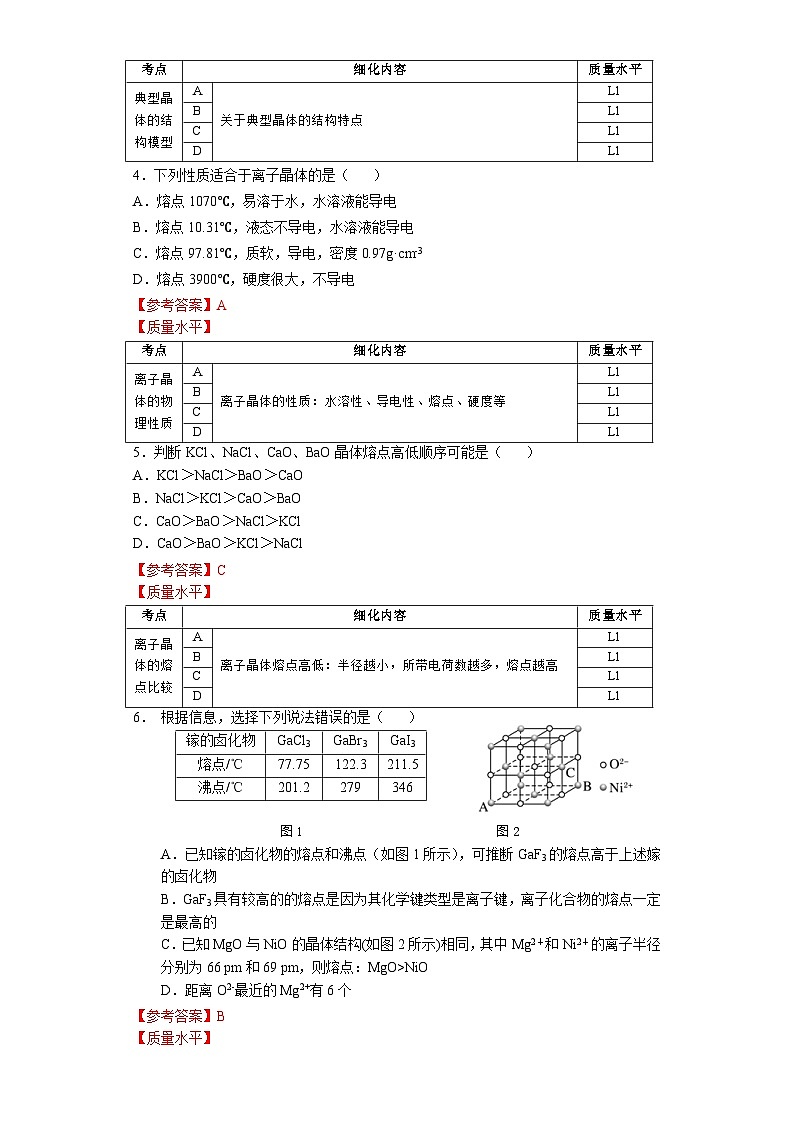
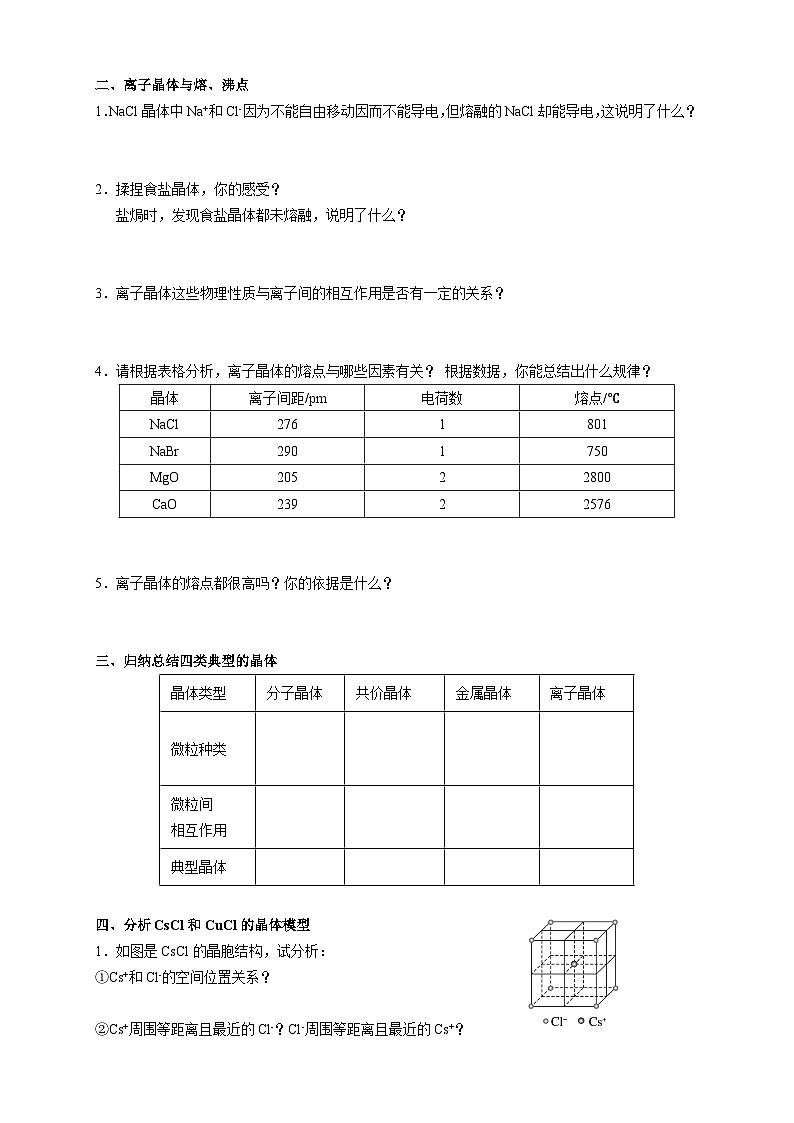
第三章 第三节 第2课时 《离子晶体》人教版 选择性必修2我们知道,熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体却不能导电,这是为什么呢?那么,NaCl晶体中微粒是怎样分布的呢?没有自由移动的Na+和Cl-NaCl晶体模型又是怎样的呢?活动·探究②能否根据你的理解运用相关知识拼接氯化钠的晶体模型?①利用放大镜观察NaCl晶体,能否看到其微观结构?1913年布拉格首次用X射线衍射法测定了氯化钠的晶体结构观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞?NaCl晶体的结构模型③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?① Na+和Cl-的空间位置关系?② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。6④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?NaCl晶体的结构模型NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?Na+和Cl-之间存在强烈的相互作用离子键请根据离子晶体的微观结构描述离子键的特征?离子键特征:无方向性和饱和性离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体(静电作用)共价键特征:有方向性和饱和性晶体与晶体性质活动·探究①揉捏食盐晶体,你的感受?②盐焗时,发现食盐都未熔融,说明了什么?离子晶体这些物理性质与离子间的相互作用是否有一定的关系?硬度较大,难以压缩熔点高结构性质决定用途决定构成微粒相互作用晶体类型阴、阳离子离子键离子晶体晶体与晶体性质请根据表格分析,离子晶体的熔点与哪些因素有关?根据数据,你能总结出什么规律?离子键强弱 熔点影响 离子半径、所带电荷影响晶体与晶体性质请根据表格分析,离子晶体的熔点与哪些因素有关?根据数据,你能总结出什么规律?耐火材料离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。离子晶体的熔点都很高吗?你的依据是什么吗?晶体与晶体性质实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。有些离子组成的物质在常温下甚至以液态形式存在。CuSO4 · 5H2O1-乙基-3-甲基咪唑四氟硼酸盐离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点KAl (SO4 )2· 12H2O有的还存在电中性分子( H2O、NH3等)。晶体与晶体性质根据晶体构成微粒和微粒间相互作用不同分为四种类型金属阳离子和自由电子金属键 原子离子键共价键分子分子间作用力阴、阳离子金属CuNaClCO2① Cs+和Cl-的空间位置关系?② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?阳离子半径大小不同③ 每个晶胞含Cs+、Cl-个数?8CsCl晶体的结构模型CsCl晶体的微观结构已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:② Cu+和Cl-的空间位置关系?① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。4CuCl晶体的结构模型课堂练习1.下列物质中,含有非极性共价键的离子晶体是( )A.NaOH B.Na2O2 C.NaCl D.AlCl32.已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;一般来说,两成键原子对应的元素间电负性差值大于1.7时,形成离子键;两成键原子对应的元素间电负性差值小于1.7时,形成共价键。下表给出了14种元素的电负性,则下列说法正确的是( )A.从表中数据看,C和S的电负性相等,所以C和S两元素原子间形成的键为非极性共价键B.根据电负性数据可知,SiCl4中含离子键,属于离子化合物C.根据电负性数据可知,Mg3N2中含有离子键D.BeCl2因含金属元素铍,故属于离子化合物3.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )A.该晶体属于分子晶体B.该晶胞中Zn2+和S2-数目不相等C. Zn2+周围等距离且最近的S2-为6D.氧化锌的熔点高于硫化锌4.萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )A.2 B.4 C.6 D.85.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。某同学画出的MgO晶胞结构示意图如下图所示,下列说法错误的是( )A.图中的错误的是⑧B.MgO是优良的耐高温材料,MgO的熔点比CaO的高C.NiO晶胞中Ni和O周围等距离且最近的O和Ni分别为6、6D.晶体中与每个O2-距离最近且等距离的O2-有6个课堂练习正确答案:B C D B D
第三章 第三节 第2课时 《离子晶体》人教版 选择性必修2我们知道,熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体却不能导电,这是为什么呢?那么,NaCl晶体中微粒是怎样分布的呢?没有自由移动的Na+和Cl-NaCl晶体模型又是怎样的呢?活动·探究②能否根据你的理解运用相关知识拼接氯化钠的晶体模型?①利用放大镜观察NaCl晶体,能否看到其微观结构?1913年布拉格首次用X射线衍射法测定了氯化钠的晶体结构观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞?NaCl晶体的结构模型③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?① Na+和Cl-的空间位置关系?② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。6④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?NaCl晶体的结构模型NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?Na+和Cl-之间存在强烈的相互作用离子键请根据离子晶体的微观结构描述离子键的特征?离子键特征:无方向性和饱和性离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体(静电作用)共价键特征:有方向性和饱和性晶体与晶体性质活动·探究①揉捏食盐晶体,你的感受?②盐焗时,发现食盐都未熔融,说明了什么?离子晶体这些物理性质与离子间的相互作用是否有一定的关系?硬度较大,难以压缩熔点高结构性质决定用途决定构成微粒相互作用晶体类型阴、阳离子离子键离子晶体晶体与晶体性质请根据表格分析,离子晶体的熔点与哪些因素有关?根据数据,你能总结出什么规律?离子键强弱 熔点影响 离子半径、所带电荷影响晶体与晶体性质请根据表格分析,离子晶体的熔点与哪些因素有关?根据数据,你能总结出什么规律?耐火材料离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。离子晶体的熔点都很高吗?你的依据是什么吗?晶体与晶体性质实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。有些离子组成的物质在常温下甚至以液态形式存在。CuSO4 · 5H2O1-乙基-3-甲基咪唑四氟硼酸盐离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点KAl (SO4 )2· 12H2O有的还存在电中性分子( H2O、NH3等)。晶体与晶体性质根据晶体构成微粒和微粒间相互作用不同分为四种类型金属阳离子和自由电子金属键 原子离子键共价键分子分子间作用力阴、阳离子金属CuNaClCO2① Cs+和Cl-的空间位置关系?② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?阳离子半径大小不同③ 每个晶胞含Cs+、Cl-个数?8CsCl晶体的结构模型CsCl晶体的微观结构已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:② Cu+和Cl-的空间位置关系?① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。4CuCl晶体的结构模型课堂练习1.下列物质中,含有非极性共价键的离子晶体是( )A.NaOH B.Na2O2 C.NaCl D.AlCl32.已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;一般来说,两成键原子对应的元素间电负性差值大于1.7时,形成离子键;两成键原子对应的元素间电负性差值小于1.7时,形成共价键。下表给出了14种元素的电负性,则下列说法正确的是( )A.从表中数据看,C和S的电负性相等,所以C和S两元素原子间形成的键为非极性共价键B.根据电负性数据可知,SiCl4中含离子键,属于离子化合物C.根据电负性数据可知,Mg3N2中含有离子键D.BeCl2因含金属元素铍,故属于离子化合物3.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )A.该晶体属于分子晶体B.该晶胞中Zn2+和S2-数目不相等C. Zn2+周围等距离且最近的S2-为6D.氧化锌的熔点高于硫化锌4.萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )A.2 B.4 C.6 D.85.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。某同学画出的MgO晶胞结构示意图如下图所示,下列说法错误的是( )A.图中的错误的是⑧B.MgO是优良的耐高温材料,MgO的熔点比CaO的高C.NiO晶胞中Ni和O周围等距离且最近的O和Ni分别为6、6D.晶体中与每个O2-距离最近且等距离的O2-有6个课堂练习正确答案:B C D B D
相关资料
更多









