

39,2023山东省威海市火炬高技术产业开发区中考一模化学试题()
展开1.本卷共7页,共70分,考试时间80分钟。
2.所有答案必须涂写在答题卡上,写在试卷中的答案无效。
3.考试绪束启,本试卷和答题卡一并交回:
4.可能用到的相对原子质量:H:1C:12O:16C1:35.5S:32Fe:56Cu:64
一、选择题(本题包括10小题,每小愿?分,共20分。每小题只有一个选项符合题意)
1.“绿色环保”需要从我做起,从身边的小事做起。下列做法中符合“绿色”理念的是( )
A.工业废水只要无色透明就可以随意排放
B.防止工厂废气污染空气,将工厂烟囱加高
C.食堂餐厅大量使用一次性木筷、餐巾纸等物品
D.研发推广使用氢能源汽车
2.经过两年的化学学习,你认为下列以识不正确的是( )
A.具有相同质子数的一类粒子统称为元素
B.在物理变化中,分子种类不变
C.当原子失去或者得到电子后,其性质发生了改变
D.原子的质量几乎都集中在原子核上
3.如图是某化学反应的微观示意图,相同的球代表同种原子。下列说法不正确的是( )
A.分子由原子构成B.原子在化学反应中不可再分
C.该反应属于置换反应D.化学反应前后原子的种类和数目不变
4.科学探究中常用到推理的方法。根据下列实验事实推出结论正确的是( )
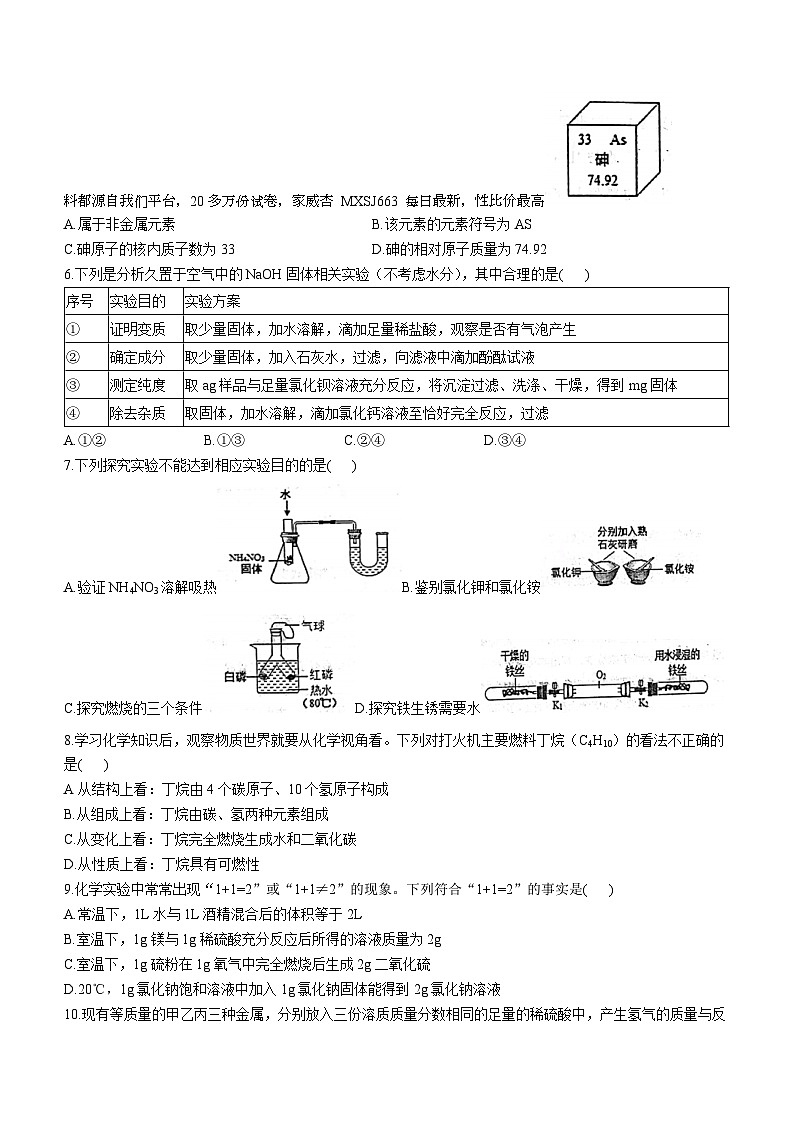
5.科学家利用“基因剪刀”技术降低了水稻中砷的含量。结合图示,有关砷的说法错误的是( )您看到的资料都源自我们平台,20多万份试卷,家威杏 MXSJ663 每日最新,性比价最高
A.属于非金属元素B.该元素的元素符号为AS
C.砷原子的核内质子数为33D.砷的相对原子质量为74.92
6.下列是分析久置于空气中的NaOH固体相关实验(不考虑水分),其中合理的是( )
A.①②B.①③C.②④D.③④
7.下列探究实验不能达到相应实验目的的是( )
A.验证NH4NO3溶解吸热B.鉴别氯化钾和氯化铵
C.探究燃烧的三个条件D.探究铁生锈需要水
8.学习化学知识后,观察物质世界就要从化学视角看。下列对打火机主要燃料丁烷(C4H10)的看法不正确的是( )
A从结构上看:丁烷由4个碳原子、10个氢原子构成
B.从组成上看:丁烷由碳、氢两种元素组成
C.从变化上看:丁烷完全燃烧生成水和二氧化碳
D.从性质上看:丁烷具有可燃性
9.化学实验中常常出现“1+1=2”或“1+1≠2”的现象。下列符合“1+1=2”的事实是( )
A.常温下,1L水与1L酒精混合后的体积等于2L
B.室温下,1g镁与1g稀硫酸充分反应后所得的溶液质量为2g
C.室温下,1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
D.20℃,1g氯化钠饱和溶液中加入1g氯化钠固体能得到2g氯化钠溶液
10.现有等质量的甲乙丙三种金属,分别放入三份溶质质量分数相同的足量的稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲乙丙在生成物中化合价均为+2价)则下列说法中不正确的是( )
A生成氢气的质量:甲>乙>丙B.金属活动性:乙>甲>丙
C.消耗硫酸的质量:甲>乙>丙D.相对原子质量:乙>丙>甲
二、填空与简答(本大题共5个小题,共30分)
11.(10分)化学与生产、生活
通过学习,我们可以从化学的角度看问题。节假日或双休日,去郊游野炊实为一大快事。然而,在野炊的乐趣之中,如果遇到下面一些问题,你是如何怎么处理的?
(1)对野炊有经验的的人会告诉你,餐具最好是导热性好,不易破碎的材料制的,你准备带的餐具是用______________制的;(填字母)
A.金属B.陶瓷C.无所谓
工业生产中常用赤铁矿来炼铁,写出其化学方程式______________;在生活中,我们很少使用纯铁,而通常将铁制成合金使用,因为将金属制成合金后有了更优越的性能如______________,纯铁和铁合金在组成上的不同点是______________。
(2)野餐食谱如下:主食:馒头配菜:烤火腿、细鱼汤、五香豆干。主食和配菜中主要含蛋白质、_____________、油脂、无机盐和水等营养素,从营养角度来看,你准备再添—样______________。(填字母)
A.炒鸡蛋B.牛奶C.黄瓜D.烤野免肉
(3)有的同学带了自热米饭,原理是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为______________,其基本反应类型是______________。
(4)在引燃细枯枝后,如果迅速往“灶”里塞满枯枝。结果反而燃烧不旺,并产生很多浓烟,说明物质充分燃烧需要的条件是______________。
(5)郊外道路比较泥泞,如果你的交通工具是自行车,你返程后即对自行车进行清洗,做到如何防锈的措施是:______________。(填字母)
A.立即晾晒干B.链条传动部件涂上油C.涂油漆
12.(4分)物质的构成
(1)世界上的物质都是由元素组成的,而物质又是由原子,分子和离子等基本粒子构成的。在宏观物质——微现构成——符号之同建立联系,是化学学科特有的思维方式。现有氢、碳、氧、钠、铜、氯六种元素,请按要求填写下表中的空白:
13.(5分)化学工流程
我国将力争2060年前实现碳中和,CO2的捕捉可减少碳排放。下图是“捕捉”(吸收)CO2部分流程图:
(1)CO2用途广泛,写出一条用途:______________;操作①的名称是______________。
(2)捕捉室中NaOH溶液常喷成雾状,原因是______________;对应的反应的化学方程式为______________。
(3)“碳转化”也是处理二氧化碳的重要方法。如下图利用皮气中的二氧化碳制取甲烷的微观示意图:
写出二氧化碳制取甲烷的化学方程式:______________。
14.(7分)金属材料在日常生活中广泛使用(7分)
(1)高温条件下,一氧化碳可把铁从磁铁矿石(Fe3O4)中还原出来,反应的化学方程式是______________。某化学兴趣小组的同学对一份磁铁矿石样品(设铁矿石杂质不含铁元素和氧元素)进行探究,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示。样品中Fe3O4的质量是______________g;生铁和钢都是铁合金,其中含碳量较高是______________。
图1图2
(2)黄铜是铜和锌的合金。向黄铜样品中加入200g稀硫酸,恰好完全反应,产生0.2g氢气。则所用稀硫酸的溶质质量分数是______________。除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有______________。(填序号)
①锌的质量②锌的质量分数③铜的质量分数
④硫酸锌的质量⑤硫酸溶液的体积
(3)铝是一种比较耐腐蚀的金属材料,这是因为铝在空气中能生成一种薄膜______________(填化学式),如果用铝来制取氢气,那么需要操作______________(填编号),才能达到实验目的。
A.用砂纸打磨表面B.用水浸泡C.用稀盐酸浸泡一段很长时间
15.(4分)碳循环和氧循环
自然界中的“碳循环”和“氧循环”为生态系统的正常运转提供了可靠的资源保障,循环过程中CO2起着非常重要的作用,如图是这种作用的具体体现之一。
第7题图
(1)CO2的水溶液能使紫色石蕊试液变红色,其原因是______________(用化学方程式表示)。
(2)有机物A完全燃烧的化学方程式,则A的化学式是________________。
(3)下列关于“碳循环”和“氧循环”的说法错误的是_______________(填序号,下同)。
A.无机物和有机物性质不同,但在一定条件下能相互转化
B.碳循环和氧循环分别是指二氧化碳和氧气的循环
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定
(4)煤的燃烧会产生大量CO2;通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁。下列说法正确的是_______________。
A.煤加工成焦炭的变化属于物理变化
B.人类只能通过燃料的燃烧获取能量
C.煤燃烧产生的二氧化碳是污染空气的主要物质
D.煤是复杂的混合物,除了含有碳、氢元素外,还含有少量硫、氮等元素
三、实验与探究(本大题共2个小题,共14分)
16.(7分)小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先随之升高,最后下降到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
某金属与同体积盐酸溶液反应实验数据表
(1)用实际参加反应的粒子表示锌与稀盐酸反应的实质_______________。
(2)分析实验数据得出:一定质量的某种金属和同体积盐酸反应,形响金属和酸反应快慢的主要因素有______________、_______________。其中,实验1和实验2进行对照实验,探究的影响反应速率的因素是_______________。
(3)可以通过比较_______________实验数据来确定金属和酸反应的快慢。
(4)根据其他测定方法,实验小组的同学绘制了锌粒与稀盐酸反应产生氢气的速率随时间变化的曲线,如右图所示。请据图分析:
时间0-t内,反应速率逐渐加快的主要原因是_______________,时间t以后,反应速率逐渐减慢的主要原因是_______________。
17.(7分)某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶收集一瓶纯净的CO2,按图示组装装置。用注射器缓缀注入3LNaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、B装置中发生连锁反应。回答下列问题:
(1)图中仪器X的名称是_______________。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是_______________。
(3)“连锁反应”后,C试管中溶液的颜色变化为_______________;E试管中的现象为_______________,反应的化学方程式为_______________。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩余,你认为是否正确?_______________。说明原因:_______________。
四、(6分)计算题
18.某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示:
试计算:
(1)(1分)产生沉淀的总质量是_______________克;
(2)(5分)计算109.8g废液中氯化铜的质量?编号
实验事实
实验结论
A
某溶液使酚酞溶液变红
该溶液一定是NaOH溶液
B
某物质可以导电
该物质一定是金属单质
C
常温下,测定某溶液的PH=3
该溶液一定呈酸性
D
某气体不能使带火星的木条复燃
该气体一定不含氧气
序号
实验目的
实验方案
①
证明变质
取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生
②
确定成分
取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液
③
测定纯度
取ag样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到mg固体
④
除去杂质
取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤
编号
组成物质的要求
物质的名称
物质的化学式
构成物质的粒子(用化学符号表示)
示例
一种气体单质
氧气
O2
O2
①
常做导线的一种金属单质
②
由三种元素组成的一种可溶性盐
③
由三种元素组成的有机物,可作燃料
实验编号
盐酸溶液浓度
反应开始时酸溶液的温度
反应开始到2分钟产生的气体体积
反应结束共产生气体体积
1
10%
20℃
19ml
118ml
2
15%
20℃
28ml
175ml
3
10%
35℃
72ml
118ml
4
15%
35℃
103ml
175ml
02,2023年山东省威海市火炬高技术产业开发区中考一模化学试题: 这是一份02,2023年山东省威海市火炬高技术产业开发区中考一模化学试题,共7页。
2023山东省威海市火炬高技术产业开发区中考一模化学试题: 这是一份2023山东省威海市火炬高技术产业开发区中考一模化学试题,共7页。
2022年山东省威海市临港区中考一模化学试题: 这是一份2022年山东省威海市临港区中考一模化学试题,共8页。












