
宁夏回族自治区银川一中2023-2024学年高三上学期第六次月考试题理综化学试卷(Word版附解析)
展开
这是一份宁夏回族自治区银川一中2023-2024学年高三上学期第六次月考试题理综化学试卷(Word版附解析),共30页。试卷主要包含了作答时,务必将答案写在答题卡上,25等内容,欢迎下载使用。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的原子量:H-1 C-12 N-14 O-16 S-32 Sc-45 Fe-56 Ba-137 C-59
一、选择题:本题包括13小题。每小题6分,共78分,在每小题给出的四个选项中,只有一个选项符合题意。
1. 化学与生活密切相关,下列说法不符合这一主题的是
A. GaN具有半导体的性质,常用作LED灯的芯片,属于新型无机非金属材料
B. 聚乙烯可用于制作食品包装袋,不能使酸性高锰酸钾溶液褪色
C. 开采可燃冰有助于实现“碳中和”
D. 黑索金()常用作导弹中的炸药,爆炸时可产生等物质的量的
2. 我国科学家利用CO2合成淀粉的核心反应如图所示,设NA为阿伏加德罗常数的值,下列说法正确的是
A. 反应①消耗2.2g CO2时,转移电子数0.6NA
B. 标准状况下22.4L H2O2所含的非极性键数为NA
C. 30 g HCHO与DHA混合物中含氧原子数为2NA
D. 16.2 g淀粉在氧气中燃烧可生成CO2分子数为0.6NA
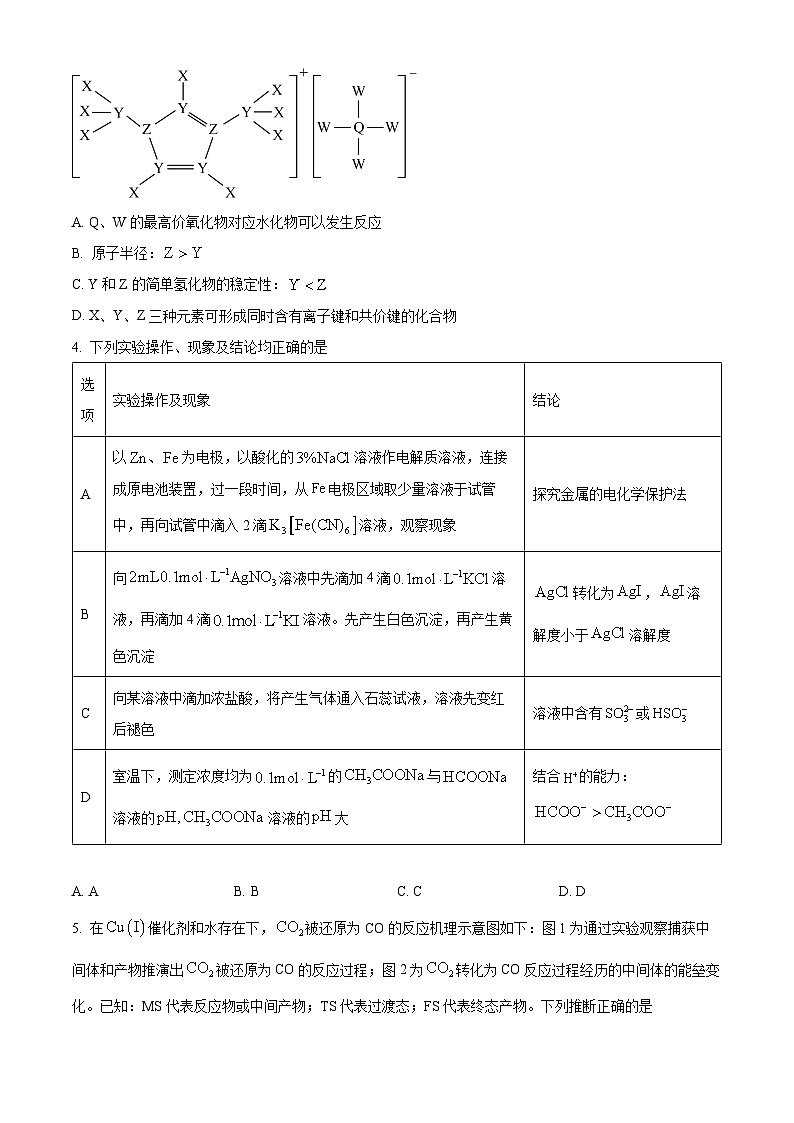
3. 某种电化学的电解液的组成如图所示,X、Y、Z、Q、W为原子序数依次增大的短周期元素,下列说法错误的是
A. Q、W的最高价氧化物对应水化物可以发生反应
B. 原子半径:
C. Y和Z的简单氢化物的稳定性:
D. X、Y、Z三种元素可形成同时含有离子键和共价键的化合物
4. 下列实验操作、现象及结论均正确的是
A. AB. BC. CD. D
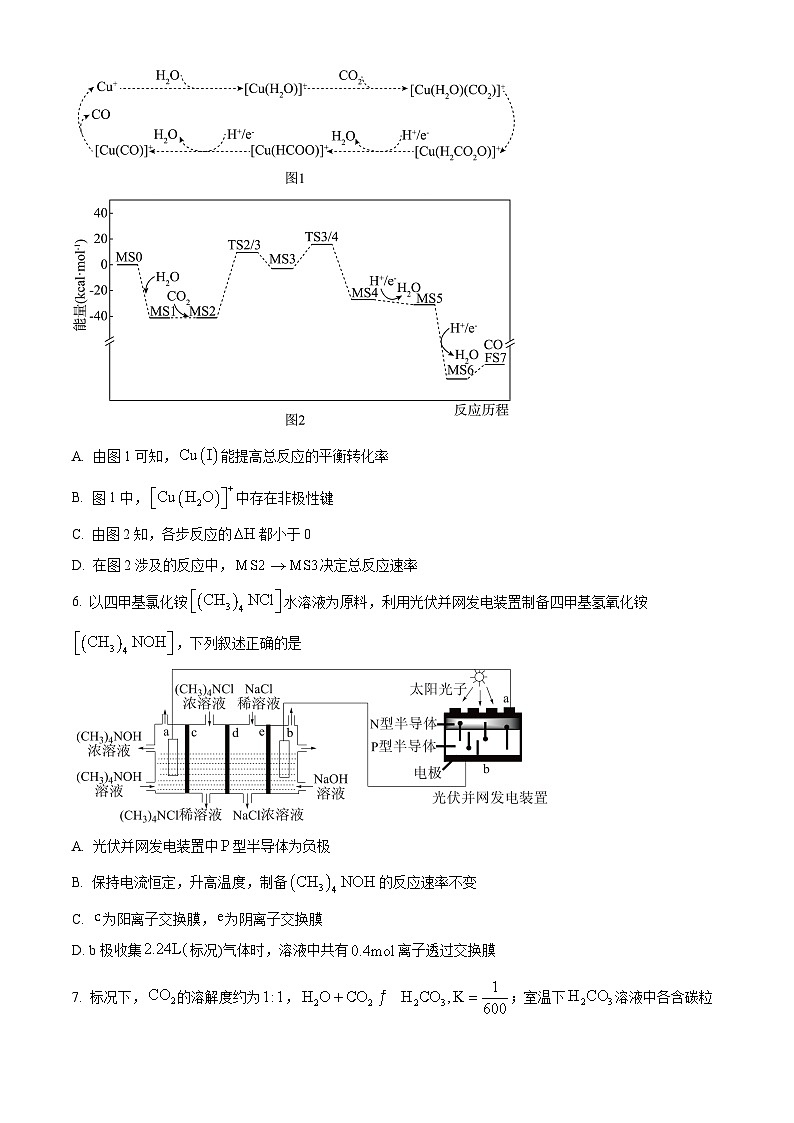
5. 在催化剂和水存在下,被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出被还原为CO的反应过程;图2为转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
A. 由图1可知,能提高总反应的平衡转化率
B. 图1中,中存在非极性键
C. 由图2知,各步反应的都小于0
D. 在图2涉及的反应中,决定总反应速率
6. 以四甲基氯化铵水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵,下列叙述正确的是
A. 光伏并网发电装置中型半导体为负极
B. 保持电流恒定,升高温度,制备的反应速率不变
C. 为阳离子交换膜,为阴离子交换膜
D. b极收集标况)气体时,溶液中共有离子透过交换膜
7. 标况下,的溶解度约为,;室温下溶液中各含碳粒子的物质的量分数与的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中与的关系如图2所示,下列说法正确的是
A. 饱和碳酸的浓度约为
B. 对应的溶液中存在:
C. 的过程中,溶液中逐渐减小
D. 点对应溶液的为9.25
8. 硫酸亚硝酰合铁(Ⅱ)在化学分析、金属腐蚀抑制剂、染料工业、医药领域等方面具有重要的应用价值。某兴趣小组利用废铁屑为原料制备硫酸亚硝酰合铁(Ⅱ),并测定其化学式。
Ⅰ.用废铁屑制备溶液
(1)将废铁屑放入溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中溶液的作用是___________。
(2)将处理好的铁屑放入锥形瓶,加入适量的溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因___________。
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是___________。
Ⅱ.用NO气体和溶液制备硫酸亚硝酰合铁(Ⅱ)
装置如图所示(加热及夹持装置略)。
(3)圆底烧瓶中生成NO的同时还生成了,该反应的离子方程式为___________。
(4)实验开始前需先鼓入,其目的是___________。
Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为。
步骤i.用酸性溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性溶液16.00 mL(NO完全转化为);
步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
(5)已知硫酸亚硝酰合铁(Ⅱ)中的配位数为6,则化学式中___________。
(6)酸性溶液应盛装在___________(填“酸”或“碱”)式滴定管中,若滴定前未润洗该滴定管,会导致b的数值___________(填“偏大”或“偏小”)。
9. 稀土金属钪(Sc)及其化合物在电子、超导合金和催化剂等领域有重要应用。以工业钛白水解废酸液(含Sc3+、TiO2+、Fe3+、H+、等离子)为原料,制取氧化钪(Sc2O3)和单质钪的工艺流程如图:
已知:①Ksp[Sc(OH)3]=8×10-31
②“沉钪”所得固体是水合复盐沉淀,其化学式为3NH4Cl·ScF3·6H2O
(1)在酸洗时,加入H2O2的作用是___________(填标号)。
A.作氧化剂B.作还原剂C.作配体
(2)反萃取步骤中,加入NaOH溶液后生成Sc(OH)3沉淀。若沉淀后溶液的pH=8(常温下),则残留的Sc3+的质量浓度是___________mg/L。
(3)“灼烧”得到Sc2O3.若灼烧Sc2(C2O4)3·6H2O也能得到Sc2O3,其在空气中热分解温度区间和分解得到的固体产物如下表所示:
由含钪化合物A转化为Sc2O3时,发生反应的化学方程式为___________。
(4)含钪元素的微粒与pF[pF=-lgc(F-)]、pH的关系如图所示,用氨水调节溶液的pH最好小于___________,“沉钪”所得滤液中c(F-)应大于___________ml·L-1。
(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是___________(用化学方程式表示)。该流程中,“脱水除铵”可制得高纯度ScF3,原因是___________。
10. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生两步构成,气化炉中涉及到的反应如下:
I.
Ⅱ.
Ⅲ.
Ⅳ.
①该工艺制总反应可表示为,该反应的平衡常数___________(用等的代数式表示)。
②绝热条件下,将以体积比充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________。
A.与比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.不变
(2)的速率方程为,(、为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率等于正、逆反应速率之差,平衡时,___________(填“>”、“N,故B错误;
C.非金属性:N>C,非金属性越强氢化物越稳定,简单氢化物的稳定性:CH4<NH3,故C正确;
D.X、Y、Z三种元素可形成既含离子键又含共价键的化合物如NH4CN,故D正确;
故选:B。
4. 下列实验操作、现象及结论均正确的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.锌活泼性大于铁,锌为负极、铁为正极,正极不会形成亚铁离子,滴入2滴溶液不会生成蓝色沉淀,能探究金属的电化学保护法,A正确;
B.反应中过量的银离子会和碘离子生成碘化银沉淀,不能说明转化为,B错误;
C.SO2气体不能使石蕊试液褪色,生成的气体可能为氯气等气体,氯气的水溶液也会出现相同的现象,C错误;
D.室温下,测定浓度均为的与溶液的pH,CH3COONa溶液的大,说明醋酸根离子的水解程度更大,醋酸根离子结合氢离子能力更强,D错误;
故选A。
5. 在催化剂和水存在下,被还原为CO的反应机理示意图如下:图1为通过实验观察捕获中间体和产物推演出被还原为CO的反应过程;图2为转化为CO反应过程经历的中间体的能垒变化。已知:MS代表反应物或中间产物;TS代表过渡态;FS代表终态产物。下列推断正确的是
A. 由图1可知,能提高总反应的平衡转化率
B. 图1中,中存在非极性键
C. 由图2知,各步反应的都小于0
D. 在图2涉及的反应中,决定总反应速率
【答案】D
【解析】
【详解】A.由图1可知,为催化剂,催化剂不影响平衡,不能提高总反应的平衡转化率,A错误;
B.中存配位键和极性共价键,不含非极性键,B错误;
C.由图2知,MS2→MS3为吸热反应,ΔH>0,C错误;
D.在多步反应体系中,反应速率最慢的反应决定了反应的总速率,活化能越高,反应速率越慢,由图2知,MS2→MS3活化能最大,反应速率最慢,决定了总反应速率,D正确;
故选D。
6. 以四甲基氯化铵水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵,下列叙述正确的是
A. 光伏并网发电装置中型半导体负极
B. 保持电流恒定,升高温度,制备的反应速率不变
C. 为阳离子交换膜,为阴离子交换膜
D. b极收集标况)气体时,溶液中共有离子透过交换膜
【答案】B
【解析】
【分析】根据图示可知,左池为电解池,右池为原电池。根据左池NaCl溶液的浓度变化可知,Cl-往右移动,d为阴离子交换膜,Na+往左边移动,e为阳离子交换膜。根据离子移动方向可知,a极为阴极,b极为阳极。a与N相连,b与P相连,故光伏并网发电装置中,N型半导体为负极,P型半导体为正极。
【详解】A.根据上述分析可知,光伏并网发电装置中型半导体为正极,A错误;
B.保持电流恒定,即单位时间内a极得到的电子数目是恒定的,电极反应的速率也将恒定,升温并不会提高反应速率,B正确;
C.根据左池的浓度变化,可知向最左端移动,故c膜为阳离子交换膜。根据上述分析可知,e膜也为阳离子交换膜,C错误;
D.b极发生的反应为:,故b极收集到0.1ml气体时,转移0.4mle-,而溶液中通过离子交换膜的离子有、Cl-、Na+,由于三者都只带1个电荷,故移动的物质的量均为0.4ml,故通过离子交换膜的离子的总物质的量为1.2ml,D错误;
故选B。
7. 标况下,的溶解度约为,;室温下溶液中各含碳粒子的物质的量分数与的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中与的关系如图2所示,下列说法正确的是
A. 饱和碳酸的浓度约为
B. 对应的溶液中存在:
C. 的过程中,溶液中逐渐减小
D. 点对应溶液的为9.25
【答案】C
【解析】
【详解】A.由题给信息可知,标准状况下,二氧化碳的溶解度为1:1,则1L饱和碳酸溶液中二氧化碳的浓度约为ml/L,由方程式可知,平衡常数K==,则碳酸的浓度为×ml/L≈7.4×10—5 ml/L,故A错误;
B.由图可知,溶液中为0时,溶液中碳酸根离子和碳酸氢根离子浓度相等,溶液的pH为10.25,溶液中氢离子浓度小于氢氧根离子浓度,由电荷守恒关系可知,溶液中,故B错误;
C.由图可知,a→b的过程中,溶液中增大,则溶液中减小;溶液中==,碳酸的一级电离常数不变,则溶液中和的值减小,故C正确;
D.由图1可知,溶液中碳酸根离子和碳酸氢根离子浓度相等,溶液的pH为10.25,则碳酸的二级电离常数Ka2(H2CO3)= = c(H+)=10—10.25,由图2可知,b点溶液中为2,则溶液中氢离子浓度为10—10.25×100ml/L=10—8.25ml/L,溶液pH为8.25,故D错误;
故选C。
8. 硫酸亚硝酰合铁(Ⅱ)在化学分析、金属腐蚀抑制剂、染料工业、医药领域等方面具有重要的应用价值。某兴趣小组利用废铁屑为原料制备硫酸亚硝酰合铁(Ⅱ),并测定其化学式。
Ⅰ.用废铁屑制备溶液
(1)将废铁屑放入溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中溶液的作用是___________。
(2)将处理好的铁屑放入锥形瓶,加入适量的溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因___________。
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是___________。
Ⅱ.用NO气体和溶液制备硫酸亚硝酰合铁(Ⅱ)
装置如图所示(加热及夹持装置略)。
(3)圆底烧瓶中生成NO的同时还生成了,该反应的离子方程式为___________。
(4)实验开始前需先鼓入,其目的是___________。
Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为。
步骤i.用酸性溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性溶液16.00 mL(NO完全转化为);
步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
(5)已知硫酸亚硝酰合铁(Ⅱ)中的配位数为6,则化学式中___________。
(6)酸性溶液应盛装在___________(填“酸”或“碱”)式滴定管中,若滴定前未润洗该滴定管,会导致b的数值___________(填“偏大”或“偏小”)。
【答案】(1)除去铁屑表面的油污
(2) ① 、 ②. 抽滤可使过滤速度更快;趁热过滤可防止晶体析出
(3)
(4)排出装置内空气,防止生成NO被氧气氧化和防止被氧化
(5)
(6) ①. 酸 ②. 偏小
【解析】
【小问1详解】
碳酸钠溶液显碱性,可以除去铁屑表面的油污;
【小问2详解】
①铁屑表面的氧化铁与稀硫酸反应生成铁离子,铁离子再与铁反应生成亚铁离子,涉及的离子方程式为:、;
②如图的装置采用了抽滤装置,能够让过滤装置与锥形瓶的压强差变大,可以加快过滤速度,趁热过滤可以防止晶体析出;
【小问3详解】
圆底烧瓶中稀硫酸与亚硝酸钠反应,N元素发生歧化反应,生成NO和硝酸钠,反应的离子方程式为:;
【小问4详解】
实验前要排除装置内的空气,目的是防止生成的NO被氧气氧化和防止被氧化;
【小问5详解】
硫酸亚硝酰合铁(Ⅱ)化学式可表示为,10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量溶液,过滤后得到沉淀,将沉淀洗涤干燥得到2.33 g硫酸钡,即n(SO)=0.01ml,则20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液中含有0.02ml SO,根据化学式可知Fe2+的个数等于SO个数,即则20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液中含有0.02mlFe2+,根据关系式5Fe2+,则0.02mlFe2+消耗的为0.004ml,剩余的为0.012ml则与NO反应,根据关系式35NO,可得n(NO)= 0.012m=0.02ml=n(Fe2+),即可得a=c=1,的配位数为6,b=5,故;
【小问6详解】
酸性溶液应盛装在酸式滴定管中,若滴定前未润洗该滴定管,则高锰酸钾溶液的总体积会偏大,会导致a的值偏大,则b的值偏小。
9. 稀土金属钪(Sc)及其化合物在电子、超导合金和催化剂等领域有重要应用。以工业钛白水解废酸液(含Sc3+、TiO2+、Fe3+、H+、等离子)为原料,制取氧化钪(Sc2O3)和单质钪的工艺流程如图:
已知:①Ksp[Sc(OH)3]=8×10-31
②“沉钪”所得固体是水合复盐沉淀,其化学式为3NH4Cl·ScF3·6H2O
(1)在酸洗时,加入H2O2的作用是___________(填标号)。
A.作氧化剂B.作还原剂C.作配体
(2)反萃取步骤中,加入NaOH溶液后生成Sc(OH)3沉淀。若沉淀后溶液的pH=8(常温下),则残留的Sc3+的质量浓度是___________mg/L。
(3)“灼烧”得到Sc2O3.若灼烧Sc2(C2O4)3·6H2O也能得到Sc2O3,其在空气中热分解温度区间和分解得到的固体产物如下表所示:
由含钪化合物A转化为Sc2O3时,发生反应的化学方程式为___________。
(4)含钪元素的微粒与pF[pF=-lgc(F-)]、pH的关系如图所示,用氨水调节溶液的pH最好小于___________,“沉钪”所得滤液中c(F-)应大于___________ml·L-1。
(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是___________(用化学方程式表示)。该流程中,“脱水除铵”可制得高纯度ScF3,原因是___________。
【答案】(1)C (2)3.6×10-8
(3)2Sc2(C2O4)3+3O22Sc2O3+12CO2
(4) ①. 4.2 ②. 1.0×10-4.2
(5) ①. ScF3+H2OScOF+2HF(或ScF3·6H2OScOF+2HF+5H2O) ②. “除铵”时NH4Cl分解生成HCl,抑制Sc3+的水解
【解析】
【分析】由题给流程可知,赤泥加入钛白废酸酸浸时,金属氧化物溶于硫酸得到可溶性的金属硫酸盐,二氧化硅不溶解,过滤得到含有二氧化硅的滤渣和含TiO2+、Sc3+、Fe3+、Al3+的硫酸盐溶液,向滤液中加入磷酸酯萃取剂萃取滤液中的TiO2+、Sc3+,分液得到含有Fe3+、Al3+的水相和含有TiO2+、Sc3+的有机相,有机相用稀硫酸洗涤后,再加入H2O2,TiO2+与H2O2络合进入水相,分液后除去,再向有机相中加入NaOH溶液将Sc3+转化为Sc(OH)3沉淀,过滤后,向Sc(OH)3沉淀加入盐酸使其转化为ScCl3,加氨水调溶液pH,加NH4F沉钪得到ScF3,用Mg热还原ScF3得到Sc。
【小问1详解】
由图可知TiO2+加入H2O2后,TiO2+与H2O2结合形成[TiO(H2O2)]2+,该转化过程元素化合价没发生变化,应该是H2O2中的氧原子提供孤电子对,TiO2+中Ti原子提供空轨道,形成配合离子,H2O2作配体,故A、B错误,C正确,故答案为:C;
【小问2详解】
若沉淀后溶液的pH=8(常温下),c(OH-)=10-6ml/L,则残留的Sc3+的物质的量浓度是,质量浓度为810-13ml/L45g/ml1000mg/g=3.6×10-8mg/L。
【小问3详解】
在温度为383~423K时,Sc2(C2O4)3·6H2O的失重百分率为19.48,则失去质量为462×0.1948=89,若失重质量为水的质量,则失去水的数目为n(H2O)=,故生成的含钪化合物A化学式为Sc2(C2O4)3·H2O;
在加热温度463~508K时,Sc2(C2O4)3·6H2O的失重百分率为23.38,若失重质量为水的质量,则失去质量为462×0.2338=108,则失去水的数目为n(H2O)=,Sc2(C2O4)3·6H2O恰好完全失去结晶水,故生成的含钪化合物B化学式为Sc2(C2O4)3,则由含钪化合物B在空气中煅烧转化为Sc2O3时,反应同时产生CO2气体,根据电子守恒、原子守恒,可得发生反应的化学方程式为:2Sc2(C2O4)3+3O22Sc2O3+12CO2。
【小问4详解】
由流程可知,加氨水调pH维持Sc以Sc3+形式存在,以便后续与F–结合生成ScF3,还需防止Sc3+与OH-结合,故调节溶液的pH最好小于4.2;由图可知,“沉钪”需要将Sc3+转化为ScF3,pF应小于4.2,则c(F–)应大于1.0×10–4.2ml·L-1,故答案为:4.2;1.0×10–4.2;
【小问5详解】
ScF3·6H2O高温脱水得到ScF3,但通常含有ScOF杂质,原因是高温脱水时,ScF3会与水反应生成ScOF,结合原子守恒,反应的化学方程式为ScF3+H2OScOF+2HF(或ScF3·6H2OScOF+2HF+5H2O);流程中“沉钪”后“脱水除铵”可制得高纯度ScF3的原因是“除铵”时NH4Cl分解生成HCl,抑制Sc3+的水解,故答案为:ScF3+H2OScOF+2HF(或ScF3·6H2OScOF+2HF+5H2O);“除铵”时NH4Cl分解生成HCl,抑制Sc3+的水解。
10. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生两步构成,气化炉中涉及到的反应如下:
I.
Ⅱ.
Ⅲ.
Ⅳ.
①该工艺制总反应可表示为,该反应的平衡常数___________(用等的代数式表示)。
②绝热条件下,将以体积比充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________。
A.与比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.不变
(2)的速率方程为,(、为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率等于正、逆反应速率之差,平衡时,___________(填“>”、“
相关试卷
这是一份四川省叙永第一中学2023-2024学年高三上学期期末考试理综化学试卷(Word版附解析),文件包含四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学Word版含解析docx、四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学Word版无答案docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份四川省成都市石室中学2023-2024学年高三上学期期末考试理综化学试卷(Word版附解析),文件包含四川省成都市石室中学2023-2024学年高三上学期期末考试理综试题-高中化学Word版含解析docx、四川省成都市石室中学2023-2024学年高三上学期期末考试理综试题-高中化学Word版无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份四川省泸县第一中学2023-2024学年高三上学期10月月考理综化学试题(Word版附解析),共15页。试卷主要包含了考试时间150分钟,满分300,2ml电子时,负极质量变化为2等内容,欢迎下载使用。










