









化学必修 第一册第一节 物质的分类及转化公开课第一课时教案
展开宏观辨识与微观探析: 从不同层次认识物质的多样性,并对物质进行分类。初步掌握物质的分类方法。通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。证据推理与模型认知: 建立分类的模型,即分类目的决定分类标准,分类标准决定分类结果。建立物质转化模型,认识物质的变化规律。科学探究与创新意识: 感受分类方法对化学研究和学习的重要作用,体会日常生产、生活中分类法的应用。
1.认识元素可以组成不同种类的物质。2.感受分类方法对化学学科学习的重要作用。3.通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。重点:让学生建立分类的思想并掌握常见化学物质的分类方法,掌握相关物质间的化学反应关系。难点:分类法的理解及其应用,建立物质转化模型,认识物质的变化规律。
1、初中学习中,将元素分为了 元素和 元素;其中Na、Mg、Al、Fe、Cu、Zn等属于 元素,O、S、P、Cl等属于 。元素。2、我们还知道,对于自然界中的物质,从状态上可分为 、 、 三态。例如:对于空气、水、硫酸、矿石、石油、煤炭,从状态分类,可以将 归为一类,将 归为一类,将 归为一类。3、对于化合物,我们可以根据组成特点,把它们分为: 、 、 、 、四大类,是否还可以对它们继续分类?试举一例。4、对于化学反应,在初中我们把它们分为四种基本反应类型。分别是 、 、 、 。
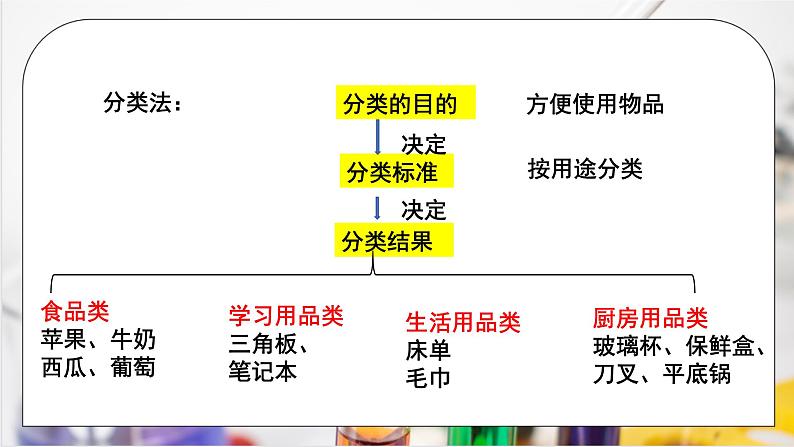
思考:从超市采购的物品如何分类?
食品类苹果、牛奶西瓜、葡萄
学习用品类三角板、笔记本
厨房用品类玻璃杯、保鲜盒、刀叉、平底锅
1、分类法(1)分类是根据研究对象的 和 ,将它们区分为不同 和 的科学方法。科学的分类能够反映事物的本质 ,有利于人们分门别类地进行深入研究。
(2)常见的分类方法分类有一定的 ,根据不同的 ,人们对研究对象进行不同的分类。
一、根据物质的组成和性质分类
交叉分类法:对同类物质采用不同标准进行分类的方法,分类的标准有多个。
树状分类法:对同类事物进行再分类的方法,分级,递进,每一级一个分类标准。
2、物质的元素组成:根据 对物质进行分类是化学研究的基础。
由同一种元素形成几种性质不同的单质,叫做这种元素的同素异形体。
例如:C60 、金刚石、石墨 ;O2和O3;红磷、白磷。
(1)只由一种元素组成的物质一定是纯净物吗?
提示—只由一种元素组成的物质不一定是纯净物,例如氧元素的同素异形体O2和O3形成的混合气体,只由氧元素组成,不是纯净物。
(2)从宏观上看物质由元素组成,从微观上看构成物质的微粒有哪些?
提示—构成物质的微粒有原子、分子或离子。如金刚石由原子构成,CO、CO2、H2、H2O等均由分子构成,NaCl、CaCO3等均由离子构成。
请对短文中红色标注的物质进行分类:
氢是元素周期表中原子序数为1的元素,含氢元素的物质有H2、H2O、H2SO4等。碳是组成生物体的主要元素之一,金刚石、石墨、C60、温室气体之一的CO2中都有碳元素的身影。钠是一种活泼的金属,生理盐水中的NaCl、碱面里的Na2CO3、管道疏通剂的有效成分NaOH中都含有钠元素。钙是生长发育所必须的元素,自热米饭发热包中的CaO、用来杀菌除虫的波尔多液[由Ca(OH)2和CuSO4配制而成]、大理石的主要成分CaCO3都含有钙元素。做X射线检查肠胃病时,病人服用BaSO4浊液,俗称“钡餐”
NaCl溶液BaSO4浊液
H2、C60金刚石、石墨
NaOHCa(OH)2
基于物质的组成、结构、性质、用途等多角度进行分类:
运用分类的思想对氧化物进行再认识:
Na2OCO2H2OFe2O3CaOSO3
Na2O、Fe2O3、CaO
CO2、H2O、SO3
CO2能用NaOH溶液吸收
同一类物质是否应该具有相似的性质?
【资料:几种氧化物的重要化学性质】
CaO+2HCl=CaCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
Na2O+2HCl=2NaCl+H2O
CO2+2NaOH=Na2CO3+H2O
SO3+2NaOH=Na2SO4+H2O
酸性氧化物:CO2、SO2、SiO2、Mn2O7
碱性氧化物:CaO、Na2O、Fe2O3
两性氧化物:Al2O3
不成盐氧化物:CO、NO
过氧化物:Na2O2、H2O2
其他氧化物:NO2、Fe3O4
【资料:氧化物的类型】
Na2OFe2O3CaO
大多数的金属氧化物是碱性氧化物
大多数的非金属氧化物是酸性氧化物
4、酸性氧化物也不一定都是非金属氧化物,如Mn2O7。5、酸性氧化物不一定能与水反应生成酸,碱性氧化物不一定能与水反应生成碱,如Fe2O3是碱性氧化物,但它不能与水反应生成Fe(OH)3。
1、金属氧化物一定是碱性氧化物?2、非金属氧化物一定是酸性氧化物?3、酸性氧化物都能溶于水生成相应的酸?
知识拓展:NO、CO等氧化物既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物。
( HCl 、HNO3)
( HCl 、HBr、HI)
( H2CO3、H2SO4)
( HCl 、 H2SO4 、HNO3)
( H2CO3、H2SO3、HF、HClO)
( Fe(OH)3、Al(OH)3)
( Mg(OH)2、Cu(OH)2)
( NaOH、Ba(OH)2)
按电离出OH-的个数分
( NaOH、KOH)
( Mg(OH)2、 Ba(OH)2 )
( NaOH、Ba(OH)2、KOH、Ca(OH) 2)
(NH3·H2O、Mg(OH)2 )
NaCl、AgNO3、CuSO4
CaCO3、BaSO4、ZnS
KNO3、KMnO4、FeSO4
NaCl、ZnS、CaCl2
KHSO4、 Ca(H2PO4)2
Cu2(OH)2CO3
NaCl、 BaSO4
【思考与讨论】酸的主要化学性质归纳如下,请列举反应实例,完成下表。
思考:为什么不同的酸具有相似的化学性质?
因为:酸的组成上有相似性,即其水溶液中均有H+。
思考:为什么不同的碱具有相似的化学性质?
因为:碱的组成上有相似性,即其水溶液中均有OH- 。
思考:盐的性质如何体现?
同一类型的盐由相应的酸根或阳离子体现。铜盐可与Fe等金属发生置换反应是因为含有Cu2+。碳酸盐可与盐酸等强酸发生复分解反应是由于含有CO32-。
金属单质Ca转化为CaSO4(盐)的流程:
①2Ca + O2 = 2CaO
②CaO + H2O = Ca(OH)2
③Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
④Ca(OH)2 + SO3 = CaSO4 + H2O
①2Na + O2 = Na2O
②Na2O + H2O = 2NaOH
③2NaOH + H2CO3 = Na2CO3 + 2H2O
④2NaOH + CO2 = Na2CO3 + H2O
写出金属单质Na到对应盐Na2CO3的转化过程:
非金属单质C转化为对应Na2CO3(盐)的流程:
②CO2 + H2O = H2CO3
③H2CO3 + 2NaOH = Na2CO3 + 2H2O
④H2CO3 + Na2O = Na2CO3 + H2O
②SO2 + H2O = H2SO3
③H2SO3 + 2NaOH = Na2SO3 + 2H2O
④H2SO3 + Na2O = Na2SO3 + H2O
写出非金属单质S到对应盐Na2SO3的转化过程:
从物质分类的角度,有如下转化:
【思考】如何制备氢氧化钠?
上述过程的成本都较高,现在的工业生产中,一般选择电解饱和食盐水的方法来生产氢氧化钠。
Na2O + H2O = 2NaOH
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
练习1、下列有关物质的分类错误的是( )A.混合物:医用酒精、空气、稀硫酸B.化合物:烧碱、氧化镁、硫酸C.盐:氯化钠、石灰石、生石灰 D.单质:石墨、臭氧、水银
练习2、下列有关氧化物的判断正确的是( )A.凡是含氧的化合物均可称为氧化物B.依据性质不同氧化物只能分为酸性氧化物和碱性氧化物C.酸性氧化物都能与碱反应生成盐和水D.金属氧化物一定是碱性氧化物
练习3、下列物质分类正确的是( )
有以下几种物质:①液态氧 ②硝酸钾溶液 ③胆矾晶体 ④干冰 ⑤生石灰 ⑥金刚石 ⑦纯碱 ⑧甲烷 ⑨熟石灰 ⑩食盐水 ⑪石灰水 ⑫KClO3 ⑬H2SO4 ⑭碱式碳酸铜[Cu2(OH)2CO3] ⑮硫酸氢钠。其中,属于混合物的有 ,属于正盐的是 ;属于酸的有 ,属于碱的是 ;属于氧化物的是 ;属于单质的是 。
①⑥
同素异形体:由同一种元素形成几种性质不同的单质
人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应优秀第一课时教案: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t8/?tag_id=27" target="_blank">第一章 物质及其变化第三节 氧化还原反应优秀第一课时教案</a>,文件包含核心素养人教版高中化学必修一《氧化还原反应》第一课时课件pptx、核心素养人教版高中化学必修一《氧化还原反应》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。
高中人教版 (2019)第一章 物质及其变化第二节 离子反应第二课时教学设计及反思: 这是一份高中人教版 (2019)<a href="/hx/tb_c161973_t8/?tag_id=27" target="_blank">第一章 物质及其变化第二节 离子反应第二课时教学设计及反思</a>,文件包含核心素养人教版高中化学必修一《离子反应》第二课时课件pptx、核心素养人教版高中化学必修一《离子反应》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共10页, 欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应精品第一课时教案: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161973_t8/?tag_id=27" target="_blank">第二节 离子反应精品第一课时教案</a>,文件包含核心素养人教版高中化学必修一《离子反应》第一课时课件pptx、核心素养人教版高中化学必修一《离子反应》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。














