

所属成套资源:2024福州一中高三上学期期末考试及答案(九科)
- 2024福州一中高三上学期期末考试政治含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试地理含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试历史含答案 试卷 0 次下载
- 2024福州一中高三上学期期末考试生物含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试物理含解析 试卷 0 次下载
2024福州一中高三上学期期末考试化学含解析
展开
这是一份2024福州一中高三上学期期末考试化学含解析,共28页。试卷主要包含了5 Ti-48 Fe-56, 化学与生产、生活密切相关等内容,欢迎下载使用。
(完卷75分钟 满分100分)
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 S-32 Cl-35.5 Ti-48 Fe-56
第Ⅰ卷 选择题(共40分)
每题只有一个选项是正确的,每题4分,共40分,请将答案填涂在答题卷上。
1. 化学与生产、生活密切相关。下列过程中没有发生化学变化的是
A. 水滴石穿
B. 用沾有KMnO4的硅藻土做水果保鲜剂
C. 肥皂水作蚊虫叮咬处的清洗剂
D. NaCl固体加入蛋白质溶液中生成沉淀
2. 化学用语可以表达化学过程,下列化学用语的表达错误的是
A. 分子的VSEPR模型:
B. 中子数为10的氧原于:
C. 用电子云轮廓图表示的键形成的示意图:
D. 用电子式表示的形成:
3. 蛇烯醇(Serpentenynenynl)的结构如图所示,特别像一条蛇。下列关于蛇烯醇说法错误的是
A. 蛇烯醇可以使酸性高锰酸钾溶液褪色,说明其结构中含有碳碳双键或碳碳三键
B. 1ml该物质与足量溴水反应,最多可消耗6ml
C. 蛇烯醇中碳原子有sp、和三种杂化方式
D. 蛇烯醇可以进行催化氧化反应,得到醛类物质
4. 离子液体在合成与催化、电化学、功能助剂、溶剂、分离过程、分析测试、功能材料等领域广泛应用,一种由短周期主族元素构成的典型离子液体阴离子结构如图所示,其中Y、X、Q、W是原子序数依次增大的同一周期元素。下列说法正确的是
A. 该阴离子中所有原子均达到8电子稳定结构
B. 该阴离子中X、Y两种原子的杂化方式相同
C. 氢化物的沸点:YY
5. 下列反应离子方程式不正确的是
A. 向饱和氯化钠溶液中依次通入足量NH3和CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH
B. 电解CuSO4溶液的总反应(石墨作阳极、铁作阴极):2Cu2++2H2O2Cu+4H++O2↑
C. FeO与稀硝酸的反应:3FeO+10H++NO=3Fe3++NO↑+5H2O
D. 硫酸氢钠溶液中滴加过量的氢氧化钡溶液:2H++SO+Ba2++2OH-=BaSO4↓+2H2O
6. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中所含数目为
B. 中杂化的碳原子数目为1
C. 标准状况下,中含有的电子数目为
D. 常温下,将投入足量浓硝酸中,反应转移电子数目为
7. 下列实验装置能达到实验目的的是
A. 图1制备乙炔气体B. 图2盐酸滴定氨水
C. 图3制备干燥氨气D. 图4配制氢氧化钠溶液
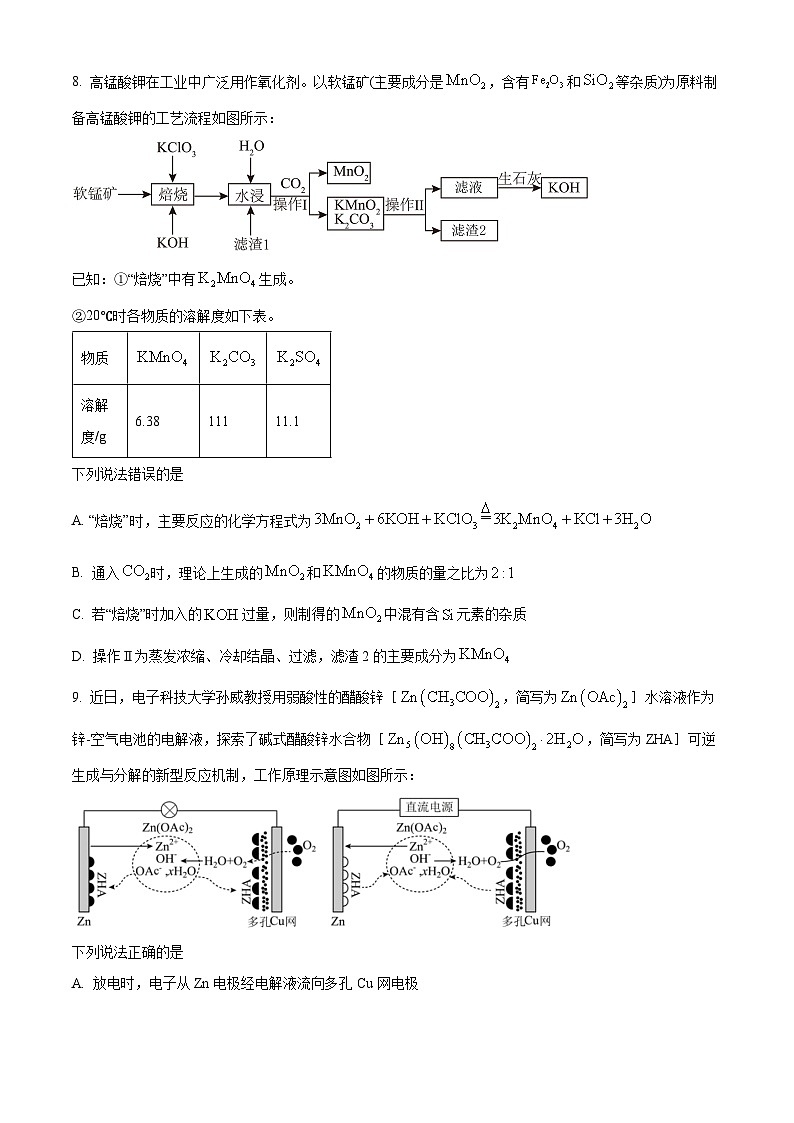
8. 高锰酸钾在工业中广泛用作氧化剂。以软锰矿(主要成分是,含有和等杂质)为原料制备高锰酸钾的工艺流程如图所示:
已知:①“焙烧”中有生成。
②20℃时各物质的溶解度如下表。
下列说法错误的是
A. “焙烧”时,主要反应的化学方程式为
B. 通入时,理论上生成的和的物质的量之比为
C. 若“焙烧”时加入的过量,则制得的中混有含元素的杂质
D. 操作Ⅱ为蒸发浓缩、冷却结晶、过滤,滤渣2的主要成分为
9. 近日,电子科技大学孙威教授用弱酸性的醋酸锌[,简写为]水溶液作为锌-空气电池的电解液,探索了碱式醋酸锌水合物[,简写为ZHA]可逆生成与分解的新型反应机制,工作原理示意图如图所示:
下列说法正确的是
A. 放电时,电子从Zn电极经电解液流向多孔Cu网电极
B. 充电时,多孔Cu网电极的电极反应式为
C. 放电时的电池总反应为
D. 与多孔Cu网电极相比,放电时,Zn电极电势低,充电时,Zn电极电势高
10. 某研究小组利用电位滴定法研究盐酸滴定亚磷酸钠()溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法正确的是
[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极j电位也发生了突跃,进而确定滴定终点。②亚磷酸()是二元弱酸,其电离常数分别是,]
A. a点对应溶液的溶质为和NaCl,pH>7
B. 第二次电极电位突跃发生的离子反应为
C. 水的电离程度:
D. c点对应的溶液中一定存在:
第Ⅱ卷 非选择题(共60分)
11. 从铜电解液分离出的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。
已知:
i.含镍溶液中的主要离子有:、、、、、和
ii.部分物质的电离常数和溶度积常数如下表。回答下列问题:
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是___________。
(2)滤渣1中除CuS外,还含有和S。反应生成和S的离子方程式是:______。
(3)“氧化除杂”时,加入的目的___________。
(4)用沉淀溶解平衡原理解释用能够“氟化除杂”的原因___________。
(5)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。
①将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是___________(填标号)。
A. B. C. D.
②如图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将转化为的是___________(填标号)。理由是___________。
③如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为,则B的原子坐标为___________。
12. 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
已知:HCl与不发生反应;装置C中除生成外,同时还生成一种有毒气态氧化物和少量其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为___________,装置B中所盛试剂为___________,装置A中发生反应的离子方程式为___________(反应后Mn元素以形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:___________→___________→b→___________→___________→d。__________
(3)下列说法不正确的是___________。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使变质
E.该装置有缺陷,通过装置E后气体不可直接排放到空气中
(4)可制备纳米:以为载体,用和水蒸气反应生成。再控制温度生成纳米。测定产物组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到,再用足量铝将还原为,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用的标准溶液滴定,将氧化为,三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是___________。
②通过分析、计算,该样品的组成为___________。
13. 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(g)=2H2(g)+O2(g)
一种新的循环利用方案是用Bsch反应CO2(g)+2H2(g)C(s)+2H2O(g) ΔHO>C即X>Q>Y,D错误;
故选B。
5. 下列反应的离子方程式不正确的是
A. 向饱和氯化钠溶液中依次通入足量NH3和CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH
B. 电解CuSO4溶液的总反应(石墨作阳极、铁作阴极):2Cu2++2H2O2Cu+4H++O2↑
C. FeO与稀硝酸的反应:3FeO+10H++NO=3Fe3++NO↑+5H2O
D. 硫酸氢钠溶液中滴加过量的氢氧化钡溶液:2H++SO+Ba2++2OH-=BaSO4↓+2H2O
【答案】D
【解析】
【详解】A.向饱和氯化钠溶液中依次通入足量NH3和CO2,发生反应生成NaHCO3晶体和氯化铵,反应的离子方程式为:Na++NH3+CO2+H2O=NaHCO3↓+NH,A正确;
B.电解CuSO4溶液,在阳极上水电离产生的氢氧根离子失去电子产生氧气,阴极上铜离子得电子生成单质铜,总反应(石墨作阳极、铁作阴极)为:2Cu2++2H2O2Cu+4H++O2↑,B正确;
C.FeO与稀硝酸发生氧化还原反应,产生硝酸铁、一氧化氮和水,离子方程式为:3FeO+10H++NO=3Fe3++NO↑+5H2O,C正确;
D.硫酸氢钠溶液中滴加过量的氢氧化钡溶液,离子方程式为:H++SO+Ba2++OH-=BaSO4↓+H2O,D错误;
答案选D。
6. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中所含数目为
B. 中杂化的碳原子数目为1
C. 标准状况下,中含有的电子数目为
D. 常温下,将投入足量浓硝酸中,反应转移电子数目为
【答案】B
【解析】
【详解】A.溶液中铜元素以四氨合铜离子存在,不存在单独的,A错误;
B.CH3CHO中甲基中碳原子采用sp3杂化,醛基上碳原子采用sp2杂化,(为1ml)中杂化的碳原子数目为1,B正确;
C.标准状况下HF为液体,故无法计算中含有的电子数目,C错误;
D.常温下Fe遇到浓硝酸将发生钝化,将投入足量浓硝酸中,无法计算反应转移电子数目,D错误;
故选B。
7. 下列实验装置能达到实验目的的是
A. 图1制备乙炔气体B. 图2盐酸滴定氨水
C. 图3制备干燥氨气D. 图4配制氢氧化钠溶液
【答案】B
【解析】
【详解】A.电石是粉末状的会从启普发生器中间的间隙中漏到食盐水中,启普发生器条件必须是块状固体,并且不溶于水, A不符合题意;
B.盐酸滴定氨水,生成,指示剂选择甲基橙,B符合题意;
C.要与氯化钙反应,因此不能用无水氯化钙干燥,C不符合题意;
D.溶解不能在容量瓶中进行,D不符合题意;
故选B。
8. 高锰酸钾在工业中广泛用作氧化剂。以软锰矿(主要成分是,含有和等杂质)为原料制备高锰酸钾的工艺流程如图所示:
已知:①“焙烧”中有生成。
②20℃时各物质的溶解度如下表。
下列说法错误是
A. “焙烧”时,主要反应的化学方程式为
B. 通入时,理论上生成的和的物质的量之比为
C. 若“焙烧”时加入的过量,则制得的中混有含元素的杂质
D. 操作Ⅱ为蒸发浓缩、冷却结晶、过滤,滤渣2的主要成分为
【答案】B
【解析】
【分析】软锰矿(主要成分是,含有和等杂质)与KClO3在强碱性条件下焙烧,反应生成氯化钾、锰酸钾和水,反应后的固体加水溶解,得到滤渣为氧化铁和二氧化硅,滤液含有锰酸钾,通入二氧化碳后,在酸性条件下,锰酸钾发生歧化反应得到二氧化锰固体和锰酸钾、碳酸钾,根据锰酸钾、碳酸钾的溶解度差别较大,可以采取蒸发浓缩、冷却结晶,过滤得到高锰酸钾固体和碳酸钾,碳酸钾加入生石灰后,得到氢氧化钾,据以上分析解答。
【详解】A.“焙烧”中有K2MnO4生成,该步骤主要反应的化学方程式为:,故A正确;
B.通入后,在酸性条件下,锰酸钾发生歧化反应得到二氧化锰固体和锰酸钾、碳酸钾,根据得失电子守恒和原子守恒配平化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,理论上生成和的物质的量之比为,故B错误;
C.若“焙烧”时加入的过量,SiO2也能和NaOH反应生成Na2SiO3,导致制得的中混有含元素的杂质,故C正确;
D.根据表格中的溶解度,KMnO4的溶解度远小于K2CO3,可用重结晶的方法将它们分离,操作的方法是蒸发浓缩、冷却结晶、过滤,故D正确;
故选B。
9. 近日,电子科技大学孙威教授用弱酸性的醋酸锌[,简写为]水溶液作为锌-空气电池的电解液,探索了碱式醋酸锌水合物[,简写为ZHA]可逆生成与分解的新型反应机制,工作原理示意图如图所示:
下列说法正确的是
A. 放电时,电子从Zn电极经电解液流向多孔Cu网电极
B. 充电时,多孔Cu网电极的电极反应式为
C. 放电时的电池总反应为
D. 与多孔Cu网电极相比,放电时,Zn电极电势低,充电时,Zn电极电势高
【答案】C
【解析】
【分析】原电池锌作为负极,铜作为正极,电子从导线流向铜棒,电解池中锌作为阴极得电子,铜作为阳极失去电子。
【详解】A.放电时,电子从Zn电极经导线流向多孔Cu网电极,故A错误;
B.充电时,多孔Cu网电极的电极反应式为,故B错误;
C.放电时的电池总反应为,故C正确;
D.与多孔Cu网电极相比,放电时,Zn电极是负极电势低,充电时,Zn电极电势低,故D错误;
故选:C。
10. 某研究小组利用电位滴定法研究盐酸滴定亚磷酸钠()溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法正确的是
[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极j电位也发生了突跃,进而确定滴定终点。②亚磷酸()是二元弱酸,其电离常数分别是,]
A. a点对应溶液的溶质为和NaCl,pH>7
B. 第二次电极电位突跃发生的离子反应为
C. 水的电离程度:
D. c点对应的溶液中一定存在:
【答案】D
【解析】
【详解】A.分析可知,a点为第一次电极电位突跃,恰好完成第一步反应,对应溶质为、NaCl,的电离平衡常数,水解平衡常数,的电离程度大于水解程度,即pHv逆=k逆c(CH4)c2(H2O),即k正c(CO2)c4(H2)>k逆c(CH4)c2(H2O),所以>;
④反应为放热反应,升高温度,平衡逆向移动,v正< v逆,k正增大的倍数
相关试卷
这是一份福建省福州第一中学2023-2024学年高三上学期期末考试化学试卷(Word版附解析),共28页。试卷主要包含了5 Ti-48 Fe-56, 化学与生产、生活密切相关等内容,欢迎下载使用。
这是一份2024苏州高三上学期期末考试化学含解析,共29页。试卷主要包含了可能用到的相对原子质量, 含锂物质在能源方面有重要应用, 硫及其化合物的转化形态丰富等内容,欢迎下载使用。
这是一份福建省福州第一中学2023-2024学年高三上学期期末考试化学试题(无答案),共9页。试卷主要包含了5 Ti-48 Fe-56,化学与生产、生活密切相关,蛇烯醇的结构如图所示,下列实验装置能达到实验目的的是,高锰酸钾在工业中广泛用作氧化剂等内容,欢迎下载使用。









