





第26讲 氨和铵盐-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开1.掌握NH3及铵盐的性质与用途。2.掌握喷泉实验、NH3的实验室制法的原理及操作。
考点二 铵盐、NH4+的检验
一. 氨的分子结构和性质
1.无色 、有刺激性气味的气体
2.极易溶于水(1:700)
4.极易液化(-33. 5 ℃)
一般用水或稀硫酸处理尾气
Cl2(沸点-34. 6 ℃)
SO2(沸点-10 ℃)
【液氨汽化时要吸收大量热,致使周围温度下降,寒气逼人】
虽然氨气并不能称为有毒气体,但由于氨气溶解度大且极易挥发,所以常被吸附在皮肤黏膜、眼黏膜上,产生刺激和炎症,吸入氨气,会刺激人的鼻喉等黏膜,接触过多会出现病状。故液氨大量泄漏时,必须采取防范措施。
例如:向地势低、逆风方向跑离事故区,及时吸入新鲜空气与水,并用大量水冲洗眼睛
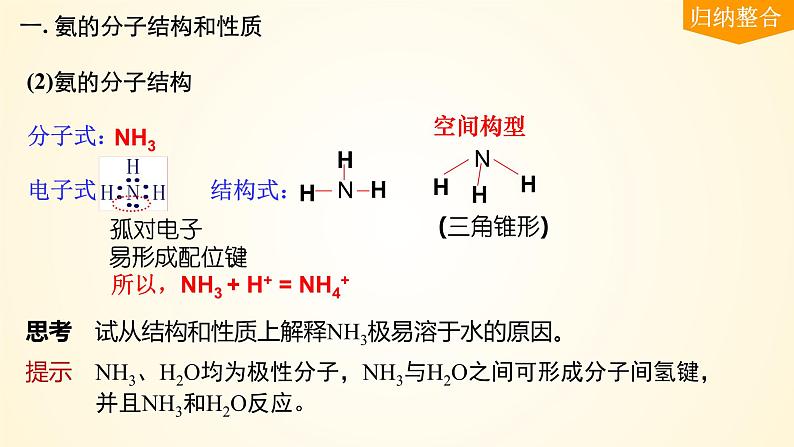
分子式:电子式: 结构式:
所以,NH3 + H+ = NH4+
思考 试从结构和性质上解释NH3极易溶于水的原因。
提示 NH3、H2O均为极性分子,NH3与H2O之间可形成分子间氢键,
并且NH3和H2O反应。
问题:氨水中存在哪些分子、哪些离子?
分子:NH3、H2O、NH3·H2O(主要)
离子:NH4+、OH-
§一水合氨不稳定,浓度较大或受热易分解:
氨气溶于水时,大部分与水结合成“NH3·H2O”
NH3是碱性气体,氨水是碱性溶液,NH3·H2O才是弱碱
NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。
1. NH3·H2O是弱电解质, NH3是非电解质
2.计算氨水浓度时,溶质指最初溶解的NH3的量
3.a ml/L的氨水中的守恒关系:
c(NH3)+c(NH3·H2O)+c(NH4+)= a ml/L
c(H+)+ c(NH4+)= c(OH-)
4.氨水溶液的特点:浓度越大,密度越小,且密度小于1g/cm3
5.氨水易分解,保存时应密封于阴凉处
另外, 氨水对许多金属有腐蚀作用, 故一般盛装在玻璃容器或橡胶袋或陶瓷坛或内涂沥青的铁桶里
6.利用氨气极易溶于水,可做喷泉实验。
NH3 + HCl = NH4Cl
问题:浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?
常用硫酸作为氨气的吸收剂
NH3 + HNO3 =
NH3 + H2SO4 =
不能用浓硫酸干燥NH3
2 (NH4)2SO4
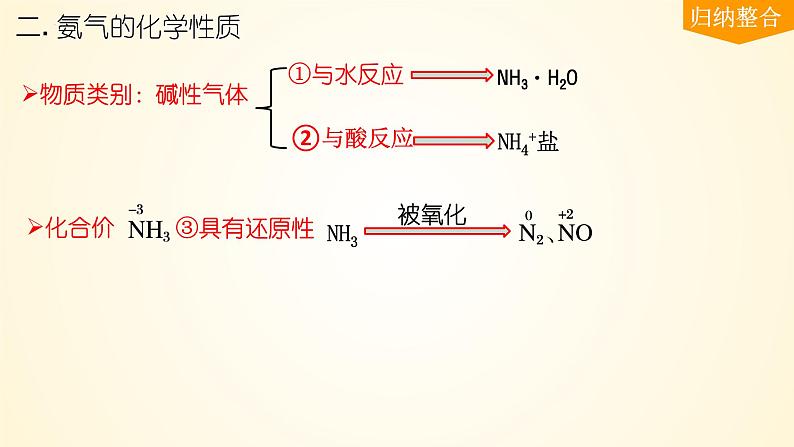
2. 氨气与酸的反应:
HCl、HNO3、H2SO4 、HBr、HI、CH3COOH等
[工业制硝酸的第一步]
3. 氨气的弱还原性:
(可与O2、Cl2、NO、NO2、CuO等氧化剂反应)
(反应条件不同,产物也不一样)
能。但若将NH3在纯O2中燃烧, 则产物为N2
问题: 你认为NH3能否像很多可燃物一样在O2中燃烧呢?
总:8NH3 + 3Cl2 = N2 + 6NH4Cl
应用:用浓氨水检查输送氯气的管道是否漏气
2NH3+3Cl2 = N2+6HCl
6HCl + 6NH3 = 6NH4Cl
(可与O2、NO、NO2、Cl2、CuO等氧化剂反应)
4)氨气与CuO反应:
提醒:NH3具有弱还原性,但遇到浓硫酸、硝酸都不发生氧化还原反应,而是生成对应的铵盐
3)氨气与NO、NO2反应:
2NH3 + CO2
CO(NH2) 2 + H2O
湿润的红色石蕊试纸蘸有浓盐酸的玻璃棒靠近试管口
3.吸收氨气(尾气处理):
(与O2、NO、NO2、Cl2、CuO等反应)
1.下列反应中能表示氨既有还原性又有碱性的是( ) A.NH3 + HNO3 = NH4NO3 B. NH3·H2O ≒ NH4++OH- C.8NH3 + 3Cl2 = N2+ 6NH4Cl D.4NH3 + 5O2 = 4NO + 6H2O
(1)试分析可能发生的有关反应?白烟的成分是什么?还可能看到哪些现象?
2.如右图所示把一根红热的铂丝伸进盛有浓氨水的试剂瓶中,反应一段时间,可观察到锥形瓶口上方有白烟。
铂丝持续红热瓶口有红棕色气体产生
(2)上述实验一段时间后,现象不明显,可向锥形瓶中加入下列哪种物质使现象明显?
A.NaOH固体 B.CaO固体 C.浓硫酸 D.NH4Cl固体
3NO2 + H2O =2HNO3 +NO
2NO + O2 = 2NO2
氨水浓度下降,要催进氨水分解出NH3
烧杯内的水由玻璃管进入烧瓶内形成红色的喷泉
氨极易溶于水、且水溶液显碱性 。
②烧瓶里为什么会形成喷泉?
引发喷泉的操作是什么?
③烧瓶中的溶液为什么变成红色?
氨极易溶于水,烧瓶内外产生压强差
氨气溶于水并与水反应,溶液显碱性。
打开止水夹,轻轻挤压胶头滴管,使少量的水进入烧瓶。
喷泉停止后,为什么烧瓶不能被水完全充满?
由于氨气是用向下排空气法收集的,一定含有少量空气。
如图2的装置,请说明引发喷泉的方法和原理。
方法一:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
方法二:打开止水夹,用冷毛巾等将烧瓶捂冷,氨气受冷收缩,将玻璃导管内的空气吸入烧瓶,氨气与水接触,即发生喷泉。
1.如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b可能是: A. a为HCl气体,b为H2O B. a为CO2气体,b为浓NaOH溶液 C. a为Cl2气体,b为饱和NaCl溶液 D. a为Cl2气体,b为浓NaOH
气体易被溶液或水吸收,烧瓶内外能形成足够的压强差,即可形成喷泉。
2.指出下面几种常见的能形成喷泉的气体的吸收剂。
另外,SO2和氯水、CH2=CH2与溴水等组合也可形成喷泉。
若上述实验在标况下完成,烧瓶的容积为VL,喷泉实验后溶液充满整个烧瓶,所得溶液中溶质的物质的量浓度为多少?
若喷泉实验后溶液只充满整个烧瓶的一半,所得溶液中溶质的物质的量浓度为多少?
= 0.045 ml/L
注意:氨水中溶质是NH3,不是NH3·H2O
0.045 ml/L
将标况下,一支充满HCl(g)的试管倒置于水槽中,瓶内液面上升,假设溶质不扩散,则最终溶质的物质的量浓度为 ml/L
若试管中HCl、空气各占一半呢?
若试管中NH3占3/4、空气占1/4呢?
若试管中充满NO2气体呢?
若试管中V(NO2):V(O2)=4:1呢?
若试管中V(NO):V(O2)=4:3呢?
→关键是确定所得溶液中溶质的物质的量和溶液的体积
总结归纳:喷泉实验产物的浓度计算
(1)HCl、NH3、NO2气体或它们与其他不溶于水的气体混合时,所得溶液的物质的量浓度为 ml·L-1。
(2)当是V(NO2):V(O2)=4:1的混合气体时,c(HNO3)= ml·L-1。
(3)当是V(NO):V(O2)=4:3的混合气体时,c(HNO3)= ml·L-1。
标准状况下的气体进行喷泉实验后所得溶液的物质的量浓度:
喷泉实验的发散装置及操作方法
打开止水夹,向锥形瓶通入少量空气,将少量水压入烧瓶,导致大量氨溶解,形成喷泉。
用手(或热毛巾等)捂热烧瓶,氨受热膨胀,赶出玻璃导管内的空气,氨与水接触,即发生喷泉
(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶中,瓶内氨溶于水)。
在水槽中加入能使水温升高的物质(例如 ),致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
向导管中通入一定量的H2S和SO2
有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。
先有白烟产生,后产生喷泉。
打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后,关闭该止水夹,等充分反应后,再打开②处的止水夹
挤压胶头滴管,然后打开导管上部的两个活塞
在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是_________________________________。
→利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
先打开a、b活塞,再挤压胶头滴管
(或先挤压胶头滴管,再打开a、b活塞)
(2)若先打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是 。
烧瓶Ⅱ中导管口处产生白烟
(3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是 。若要在该装置中产生双喷泉现象,其操作方法是 。
先打开a、c活塞,再挤压胶头滴管,片刻后,关闭a活塞,然后打开b活塞
先打开a、c活塞,再挤压胶头滴管,片刻后,打开b活塞
电子式: 结构式:
NH3 + H+ = NH4+
NH4+和酸根离子构成的化合物
铵盐是不含金属元素的离子化合物,
含离子键、极性键、配位键
含正四面体构型的物质:
原子晶体:金刚石、晶体硅、SiO2、SiC
原子团:NH4+、SO42—
且铵盐溶于水时,一般都吸热,使溶液温度下降
NH3↑+ H2O ↑+ CO2↑
注意:1.不是可逆反应
{“三解”:水解、碱解、受热分解}
2)铵盐分解不一定都产生氨气
说明: 1)硝铵是炸药
1. NH4NO3 、(NH4)2SO4受热分解产物复杂
2.中学化学里,受热易分解的盐,一般为铵盐或碳酸氢盐或碳酸盐(除Na2CO3、K2CO3) 。
NaNO3 +H2O +NH3↑
Na2SO4 + 2H2O + 2NH3↑
NH4++ OH-= NH3·H2O
⒈ 固体反应不写离子方程式。
→应用:实验室用来制取NH3;用于NH4+ 的检验
写出下列反应离子方程式
NH4HCO3 + NaOH(少量)—
NH4HCO3 + NaOH(足量)—
NH4HSO3 + Ba(OH)2(少量)—
NH4HSO3 + Ba(OH)2(足量)—
[NH4+水解呈酸性]
铵盐的水溶液一定呈酸性( )
CH3COONH4溶液呈中性
1.请写出NH4+在D2O中水解的离子方程式
NH4+ + D2O = NH3·HDO + D+
2.写出NH4+分别与AlO2—、SiO32—发生双水解反应离子方程式
湿润的红色石蕊试纸靠近试管口
问题:如何检验一包白色晶体是铵盐?
或蘸有浓盐酸的玻璃棒靠近试管口
(1)加热固态铵盐和碱的混合物
碱性干燥剂(碱石灰、CaO、NaOH)
2NH4Cl + Ca(OH)2
CaCl2 + 2H2O + 2NH3↑
实验室制备氨气的几个问题
1. 原料:NH4Cl可以换成NH4NO3 ?
NH4NO3受热发生爆炸
NaOH碱性太强,高温时易与SiO2反应,腐蚀试管
2.干燥氨气为什么不可以用中性干燥剂无水CaCl2?
CaCl2 + 8NH3 = CaCl2·8NH3 (络合反应)
3.收集装置中试管口棉花的作用是什么?
强碱吸湿性强,易结块,不利于NH3逸出
1)实验时,防止NH3与空气对流
2)实验结束,在棉花上滴少量水或稀硫酸,吸收多余NH3,防止污染空气
Ca(OH)2可以换用NaOH吗?
②浓氨水滴入NaOH固体、CaO或碱石灰
2)溶解放热, 溶液升温
(2)实验室制取氨的其他方法
知识回顾人工固氮技术---合成氨
实验表明:常温常压下,把N2、H2置于密闭容器中,经过三年才生成极少量的氨.
N≡N键能很大,分子结构稳定,性质不活泼
( 946KJ/ml )
为什么在常温常压下N2和H2的反应很缓慢?
分析:①合成氨反应是体积缩小的气体反应,增大压强既可以增大反应速率,又能提高平衡混合物中氨的含量,所以理论上压强越大越好。
一、合成氨的适宜条件的选择
②但是压强越大,对设备的要求高、压缩H2和N2所需要的动力也大。
综合以上两点,实际生产中压强一般选择在10~30MPa之间。
压强的选择----成本与效益的博弈
①因为正反应方向是放热的反应,所以降低温度有利于提高平衡混合物中氨的含量。
②可是温度越低,反应速率越小,达到平衡所需要的时间越长
③催化剂要在一定温度下效果最好。
综合以上因素,实际生产中温度一般选择在400~500℃左右
判断:选择400~500℃作为合成氨的温度可用勒夏特烈原理解释
温度的选择----快与少、慢与多的权衡
使用催化剂能否提高合成氨的转化率?使用催化剂对反应速率有何影响?
实际生产中选用铁为主体的多成分催化剂(铁触媒),它在500℃时活性较高。
∴ 要使用合适的催化剂
能加快反应速率,提高生产效率
判断:选择铁触媒作为合成氨的催化剂可用勒夏特烈原理解释
4、浓度怎么定?H2和N2的比例怎么定?
因此,可以用保持一定的N2、H2浓度,减少NH3的浓度的方法,提高合成氨的效率和产量。
实际生产中的处理方法:
增大反应物的浓度可以增大反应速率,促进平衡正向移动
减小生成物的浓度可以使平衡正向移动
及时将气态氨冷却液化而分离出去;
及时补充氮气和氢气并循环利用,使其保持一定的浓度。
[n(N2)∶n(H2)=1∶2.8]
归纳总结:工业合成氨的最佳条件
使用过量的N2或及时分离平衡混合气中的氨。
400-500℃左右 (温度低,有利于增大平衡混合气中的含量,但反应速率太慢。 500℃,催化剂活性最大)
铁触媒 (能加快化学反应速率,对平衡无影响)
10~30MPa(压强过高,对设备材质和生产条件提出了更高的要求)
值得说明的是:在上述条件下,合成氨的产率仍然不高。
二、合成氨的基本生产过程
合成氨的生产主要包括三个步骤:
使原料气进行反应合成氨
原料气的制取—净化—压缩—合成—分离—液氨
N2主要来源于____;氢气主要来源于 。
[N2的沸点低先汽化]
C3H8 + 3H2O = 3CO + 7H2
3)由天然气或石油气等制取氢气
1)制取原料气的过程中常混有的气体杂质有 。
原料气净化的原因是有些杂质可使催化剂“中毒”。
①用稀氨水吸收H2S杂质:NH3·H2O+H2S = NH4HS+H2O。
②使CO变成CO2:_________________
CO+H2O = CO2+H2
③除去CO2(用K2CO3吸收):_______________________。
K2CO3+CO2+H2O = 2KHCO3
从合成塔出来的混合气体,氨气占总体积的____,要把混合气体通过冷凝器、_______,再导入液氨贮灌。剩余气体再送回合成塔,循环利用(合成氨转化率较低,要采用循环操作)。
1.关于氨的合成工业的下列说法正确的是 ( )A. 从合成塔出来的气体,其中氨一般占15%,所以生产氨的工业的效率都很低B. 由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高C. 合成氨工业的反应温度控制在500℃左右,目的是使平衡向正反应方向进行D. 合成氨工业采用10-30MPa ,是因该条件下催化剂的活性最好
2、有平衡体系CO (g) + 2H2 (g) CH3OH (g) △H<0 , 为了增加CH3OH的产量,应该采取的措施是 ( )。
A、高温、高压 B、适宜的温度、高压、催化剂 C、低温、低压 D、高温、高压、催化剂
第29讲 常见气体的实验室制备、净化和收集-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第29讲 常见气体的实验室制备、净化和收集-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共35页。PPT课件主要包含了复习目标,热点强化12,化学装置图的正误判断等内容,欢迎下载使用。
第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共55页。PPT课件主要包含了氧族元素,易得2e-,专项突破,归纳整合,CS2,氧化性,还原性,漂白性,迁移应用,思考与交流等内容,欢迎下载使用。
第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,生活小知识等内容,欢迎下载使用。












