






所属成套资源:【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
第39讲 反应热的测定与计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开
这是一份第39讲 反应热的测定与计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共43页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合,一中和热,放热反应,mol纯物质,友情提示,反应热大小的比较等内容,欢迎下载使用。
1.了解中和反应反应热测定的原理及操作。2.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。
考点一 中和反应反应热的测定
考点二 盖斯定律及其应用
考点三 反应热大小的比较
考点一 中和反应反应热的测定
稀溶液中,酸与碱反应生成1ml液态H2O(l)时释放的热量.
⑤若反应过程中有其他物质生成(沉淀、难电离物质等),这部分反应热不属于中和热。{如硫酸与氢氧化钡的反应}
③特别地,强酸、强碱的稀溶液:H+(aq)+OH-(aq)=H2O(l)
①必须是稀溶液,如浓硫酸稀释或NaOH固体溶解时放热;
②以生成1ml H2O(l)为标准
一般地,酸、碱浓度:C(H+)≤ 1ml/L或C(OH—)≤ 1ml/L
△H = -57.3 kJ/ml
④中和热不包括物质溶解、电离、水合等过程的热效应
→已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·ml-1,又知电解质的电离是吸热过程。向1 L 0.5 ml·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( ) A. ΔH1>ΔH2>ΔH3 B. ΔH1ΔH3>ΔH2
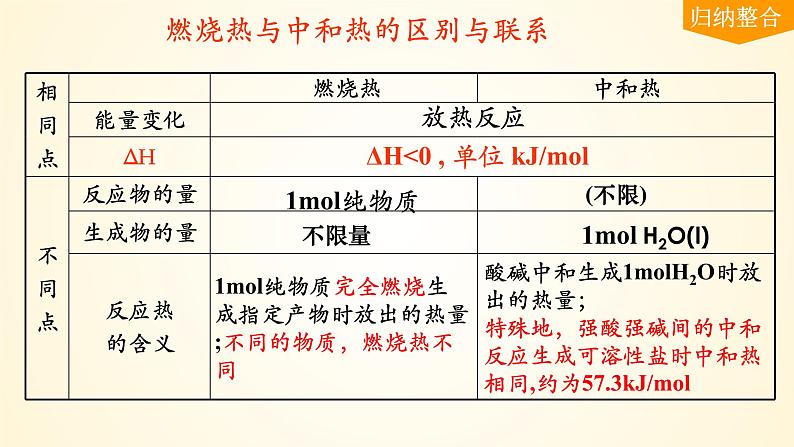
燃烧热与中和热的区别与联系
ΔHΔH2>ΔH1
对于反应a、b,ΔHa>0、ΔHb>0。
反应a=反应②-反应③,ΔHa=ΔH2-ΔH3>0
反应b=反应③-2×反应①,故ΔHb=ΔH3-2ΔH1>0
1.(2020·北京,12)依据图示关系,下列说法不正确的是A.石墨燃烧是放热反应B.1 ml C(石墨,s)和1 ml CO分别在足量O2中燃烧,全部转化为CO2,前者放热多C.C(石墨,s)+CO2(g)=2CO(g) ΔH=ΔH1-ΔH2D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
2.(2022·浙江1月选考,18)相关有机物分别与氢气发生加成反应生成1 ml环己烷( )的能量变化如图所示:下列推理不正确的是A.2ΔH1≈ΔH2,说明碳碳双键加氢放出 的热量与分子内碳碳双键数目成正比B.ΔH2









