

2024年高考化学二轮专项复习专题突破练六元素及其化合物(B)(Word版附解析)
展开1.(2021江苏苏锡常镇调研一)氧化物在生产、生活中有广泛应用。下列氧化物的性质与用途具有对应关系的是( )
A.Al2O3有两性,可用于制造耐高温陶瓷
B.ClO2有氧化性,可用于自来水消毒
C.SiO2硬度大,可用于制备光导纤维
D.SO2有还原性,可用于漂白有色织物
2.(2021福建泉州质量监测三)实验室以磷石膏[主要成分为CaSO4,含少量SiO2、Ca3(PO4)2等杂质]为原料制备轻质CaCO3,流程如下图。下列说法错误的是( )
CO2 NH4Cl溶液
↓ ↓
磷石膏粉
氨水→转化→过滤→高温
煅烧→浸取……→轻质
CaCO3
↓
滤液
A.“转化”中,包含反应CaSO4+CO32-SO42-+CaCO3
B.“滤液”的pH约为6.5,阴离子主要是SO42-和CO32-
C.“高温煅烧”需要的仪器有酒精喷灯、坩埚、坩埚钳、泥三角、三脚架等
D.“浸取”时,适当升高温度有利于Ca2+的浸出
3.(2021广东广州一模)探究是培养创新精神和实践能力的手段。用如下装置探究氯气的性质,图中三支试管口均放置浸有NaOH溶液的棉花。下列对实验现象的分析错误的是( )
A.①中碘化钾淀粉试纸变蓝,说明氯气的氧化性强于碘
B.②中产生白色沉淀,说明氯气与水反应生成Cl-
C.③中的溶液变为棕黄色,说明氯气有氧化性
D.④溶液先变红后褪色,说明氯水有酸性和漂白性
4.(2021广东六校第三次联考)如图是某元素的价类二维图。其中A为酸式盐,E的相对分子质量比D大16。下列说法正确的是( )
A.E与水反应一定能生成一种强酸
B.若x为强酸,则物质D可使石蕊溶液先变红后褪色
C.若x为强酸,则D→E的反应可用于检验D
D.若x为强碱,则物质A~E中均含有硫元素
5.(双选)(2021山东青岛模拟)废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是( )
A.反应Ⅰ的离子方程式为Cu+H2O2+2NH3+2NH4+[Cu(NH3)4]2++2H2O
B.操作②用到的主要仪器为蒸馏烧瓶
C.操作④以石墨为电极电解硫酸铜溶液,阳极产物为O2和H2SO4
D.操作⑤为蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
二、非选择题
6.(2021北京平谷一模)燃煤烟气中含有较多的SO2,减少排放和有效吸收是治理大气污染的一项重要措施。
(1)向燃煤中加入生石灰,可以有效减少SO2的排放,燃烧后的煤渣中主要含硫元素的成分为 (化学式)。
(2)利用工业废碱液(主要成分为Na2CO3)吸收烟气中的SO2并可获得无水Na2CO3。
含CO2的尾气
↑
含SO2的烟气→废碱液吸收塔→NaHSO3→…→Na2SO4
①吸收塔中发生反应的离子方程式为 ,酸性:H2SO3 (填“<”或“>”)H2CO3。
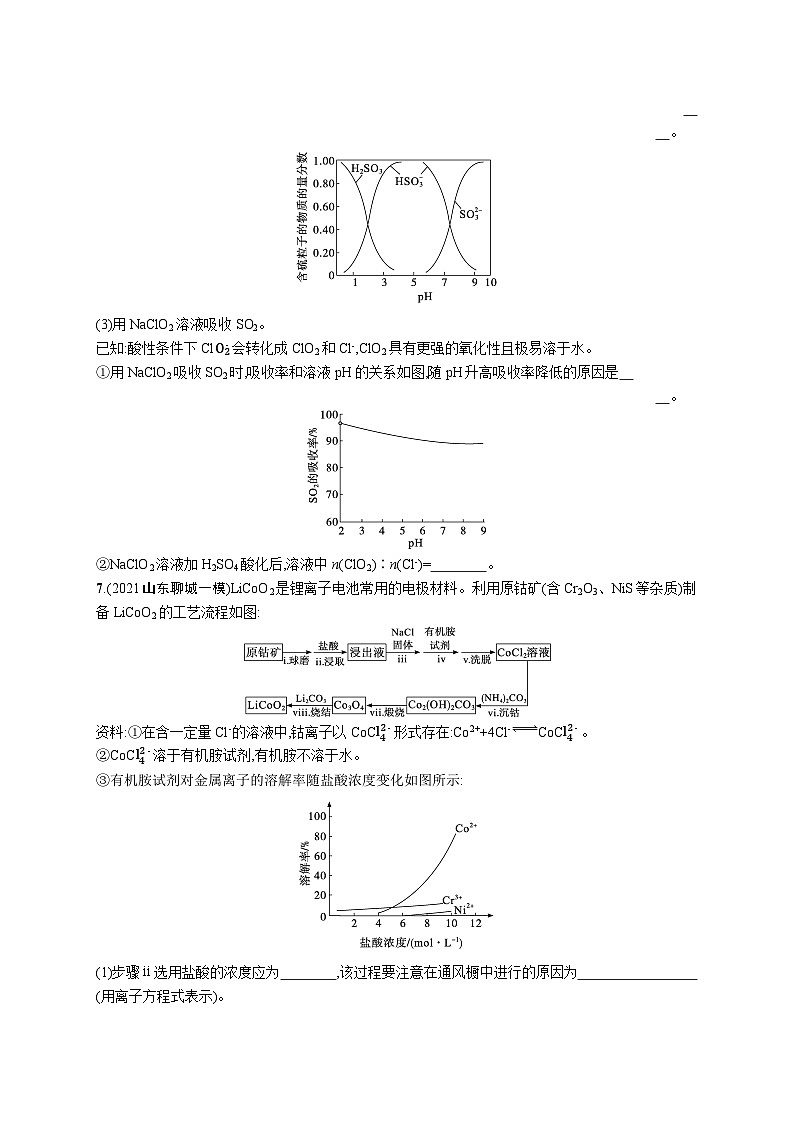
②向H2SO3溶液中滴加NaOH溶液,测得溶液中含硫粒子的物质的量分数随pH变化如图。由此可知NaHSO3溶液呈 (填“酸性”或“碱性”),结合化学用语解释原因:
。
(3)用NaClO2溶液吸收SO2。
已知:酸性条件下ClO2-会转化成ClO2和Cl-,ClO2具有更强的氧化性且极易溶于水。
①用NaClO2吸收SO2时,吸收率和溶液pH的关系如图,随pH升高吸收率降低的原因是
。
②NaClO2溶液加H2SO4酸化后,溶液中n(ClO2)∶n(Cl-)= 。
7.(2021山东聊城一模)LiCO2是锂离子电池常用的电极材料。利用原钴矿(含Cr2O3、NiS等杂质)制备LiCO2的工艺流程如图:
资料:①在含一定量Cl-的溶液中,钴离子以CCl42-形式存在:C2++4Cl-CCl42-。
②CCl42-溶于有机胺试剂,有机胺不溶于水。
③有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
(1)步骤ⅱ选用盐酸的浓度应为 ,该过程要注意在通风橱中进行的原因为 (用离子方程式表示)。
a.4 ml·L-1
b.6 ml·L-1
c.10 ml·L-1
(2)从平衡移动角度解释步骤中加入NaCl固体的目的是
。
(3)步骤ⅳ的操作是 。
(4)步骤ⅵ用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钴[C2(OH)2CO3]。已知碱式碳酸钴在339 ℃以上开始分解,实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示。分析曲线下降的原因是
。
(5)步骤ⅷ中C3O4和Li2CO3混合后,鼓入空气,经高温烧结得到LiCO2。该反应的化学方程式是
。
(6)多次实验测定该原钴矿中钴元素的质量分数为1.18%,则原钴矿中C2O3的质量分数为 %。(假设原钴矿中含钴元素的物质只有C2O3)
8.(2021 河北联考一)柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]用途广泛,如用于补血药、改进一些抗癌药物的性能等。为同时实现环境保护和资源的回收利用,以工业废料铁泥(主要成分是Fe2O3,还含有Fe、FeO、SiO2)为原料制备柠檬酸铁铵,工艺流程如下:
回答下列问题。
(1)预处理的目的是除去铁泥中的油污,最合适的X溶液为 。
a.碳酸钠溶液
b.氢氧化钠溶液
c.稀盐酸
d.酸性高锰酸钾溶液
(2)酸溶过程中要适度升温至85 ℃的目的是 ,采用的合适加热方式是 。
(3)氧化过程中发生反应的离子方程式为 。
(4)已知Fe(OH)3的Ksp=1×10-38.6,加氨水沉淀Fe3+得到Fe(OH)3,为减少损失,需将Fe3+完全沉淀(粒子浓度不大于10-5 ml·L-1),则溶液中pH不低于 。
(5)成盐过程中加入柠檬酸与氨水反应的化学方程式为 ;
经蒸发浓缩、冷却结晶、过滤、干燥等操作得到纯净的柠檬酸铁铵,过滤后用乙醇洗涤2~3次,洗涤时使用乙醇的目的是 。
参考答案
专题突破练六 元素及其化合物(B)
1.B 解析 Al2O3熔点高,可用于制造耐高温陶瓷,A项错误。ClO2有氧化性,能杀菌消毒,可用于自来水消毒,B项正确。SiO2能传导光信号,可用于制备光导纤维,C项错误。SO2具有漂白性,可用于漂白有色织物,且该漂白性与氧化还原反应无关,D项错误。
2.B 解析 “转化”时,通入二氧化碳,生成碳酸根离子,将硫酸钙转化为碳酸钙,A项正确。pH约为6.5,呈酸性,碳酸根不可能大量存在,B项错误。“高温煅烧”需要的仪器有酒精喷灯、坩埚、坩埚钳、泥三角、三脚架等,C项正确。碳酸钙的溶解度随着温度的升高而降低,所以适当升高温度有利于Ca2+的浸出,D项正确。
3.B 解析 湿润的碘化钾淀粉试纸变为蓝色,说明生成I2,可证明氯气的氧化性强于碘,A项正确。②中产生白色沉淀,有可能是挥发的氯化氢与AgNO3溶液反应生成氯化银沉淀,B项错误。氯化亚铁与氯气反应生成氯化铁,氯的化合价从0价降为-1价,说明氯气有氧化性,C项正确。溶液先变红后褪色,说明氯水有酸性和漂白性,D项正确。
4.A 解析 D和E均为氧化物,E中元素的价态比D中元素的高,E 的相对分子质量比 D 大 16,可以推测出E分子中比D分子中多一个O,则y为氧气,B到E为连续氧化过程,则B可以为NH3,C为N2,D为NO,E为NO2,此时A为某种酸式铵盐,x为强碱;B还可以是H2S,C为S,D为SO2,E为SO3,此时A为某种硫氢化物,x为非氧化性强酸。E为NO2或SO3,NO2与水反应可以生成HNO3,SO3与水反应生成H2SO4,硝酸和硫酸均为强酸,A项正确。根据分析可知若x为强酸,则A为硫氢化物,D为SO2,SO2并不能漂白石蕊溶液,所以只会变红,不会褪色,B项错误。根据分析可知若x为强酸,则D为SO2,E为SO3,SO2与氧气在高温、高压、催化剂的条件下生成SO3,该反应并不能用来检验SO2,C项错误。根据分析可知若x为强碱,物质A~E中均含有N元素,D项错误。
5.AC 解析 过氧化氢溶液具有氧化性,能氧化还原性物质Cu,反应的离子方程式为Cu+H2O2+2NH3+2NH4+[Cu(NH3)4]2++2H2O,A项正确。操作②为萃取、分液,主要仪器为分液漏斗,B项错误。以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,所以阳极上生成O2,同时有大量的H+生成,且SO42-也向阳极移动,因此阳极产物还有H2SO4,C项正确。从溶液中获取晶体采用加热浓缩、冷却结晶,且用冷水洗涤、过滤方法,D项错误。
6.答案 (1)CaSO4
(2)①2SO2+CO32-+H2O2HSO3-+CO2 > ②酸性 因为HSO3-在水溶液中存在HSO3-+H2OH2SO3+OH-和HSO3-SO32-+H+两个过程,HSO3-的电离程度大于水解程度,所以显酸性
(3)①pH越低溶液中的ClO2越多,氧化性越强,SO2更易被吸收,吸收率越高 ②4∶1
解析 (1)向燃煤中加入生石灰,可与SO2、氧气反应,生成CaSO4,即燃烧后的煤渣中主要含硫元素的成分为CaSO4。
(2)①用工业废碱液(主要成分为Na2CO3)吸收烟气中的SO2,生成亚硫酸氢钠和二氧化碳,则离子方程式为2SO2+CO32-+H2O2HSO3-+CO2;该反应的原理为强酸制弱酸,则酸性:H2SO3>H2CO3。
②由图可知NaHSO3溶液呈酸性,原因是HSO3-在水溶液中存在HSO3-+H2OH2SO3+OH-和HSO3-SO32-+H+两个过程,HSO3-的电离程度大于水解程度,所以显酸性。
(3)①由已知条件可知,pH越低溶液中的ClO2越多,氧化性越强,SO2更易被吸收,吸收率越高,所以随pH升高吸收率降低。
②NaClO2溶液加H2SO4酸化后,溶液中会生成ClO2和Cl-,反应的离子方程式为5ClO2-+4H+4ClO2+Cl-+2H2O,则n(ClO2)∶n(Cl-)=4∶1。
7.答案 (1)c NiS+2H+Ni2++H2S↑
(2)加入NaCl固体,溶液中Cl-浓度增大,平衡C2++4Cl-CCl42-右移,CCl42-浓度增大,提高其在有机胺试剂中的浓度
(3)分液
(4)温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少
(5)4C3O4+6Li2CO3+O212LiCO2+6CO2
(6)1.66
解析 (1)步骤ⅱ选用盐酸的浓度应为10 ml·L-1,可用于分离C与Cr、Ni;由于原料中含有的NiS与盐酸反应生成H2S,H2S有毒,故应在通风橱中进行,反应的离子方程式为NiS+2H+Ni2++H2S↑。
(2)步骤ⅲ中加入NaCl固体,可使溶液中Cl-浓度增大,平衡C2++4Cl-CCl42-右移,CCl42-浓度增大,提高其在有机胺试剂中的浓度。
(3)步骤ⅳ加入有机溶剂,用于萃取,可用分液的方法分离。
(4)由图像可知,随温度升高,所得沉淀质量曲线呈下降趋势,原因为温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少。
(5)C3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCO2,反应的化学方程式为4C3O4+6Li2CO3+O212LiCO2+6CO2。
(6)原钴矿中钴元素的质量分数为1.18%,则原钴矿中C2O3的质量分数为1.18%×59×2+3×1659×2=1.66%。
8.答案 (1)a
(2)加快反应速率,提高酸溶效率 水浴加热
(3)2Fe2++H2O2+2H+2Fe3++2H2O
(4)2.8
(5)Fe(OH)3+3NH3·H2O+2C6H8O7
(NH4)3Fe(C6H5O7)2+6H2O 减少溶解损耗,便于干燥
解析 (1)预处理的目的是除去铁泥中的油污,能除油污的有碳酸钠溶液和NaOH溶液,但NaOH溶液可与SiO2反应。
(2)适当升温的目的是加快反应速率,提高酸溶效率;为控制温度精确为85 ℃,应采取水浴加热。
(3)氧化目的是将Fe2+氧化为Fe3+,则反应的离子方程式为2Fe2++H2O2+2H+2Fe3++2H2O。
(4)Fe3+完全沉淀,则c(Fe3+)=10-5 ml·L-1时,c(OH-)=3Kspc(Fe3+)=310-38.610-5 ml·L-1=10-11.2 ml·L-1,则c(H+)=KWc(OH-)=10-1410-11.2 ml·L-1=10-2.8 ml·L-1,pH=2.8。
(5)成盐过程中加入柠檬酸和氨水生成柠檬酸铁铵的反应的化学方程式为Fe(OH)3+3NH3·H2O+2C6H8O7(NH4)3Fe(C6H5O7)2+6H2O,使用乙醇洗涤的目的是减少溶解损耗,便于干燥。
2024年高考化学二轮专项复习专题突破练八化学反应的热效应(B)(Word版附解析): 这是一份2024年高考化学二轮专项复习专题突破练八化学反应的热效应(B)(Word版附解析),共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024年高考化学二轮专项复习专题突破练十一化学实验(A)(Word版附解析): 这是一份2024年高考化学二轮专项复习专题突破练十一化学实验(A)(Word版附解析),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2023二轮复习专项练习(化学)专题突破练六 元素及其化合物(A): 这是一份2023二轮复习专项练习(化学)专题突破练六 元素及其化合物(A),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












