



2025版高考化学一轮复习真题精练第十一章化学实验第41练制备型化学实验课件
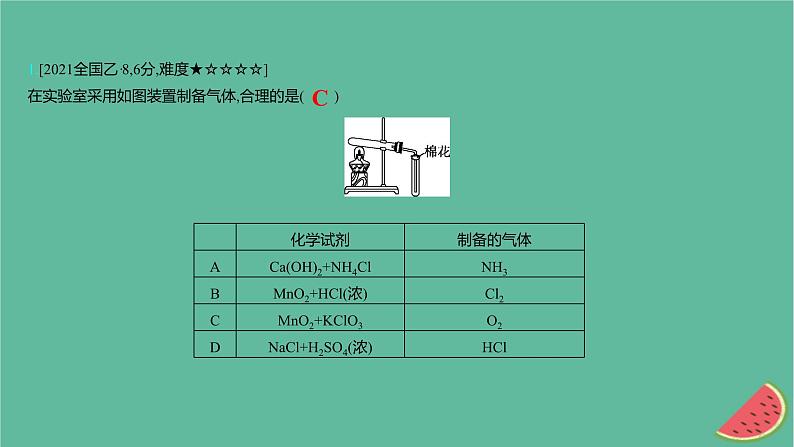
展开1.[2021全国乙·8,6分,难度★☆☆☆☆]在实验室采用如图装置制备气体,合理的是( )
【解析】 NH3应使用向下排空气法收集,A项错误;图示装置不能用于固液反应制气体,B、D项错误;KClO3在MnO2催化下加热可生成O2,O2的密度比空气的大,可用向上排空气法收集,C项正确。
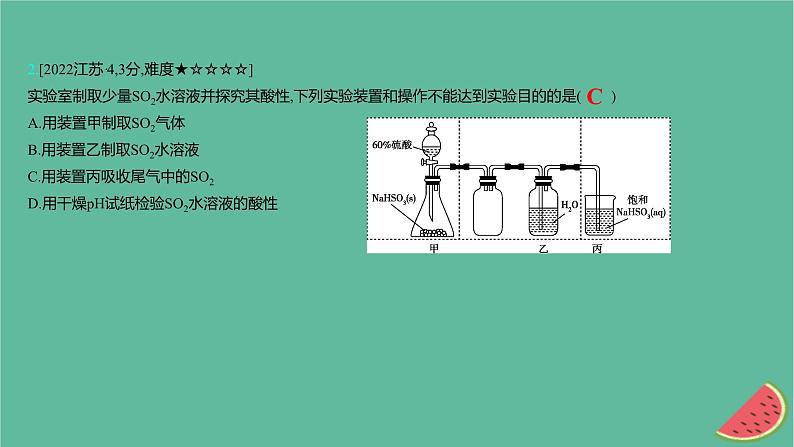
2.[2022江苏·4,3分,难度★☆☆☆☆]实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是( )A.用装置甲制取SO2气体B.用装置乙制取SO2水溶液C.用装置丙吸收尾气中的SO2D.用干燥pH试纸检验SO2水溶液的酸性
【解析】 A项,60%硫酸与NaHSO3反应可制得SO2气体,正确;B项,SO2通入水中形成SO2的水溶液,正确;C项,SO2在饱和NaHSO3溶液中的溶解度很小,错误;D项,测定溶液的酸碱性时,用玻璃棒蘸取待测液点到干燥的pH试纸上,观察试纸颜色的变化,正确。
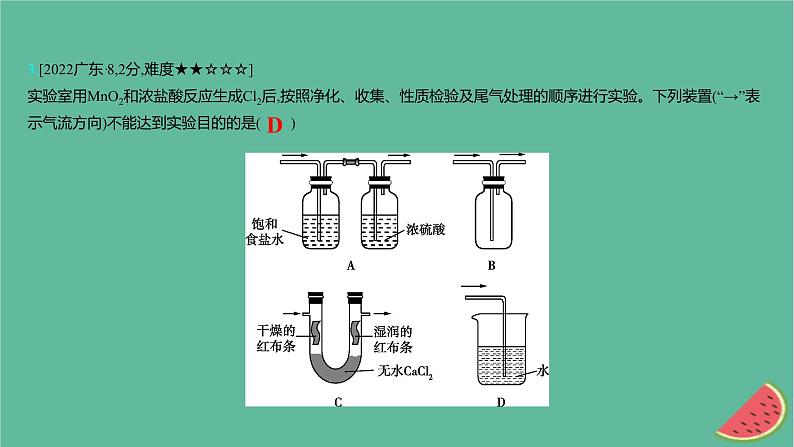
3.[2022广东·8,2分,难度★★☆☆☆]实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
【解析】 A项,除杂装置,先除去HCl,后除去水蒸气,正确;B项,集气装置,氯气密度比空气大,进气管长,出气管短,正确;C项,探究干燥的红布条和湿润的红布条与氯气的反应,正确;D项,尾气吸收应用碱液,错误。
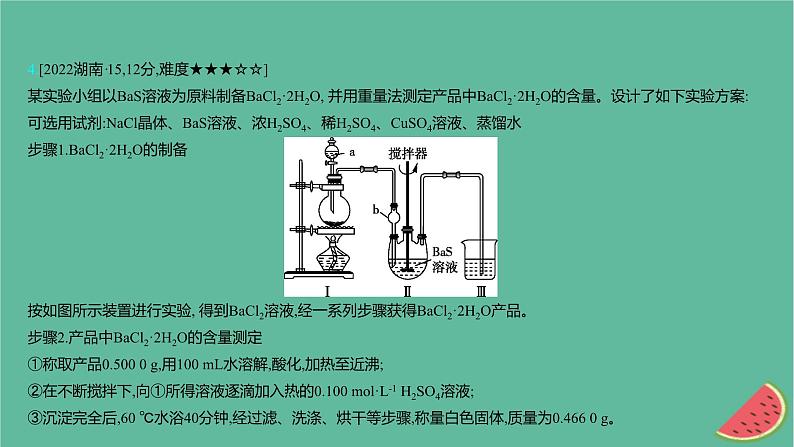
4.[2022湖南·15,12分,难度★★★☆☆]某实验小组以BaS溶液为原料制备BaCl2·2H2O, 并用重量法测定产品中BaCl2·2H2O的含量。设计了如下实验方案:可选用试剂:NaCl晶体、BaS溶液、浓H2SO4、稀H2SO4、CuSO4溶液、蒸馏水步骤1.BaCl2·2H2O的制备按如图所示装置进行实验, 得到BaCl2溶液,经一系列步骤获得BaCl2·2H2O产品。步骤2.产品中BaCl2·2H2O的含量测定①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的0.100 ml·L-1 H2SO4溶液;③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。
回答下列问题:(1)Ⅰ是制取 气体的装置,在试剂a过量并微热时,发生主要反应的化学方程式为 ; (2)Ⅱ中b仪器的作用是 ;Ⅲ中的试剂应选用 ; (3)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是 ; (4)沉淀过程中需加入过量的H2SO4溶液,原因是 ; (5)在过滤操作中,下列仪器不需要用到的是 (填名称); (6)产品中BaCl2·2H2O的质量分数为 (保留三位有效数字)。
【实验剖析】 由给出的试剂和装置,结合实验目的进行分析:
5.[2023新课标·28,14分,难度★★★☆☆]实验室由安息香制备二苯乙二酮的反应式如下:相关信息列表如下:装置示意图如图所示,实验步骤为:①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。③加入50 mL水,煮沸后冷却,有黄色固体析出。④过滤,并用冷水洗涤固体3次,得到粗品。⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。回答下列问题:(1)仪器A中应加入 (填“水”或“油”)作为热传导介质。 (2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。 (3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。 (4)在本实验中,FeCl3为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由 。 (5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止 。 (6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。 a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于 (填标号)。 a.85% b.80% c.75% d.70%
第41练 制备型化学实验
(2)已知电负性Cl>H>Si, SiHCl3在浓NaOH溶液中发生反应的化学方程式为 。 (3)采用如下方法测定溶有少量HCl的SiHCl3纯度。m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g,从下列仪器中选出①、②中需使用的仪器,依次为 (填标号)。测得样品纯度为 (用含m1、m2的代数式表示)。
2.[2022辽宁·18,14分,难度★★★☆☆]H2O2作为绿色氧化剂应用广泛,氢醌法制备H2O2原理及装置如下:已知:H2O、HX等杂质易使Ni催化剂中毒。回答下列问题:(1)A中反应的离子方程式为 。 (2)装置B应为 (填序号)。
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞 ,控温45 ℃。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞 ,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。 (4)装置F的作用为 。 (5)反应过程中,控温45 ℃的原因为 。 (6)氢醌法制备H2O2总反应的化学方程式为 。 (7)取2.50 g产品,加蒸馏水定容至100 mL,摇匀。取20.00 mL于锥形瓶中,用0.050 0 ml·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为 。
3.[2022重庆·16,15分,难度★★★☆☆]创新命题素材,本题以纳米球状红磷的制备为载体考查化学实验的相关知识研究小组以无水甲苯为溶剂,PCl5(易水解)和NaN3为反应物制备纳米球状红磷。该红磷可提高钠离子电池的性能。(1)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。①存贮时,Na应保存在 中。 ②冷凝水的进口是 (填“a”或“b”)。 ③用Na干燥甲苯的原理是 (用化学方程式表示)。 ④回流过程中,除水时打开的活塞是 ;体系变蓝后,改变开关状态收集甲苯。
(2)纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280 ℃加热12小时,反应物完全反应。其化学反应方程式为 。用Ar气赶走空气的目的是 。 ②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是 和 。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125 nm的红磷,气体产物的压强为 kPa,需NaN3的物质的量为 ml(保留3位小数)。已知:p=a×n,其中a=2.5×105 kPa·ml-1,n为气体产物的物质的量。
2025版高考化学一轮复习真题精练第十一章化学实验第42练定量型化学实验课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第42练定量型化学实验课件,共24页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第十一章化学实验第43练探究型化学实验课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第43练探究型化学实验课件,共20页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第十一章化学实验第39练化学实验基本操作课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第39练化学实验基本操作课件,共19页。PPT课件主要包含了新考法等内容,欢迎下载使用。












