





所属成套资源:【讲通练透】2024年高考化学一轮复习精品课件(全国通用)
第10讲 铁及其重要化合物(课件)-2024年高考化学一轮复习(新教材新高考)
展开
这是一份第10讲 铁及其重要化合物(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了内容索引,考情分析,网络构建,PARTONE,PARTON等内容,欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
第10讲 铁及其重要化合物
知识梳理
题型归纳
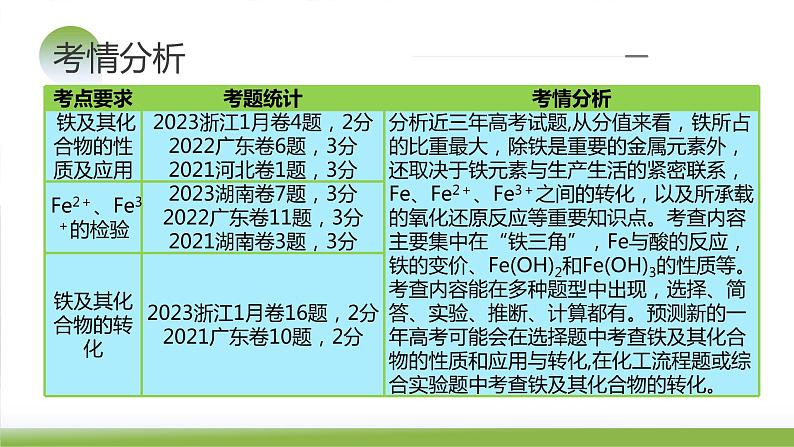
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
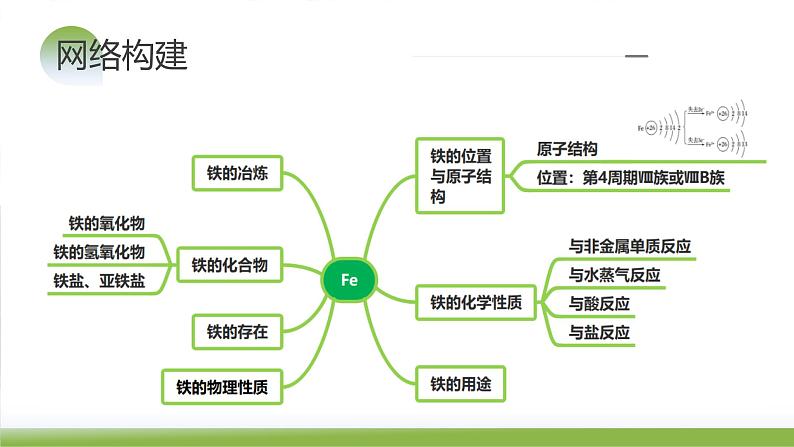
(1)存在:主要以化合态(陨石除外)的形式存在,在地壳中的含量居第四位,铁矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)、黄铁矿(FeS2)等。
(2)位置:铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应
常温:铁在潮湿的空气中被腐蚀生成铁锈,其主要成分为Fe2O3。
(4)与某些盐溶液反应
②与FeCl3溶液反应的离子方程式:2Fe3++Fe=3Fe2+。
①与CuSO4溶液反应的离子方程式:Fe+Cu2+=Fe2++Cu。
②Fe与Cl2反应无论用量多少都生成FeCl3,而Fe与盐酸反应生成FeCl2。
③铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
④铁与一般氧化剂(如S、HCl、FeCl3、CuSO4、I2等)反应时被氧化为Fe2+,铁与强氧化剂(如Cl2、Br2、HNO3、浓H2SO4等)反应时被氧化为Fe3+。
①在电化学中铁作负极时电极反应式为Fe-2e-=Fe2+。
(1)原料:铁矿石、焦炭、空气、石灰石。
知识点2 铁的重要化合物
1)铁的氧化物物理性质
2)铁的氧化物化学性质
①FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为
FeO+2H+= Fe2++H2O
Fe2O3+6H+= 2Fe3++3H2O
Fe3O4+8H+= 2Fe3++Fe2++4H2O
②Fe3O4分别与HNO3和HI反应的离子方程式为
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
Fe3O4+8H++2I-=3Fe2++I2+4H2O
③FeO与HNO3反应时,除考虑与H+的反应外,还要考虑Fe2+被HNO3氧化成Fe3+。
3FeO+6H++NO3-=3Fe3++NO↑+3H2O
④Fe2O3与HI反应时,除考虑与H+的反应外,还要考虑Fe3+被I-还原成Fe2+
Fe2O3+6H++2I-=2Fe2++I2+3H2O
⑤高温时,都能被C、CO、Al等还原剂还原,生成单质铁
1)Fe(OH)2是白色絮状物,易被空气中的氧气氧化生成Fe(OH)3,颜色由白色变为灰绿色,最后变为红褐色,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
3)二者之间的关系:在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
②Fe(OH)3与氢碘酸(HI)反应不是发生中和反应生成盐和水,而是发生氧化还原反应2Fe(OH)3+6HI=2FeI2+I2+6H2O。
①Fe(OH)2与硝酸反应不是发生中和反应生成盐和水,而是发生氧化还原反应3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O。
注意:空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,防止Fe(OH)2氧化的方法:
(1)可溶性亚铁盐与强碱或氨水反应:Fe2++2OH-=Fe(OH)2↓或Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+。
A.将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。
B.将盛有NaOH溶液的胶头滴管尖端插入盛有亚铁盐溶液的试管底部,并慢慢挤出NaOH溶液。
C.在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
D.在亚铁盐溶液上面加保护层,如苯、植物油等。
E.常见的制备Fe(OH)2的装置:
说明:①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③中液面加苯阻止了空气进入;④中阳极为铁,阴极为石墨,利用电解实验可以制得纯净的Fe(OH)2白色沉淀。
(2)可溶性铁盐与强碱或氨水反应:Fe3++3OH-=Fe(OH)3↓或Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
例1.(2023·江苏徐州·统考三模)下列有关铁及其化合物的性质与用途具有对应关系的是A.Fe2O3能与盐酸反应,可用于制作红色颜料B.FeCl3具有氧化性,可用于除去水中悬浮杂质C.铁粉具有还原性,可用于食品袋中的抗氧化剂D.FeS难溶于水,可用于除去废水中的Cu2+
考向1 考查铁及其重要化合物的性质与应用
【变式训练2】(2023·上海黄浦·统考二模)把铁条放入盛有过量稀硫酸的试管中,下列改变不能加快氢气产生速率的是A.改铁条为镁条 B.滴加少量CuSO4溶液C.改稀硫酸为98%的硫酸 D.升高溶液的温度
考向2 考查氢氧化亚铁的制备
回答下列问题:(1)仪器a的名称是_______,B中长玻璃管的作用是_______。(2)装置A中金属离子的检验方法是_______。(3)步骤 Ⅲ 装置B中的现象是_______,其发生反应的化学方程式为_______。
【答案】(1)恒压滴液漏斗 平衡气压,辅助排出装置B中的空气(2)取少量装置A烧瓶中的液体于洁净试管中,滴加几滴KSCN溶液,无红色出现,再滴加H2O2,溶液变为红色,则证明存在Fe2+(3)白色沉淀逐渐变为灰绿色,最后变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
考向3 考查铁及其化合物的有关计算
【变式训练2】(2022·浙江舟山·浙江省普陀中学校考模拟预测)取48.0gFe2O3,一定温度下加热,残留固体47.36g。将该剩余固体溶于足量盐酸,此过程没有气体产生;所得溶液中再加入足量KI溶液。请计算:(1)生成I2的物质的量_____。(2)若分解产物为Fe3O4,求Fe2O3的分解率_____。
【答案】(1)0.26ml (2)40%
1.Fe2+的氧化性和还原性
知识点1 亚铁盐的性质及应用
①含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如:遇Br2、Cl2、H2O2、NO3-(H+)等均表现为还原性。
②Fe2+的酸性溶液与H2O2反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O。
③向FeSO4溶液中滴加酸性KMnO4溶液,溶液褪色。反应的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O。
Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。
1.氧化性:含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S、SO32-等均表现为氧化性。
知识点2 铁盐的性质及应用
①Fe3+与S2-、I-、HS-、SO32-等具有较强还原性的离子不能大量共存。
②Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+。
Fe(OH)3是很弱的碱,且溶度积很小,因而Fe3+极易水解,只能存在于酸性较强的溶液中。
②利用Fe3+易水解的性质,工业上常用调节pH方法除去溶液中的铁离子。
③利用Fe3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。
④Fe3+与HCO3-、[Al(OH)4]-、CO32-、ClO-等水解呈碱性的离子不能大量共存。
含有Fe3+的盐溶液遇到KSCN时变成血红色,含有Fe3+的盐溶液遇到酚类物质时变成紫色。
知识点3 Fe2+和Fe3+的检验
3.混合溶液中Fe3+、Fe2+的检验
【易错提醒】检验Fe2+和Fe3+时的注意事项
(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入足量的新制氯水中(新制氯水能氧化SCN-),检验Fe2+最好用K3[Fe(CN)6]溶液。
(2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。
知识点4 “铁三角”的转化关系及其应用
①Fe2+与NO3-(H+)、ClO-、MnO4-(H+)发生氧化还原反应,不能大量共存;
②Fe3+与S2-、I-、SO32-发生氧化还原反应,不能大量共存;
③Fe2+、Fe3+与HCO3-、CO32-等水解相互促进生成沉淀,不能大量共存。
(3)盐溶液的配制与保存
(5)铁及其化合物的转化关系——铁的价类二维图
1)横向变化体现了同价态不同物质类别(氧化物、盐、碱)之间的转化:
①碱性氧化物(Fe2O3、FeO)都能溶于酸(H+)转化为盐;
②Fe2+、Fe3+与碱(OH-)反应生成对应的碱;
③难溶性的碱易分解生成对应的氧化物,但难溶性的碱性氧化物一般不与水反应生成对应的碱。
2)纵向变化体现不同价态同物质类别之间的转化,主要体现物质的氧化性或还原性。
3)斜向变化体现不同价态、不同物质类别之间的转化,主要体现物质的氧化性和还原性。
考向1 考查Fe2+、Fe3+ 的性质及其检验
考向2 考查“铁三角”的转化及应用
稿定PPT,海量素材持续更新,上千款模板选择总有一款适合你
考向3 实验探究铁及其重要化合物的转化关系
【变式训练】(2023·北京西城·统考二模)探究Cu与Fe(NO3)3溶液的反应,进行如下实验。实验①:向10mL0.2ml/LFe(NO3)3溶液(pH≈1)中加入0.1gCu粉,振荡后静置,取上层清液,滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生。6h后,溶液由棕黄色变为蓝绿色。实验过程中未见有气泡产生,溶液的pH几乎不变。实验②:在密闭容器中向10mL0.6ml/LHNO3溶液中加入0.1gCu粉,10h后溶液变为淡蓝色。实验③:在密闭容器中向10mL0.6ml/LHNO3溶液中分别加入0.1gCu粉和0.1gFeSO4固体,0.5h溶液变黄,3h溶液变为黄绿色。
1.(2023·浙江·高考真题)物质的性质决定用途,下列两者对应关系不正确的是A.SO2能使某些色素褪色,可用作漂白剂B.金属钠导热性好,可用作传热介质C.NaClO溶液呈碱性,可用作消毒剂D.Fe2O3呈红色,可用作颜料
2.(2023·上海·统考高考真题)下列物质中,能通过化学氧化法去除石油开采过程中伴生的的是A.氨水B.双氧水C.FeSO4溶液D.NaOH溶液
5.(2022·广东·高考真题)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是A.加入AgNO3溶液产生沉淀B.加入淀粉碘化钾溶液无蓝色出现C.加入KSCN溶液无红色出现D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
相关课件
这是一份第10讲 铁及其重要化合物(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第10讲铁及其重要化合物练习原卷版docx、第10讲铁及其重要化合物练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份第10讲 铁及其重要化合物(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
这是一份第10讲 铁及其重要化合物(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第10讲铁及其重要化合物讲义原卷版docx、第10讲铁及其重要化合物讲义解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。








