






所属成套资源:【讲通练透】2024年高考化学一轮复习精品课件(全国通用)
第15讲 碳、硅及无机非金属材料(课件)-2024年高考化学一轮复习(新教材新高考)
展开
这是一份第15讲 碳、硅及无机非金属材料(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了内容索引,考情分析,网络构建,PARTONE等内容,欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
第15讲 碳、硅及无机非金属材料
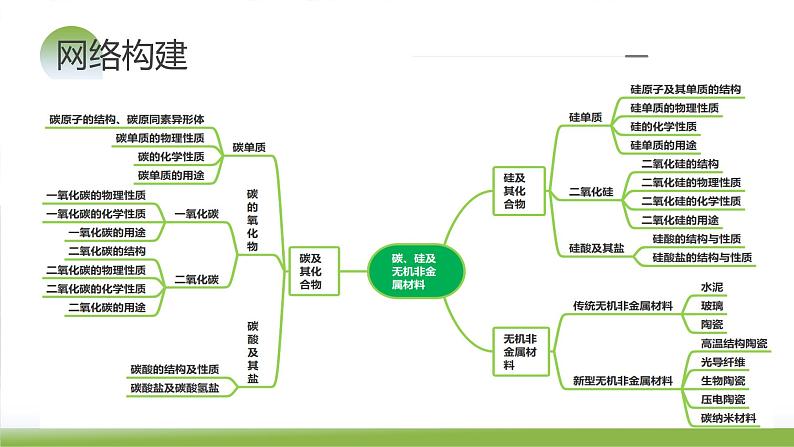
知识梳理
题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
2.常见碳单质的结构和物理性质
常见的碳单质有金刚石、石墨、无定形碳、足球烯、碳纳米管等,它们互为同素异形体。
a.与O2的反应(用化学方程式表示):
b.与氧化物反应(用化学方程式表示):
①金刚石结构坚硬,作玻璃刻刀、机器钻头、装饰品等;②石墨的细鳞片状结构质软、导电性、滑腻性、耐高温 铅笔芯、电极、润滑剂、坩埚;③木炭和活性炭的疏松多孔的结构吸附性吸附食品色素、除臭、防毒面具、冰箱除味剂等;④作燃料,用于家庭取暖、做饭等;⑤作还原剂:冶炼金属,如冶炼金属铜、铁等。
知识点2 碳的氧化物CO和CO2
1.碳的氧化物的物理性质
2.碳的氧化物的化学性质
②CO2是典型的酸性氧化物,也具有氧化性。
【特别提醒】溶液中通入CO2气体产生沉淀的问题:向BaCl2或CaCl2溶液中通入CO2气体,由于盐酸的酸性比碳酸的强,不会产生BaCO3或CaCO3沉淀。
3.CO、CO2气体的除杂方法
【易错提醒】①澄清石灰水只用于检验CO2,不能用于除去混合气体中的CO2,应用NaOH溶液除去;
②CO2、SO2通入CaCl2或BaCl2溶液均无沉淀产生。
知识点3 碳酸和碳酸盐
二元弱酸、不稳定,常用CO2+H2O代替H2CO3,但酸性比苯酚、次氯酸强。
2.碳酸的正盐和酸式盐的比较
知识点4 碳元素在自然界中的循环
1.CO2的主要来源:大量含碳燃料的燃烧。
2.自然界消耗CO2的主要反应:
b.光合作用将CO2转化为O2;
c.岩石的风化:CaCO3+H2O+CO2=Ca(HCO3)2。
知识点5 CO2与碱、盐溶液的反应规律
(2)反应后溶质成分的判断
碳酸是一种弱酸,其酸性比盐酸、醋酸要弱,因此,盐酸、醋酸能与碳酸盐反应;其酸性又比硅酸、次氯酸、苯酚、偏铝酸等强,因此,将CO2气体通入Na2SiO3、NaClO、C6H5ONa 、NaAlO2等盐溶液中,均能发生反应而生成相应的弱酸和碳酸(氢)盐,这就是“强酸制弱酸”原理的应用。如:
(1)CO2与盐溶液的常见反应
①CO2+Na2CO3+H2O=2NaHCO3
②CO2+Na2SiO3+2H2O=H4SiO4↓+Na2CO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3
当CO2过量时,发生反应如下:2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3
③CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO
当CO2过量时,发生反应如下:2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO
④CO2+C6H5ONa+H2O―→C6H5OH+NaHCO3
⑤CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3(CO2过量时)
CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3(CO2少量时)
①“强酸制弱酸”是一个重要的化学反应规律,但不可认为弱酸就不能“制取”强酸。在某些条件下,当弱酸的酸根阴离子被沉淀或被氧化后,H+就被“释放”出来,从而生成了强酸。如将H2S通入CuSO4溶液中或向氢硫酸中滴加氯水,均由氢硫酸这种弱酸生成了强酸:H2S+CuSO4=CuS↓+H2SO4(S2-与Cu2+结合成难溶的CuS),H2S+Cl2===S↓+2HCl(S2-被氧化)。
②CO2与C6H5ONa溶液反应的产物与CO2的用量无关,都生成NaHCO3,因为酸性H2CO3>C6H5OH>HCO3-。
③CO2与NaClO溶液反应的产物与CO2的量无关,也只能生成NaHCO3,不能生成Na2CO3,因为酸性H2CO3>HClO>HCO3-。但CO2与Ca(ClO)2溶液反应的产物与CO2的量有关,CO2的量不足时,CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO;CO2过量时,2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO;
④CO2、SO2通入CaCl2或BaCl2溶液均不反应,无沉淀产生。但SO2通入Ca(NO3)2或Ba(NO3)2溶液发生氧化还原反应,均有沉淀产生。
考向1 考查碳及及其化合物性质和应用
考向2 CO2与碱反应图像分析
考向3 考查碳元素在自然界中的循环的应用
【变式训练1】(2023秋·江苏盐城·高三校联考期末)我国提出争取在2030年前实现碳达峰,2060年实现碳中和。下列说法正确的是A.“碳达峰”和“碳中和”中的“碳”都是指碳元素B.光催化CO2和H2O合成甲醇是实现碳中和的有效手段C.在燃煤中加入生石灰是实现碳中和的重要途径D.利用火力发电产生的电能电解水制氢有利于实现碳中和
【变式训练2】(2023春·上海浦东新·高三上海市实验学校校考阶段练习)CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是A.光合作用 B.自然降雨C.化石燃料的燃烧D.碳酸盐的沉积
1.硅的存在、结构与物理性质
(1)存在:单质硅有晶体硅和无定形硅两大类,自然界中无游离态硅——单质硅,硅以化合态存在,主要以二氧化硅和硅酸盐的形式存在地壳中,含量仅次于氧,位列第二。
(2)单质硅结构:硅元素原子序数为14,基态原子的简化电子排布式为[Ne]3s23p2,核外电子的空间运动状态有8种,不成对电子数有2个;单晶硅为共价晶体,晶体中每个Si原子以sp3杂化,分别与4个相邻的Si 原子形成4个σ键,Si原子的配位数为4,晶体中最小的环是6元环,1个环中平均含有0.5 Si原子,含Si—Si键数为1。
(3)物理性质:灰黑色固体,有金属光泽,熔、沸点高,硬度大,有脆性,是常见的半导体材料和合金材料。金刚石、晶体硅、碳化硅中熔点从高到低的顺序是金刚石、碳化硅、晶体硅。
①与氢氟酸反应的化学方程式:Si+4HF=SiF4↑+2H2↑;
②与NaOH溶液反应的化学方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑;
③与F2反应的化学方程式:Si+2F2=SiF4
【特别提醒】①用焦炭还原SiO2,产物是CO而不是CO2。
②粗硅中含碳等杂质,与Cl2反应生成的SiCl4中含有CCl4等杂质,经过分馏提纯SiCl4后,再用H2还原,得到高纯度硅。
4.单质硅的用途:半导体材料、太阳能电池、计算机芯片和耐酸设备等。
3.物理性质:熔点高,硬度大,不溶于水
1.存在:硅石、石英、水晶、玛瑙、沙子等
2.二氧化硅的结构特点
①与碱反应:SiO2+2NaOH=Na2SiO3+H2O;
①水晶可用于电子工业的部件、光学仪器、工艺品
与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O
②SiO2是制光导纤维的重要原料
③较纯的石英用于制造石英玻璃
④石英砂用于制玻璃的原料及建筑材料
【特别提醒】(1)由于玻璃的成分中含有SiO2,故实验室盛放碱液的试剂瓶用橡皮塞而不用玻璃塞。(2)未进行磨砂处理的玻璃,在常温下是不易被强碱腐蚀的。
(3)因为氢氟酸腐蚀玻璃,与玻璃中的SiO2反应,所以氢氟酸不能用玻璃瓶保存,而应保存在塑料瓶或铅皿中。
(4)SiO2是H2SiO3的酸酐,但SiO2不与水反应,不能用SiO2直接与水作用制备H2SiO3。
1.物理性质:硅酸是一种白色胶状物质,不溶于水,能形成胶体。新制备的硅酸为透明、胶冻状,硅酸经干燥脱水形成硅酸干凝胶——“硅胶”。
a.弱酸性:硅酸的酸性很弱,比碳酸的酸性还弱,在与碱反应时只能与强碱反应。如:H2SiO3+2NaOH=Na2SiO3+2H2O。
由于SiO2不溶于水,所以硅酸是通过可溶性硅酸盐与其他酸反应制得的。
Na2SiO3+2HCl=H2SiO3↓+2NaCl,Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3(证明酸性:H2CO3>H2SiO3)。
4.用途:硅胶可作催化剂的载体和袋装食品、瓶装药品的干燥剂。
2.硅酸盐的氧化物表示方法——常用氧化物的形式表示:
1.概念:由硅、氧和金属组成的化合物的总称,是构成地壳岩石的主要成分。
氧化物的书写顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水,不同氧化物间以“·”隔开。如硅酸钠(Na2SiO3)可表示为Na2O·SiO2,长石(KAlSi3O8)可表示为K2O·Al2O3·6SiO2。
【特别提醒】(1)氧化物之间以“· ”隔开;
(2)计量数配置出现分数应化为整数。硅酸盐改写为氧化物形式时,各元素的化合价保持不变,且满足化合价代数和为零,各元素原子个数比符合原来的组成。当系数配置出现分数时一般应化为整数。如上例中KAlSi3O8,将(1/2)K2O·(1/2)Al2O3·3SiO2,要写成K2O·Al2O3·6SiO2。
①物理性质:白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
3.硅酸钠(Na2SiO3)——又称泡花碱
②化学性质——与酸性较硅酸强的酸反应:
a.与盐酸反应的化学方程式:Na2SiO3+2HCl=2NaCl+H2SiO3↓。
b.与CO2水溶液反应的化学方程式:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓。
③用途:黏合剂(矿物胶)、防腐剂和耐火阻燃材料。
【特别提醒】①Na2SiO3的水溶液是一种黏合剂,是制备硅胶和木材防火剂等的原料;Na2SiO3易与空气中的CO2、H2O反应,要密封保存。
②可溶性碳酸盐、硅酸盐的水溶液呈碱性,保存该溶液的试剂瓶不能用玻璃塞,应用橡胶塞。
知识点5 碳、硅及其化合物性质“反常”小结
1.一般情况下,非金属元素单质熔、沸点低,硬度小,但晶体硅、金刚石熔、沸点高,硬度大,其中金刚石为自然界中硬度最大的物质。
2.一般情况下,非金属单质为绝缘体,但硅为半导体,石墨为电的良导体。
4.非金属单质与碱反应一般既作氧化剂又作还原剂,且无氢气放出,但硅与强碱溶液反应只作还原剂,且放出氢气:Si+2NaOH+H2O=Na2SiO3+2H2↑。
5.非金属单质一般不与非氧化性酸反应,但硅能跟氢氟酸反应:Si+4HF=SiF4↑+2H2↑。
6.一般情况下,碱性氧化物+酸―→盐+水,二氧化硅是酸性氧化物,却能与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O(SiF4不属于盐,故SiO2不是两性氧化物)。
7.一般情况下,无机酸能溶于水,但硅酸却难溶于水。
10.一般情况下,酸性氧化物与水反应生成相应的含氧酸,但二氧化硅不溶于水,也不与水反应。
考向1 考查硅、二氧化硅的性质及其应用
【变式训练】(2022·全国·高三专题练习)硅是构成无机非金属材料的一种主要元素,下列有关硅及其化合物的叙述错误的是A.氮化硅陶瓷是一种高温结构陶瓷,其化学式为Si3N4B.高纯硅可以制成计算机、通信设备等的芯片C.硅可以用来生产新型无机非金属材料——光导纤维D.二氧化硅为立体网状结构,每个硅原子结合4个氧原子
考向2 考查硅的制备
考向3 考查硅酸、硅酸盐的性质及其应用
【变式训练1】(2023·黑龙江大庆·统考一模)北京故宫的屋顶有各种颜色的琉璃瓦,其坚实耐用,经历几百年的风雨洗礼仍能保存完整,下列说法错误的是A.琉璃瓦的主要成分是硅酸盐B.制作琉璃瓦的主要原料是黏土C.琉璃瓦坚实耐用取决于硅酸盐的结构D.黄色和绿色琉璃瓦中分别含有Fe2+、Cu2+
【变式训练2】(2023·全国·高三专题练习)下列关于硅单质及其化合物的说法正确的是 ①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料A.①②B.②③C.①④D.③④
1.含义:传统的无机非金属材料多为硅酸盐材料,如水泥、玻璃、陶瓷等硅酸盐材料。
知识点1 传统无机非金属材料
(1)陶瓷:陶瓷以黏土(主要成分为含水的铝硅酸盐)为主要原料,经高温烧结而成的。
(2)玻璃:普通玻璃的主要成分为Na2SiO3、CaSiO3和SiO2,它是以纯碱、石灰石和石英砂为主要原料,经混合、粉碎,在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得的,玻璃可用于生产建筑材料、光学仪器和各种器皿,还可制造玻璃纤维,用于高强度复合材料等。
(3)水泥:普通硅酸盐水泥的主要原料是黏土和石灰石,二者与其他辅料经混合、研磨后在水泥回转窑中煅烧,发生复杂的物理变化和化学变化,加入适量石膏调节水泥硬化速率,再研成细粉得到普通水泥。混凝土是水泥、沙子和碎石等与水混合得到的。
3.传统无机非金属材料比较
1.高纯度含硅元素的材料,如单晶硅、二氧化硅,具有特殊的光学和电学性能。
知识点2 新型无机非金属材料
(1)含义:新型陶瓷在组成上不再限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能。
(2)新型陶瓷的种类与用途
(1)含义:碳纳米材料是一类新型的无机非金属材料。
(2)类型:富勒烯、碳纳米管、石墨烯等。
(3)用途:在能源、信息、医药等领域有广阔的应用前景。
例1.(2023·全国·高三专题练习)下列关于无机非金属材料的说法不正确的是A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点D.传统无机非金属材料和新型无机非金属材料的主要成分不同
考向1 考查传统无机非金属材料的分类和应用
考向2 考查新型无机非金属材料的分类和应用
例2.(2023·辽宁葫芦岛·统考二模)近年来,我国科技迅猛发展,下列科技成果中蕴含的化学知识叙述不正确的是A.建造港珠澳大桥所采用的高强抗震螺纹钢属于合金B.中国天眼FAST用到的SiC是新型无机非金属材料C.华为麒麟芯片的主要成分是单质硅D.飞船返回舱使用氮化硅耐高温结构材料,Si3N4属于分子晶体
【变式训练】(2023·安徽芜湖·统考二模)化学与生活、科技、社会发展息息相关。下列说法正确的是A.“天宫”空间站使用聚乳酸材料餐具,聚乳酸是化合物B.富勒烯与石墨烯用途广泛,它们都属于新型无机非金属材料C.冬奥场馆建筑使用碲化镉发电玻璃,碲和镉均属于主族元素D.中国承建的卡塔尔首座光伏电站中的光伏材料为高纯度二氧化硅
1.(2023·山东·统考高考真题)下列之物具有典型的齐鲁文化特色,据其主要化学成分不能与其他三种归为一类的是A.泰山墨玉B.龙山黑陶C.齐国刀币D.淄博琉璃
2.(2023·浙江·高考真题)下列物质中属于耐高温酸性氧化物的是A.CO2B.SiO2C.MgOD.Na2O
4.(2023·浙江·统考高考真题)材料是人类赖以生存和发展的物质基础,下列材料主要成分属于有机物的是A.石墨烯 B.不锈钢C.石英光导纤维D.聚酯纤维
相关课件
这是一份第15讲 碳、硅及无机非金属材料(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
这是一份第15讲 碳、硅及无机非金属材料(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第15讲碳硅及无机非金属材料练习原卷版docx、第15讲碳硅及无机非金属材料练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份第15讲 碳、硅及无机非金属材料(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第15讲碳硅及无机非金属材料讲义原卷版docx、第15讲碳硅及无机非金属材料讲义解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。









