

最新高考化学考点一遍过(讲义) 考点09 电解质及电离方程式
展开2、扎实训练学科基本技能、理解感悟学科基本方法。
一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。
3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。
落实学生解题的三重境界:一是“解”,解决当前问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。
4、有计划、有步骤、有措施地指导学生补齐短板。
高三复习要突出重点,切忌主次不分,无的放矢,导致复习不深不透,浅尝辄止,蜻蜓点水,雾里看花。怎么办?就是要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
考点09 电解质及电离方程式
1.电解质和非电解质
过 关 秘 籍
(1)注意“或”与“和”的区别,电解质满足其一即可,而非电解质必须同时满足两个条件。如AlCl3、FeCl3在熔融状态下不导电,但在水溶液中可以电离导电,属于电解质。
(2)电解质和非电解质均为化合物,单质与混合物均不属于电解质。如金属虽然能导电但不是电解质。
(3)电解质在水溶液中或熔融状态下自身发生电离而导电;非电解质在水溶液中和熔融状态下自身都不能发生电离。电解质本身不一定导电,如固体氯化钠本身不导电但在水溶液中能导电,属于电解质。
(4)某些气态化合物属于非电解质,但其在水溶液中因反应生成电解质而导电。如CO2、SO2、NH3、N2O5是非电解质,但H2CO3、H2SO3、NH3·H2O、HNO3是电解质。
(5)大部分难溶盐虽然难溶于水,但是溶解的部分在水中能够完全电离,故属于强电解质。如AgCl、BaSO4、CaCO3、BaCO3等。
(6)电解质与金属的导电原理不同:电解质的导电是因为自由移动的阴、阳离子定向移动产生的;金属导电是由于金属晶体中自由电子的定向移动。
2.强电解质和弱电解质
3.电解质的电离
(1)电离的概念
电解质溶于水或受热熔化时,离解成自由移动的离子的过程称为电离。
注意:电解质溶于水时是由于水分子的作用而电离;熔融时是由于热能破坏化学键而电离成自由移动的离子,都不是因通电而电离的。
(2)电离方程式
①强电解质:完全电离,用“”。
如H2SO4:H2SO42H++;
NaOH:NaOHNa++OH−;
(NH4)2SO4:(NH4)2SO42+。
②弱电解质:
a.多元弱酸分步电离,且电离程度逐步减弱,酸性的强弱主要由第一步电离决定。多元弱碱分步电离,可一步写出。
如H2S:H2SH++HS− ,HS−H++S2− ;
Cu(OH)2:Cu(OH)2Cu2++2OH−。
b.两性氢氧化物双向电离。
如Al(OH)3:H+++H2OAl(OH)3Al3++3OH−。
酸式电离 碱式电离
③酸式盐的电离:
a.强酸酸式盐完全电离,一步到底。
如NaHSO4在水溶液中的电离方程式:NaHSO4Na++H++;NaHSO4在熔融状态下的电离方程式:NaHSO4Na++。
b.多元弱酸酸式盐,第一步完全电离,第二步酸式酸根离子部分电离。
如NaHCO3,第一步:NaHCO3Na++,第二步:H++。
考向一 电解质及其强弱的判断
1.电解质、非电解质的判断
(1)电解质和非电解质的前提是化合物,单质既不是电解质,也不是非电解质。
(2)常见的电解质有酸(H2SO4、HCl、CH3COOH等)、碱[强碱(NaOH、KOH等)、弱碱(NH3·H2O、氢氧化镁、氢氧化铜、氢氧化铁等)]、盐(NaCl、BaCO3等)、活泼金属的氧化物(Na2O、MgO、Al2O3等)。常见的非电解质有NH3、非金属元素形成的酸酐、有机化合物中的烃、醇、醛、酯等。
(3)可通过熔融导电实验证明物质是离子化合物还是共价化合物。离子化合物一定是电解质,而共价化合物可能是电解质(如AlCl3),也可能是非电解质(如SO2、NH3等)。
2.强电解质、弱电解质的判断
(1)电解质的强弱与物质内部结构有关,与外界因素无关。
(2)电解质的强弱与溶解性无关,如BaSO4、CaCO3等虽难溶于水却是强电解质;Pb(CH3COO)2尽管能溶于水,却部分电离,是弱电解质。
(3)电解质的强弱与溶液的导电性强弱没有必然联系,溶液导电能力强弱由溶液中自由移动的离子的浓度决定,也与离子所带电荷数有关,很稀的强电解质溶液导电性较弱,浓度较大的弱电解质溶液的导电性可能较强。因此,强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
典例1 下列说法正确的一组是
①不溶于水的盐都是弱电解质
②可溶于水的盐都是强电解质
③0.5 ml·L-1一元酸溶液中H+浓度为0.5 ml·L-1
④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤⑥ C.只有⑤ D.只有⑥
【解析】本题考查强电解质和弱电解质的概念。①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,如硫酸钡,错误;②电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,错误;③0.5 ml·L-1 一元酸溶液中H+浓度不一定为0.5 ml·L-1,如醋酸,错误;④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中可电离出H+的个数以及电离程度有关,与电解质的强弱无关,错误;⑥酸在熔融状态时均不导电,只有溶于水时才导电,错误。
【答案】C
【归纳反思】判断物质是是否电解质(或强、弱电解质)的解答思路
1.下列说法中,正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力一定强
C.NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、SOeq \\al(2-,4)
D.NH3属于非电解质,但其水溶液能够导电
题后拓展
金属导电与电解质溶液导电的原理比较
(1)金属导电是由于自由电子在电场作用下的定向移动,温度升高、金属阳离子振动幅度增大,自由电子定向移动阻力增大,金属导电性减弱。
(2)电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,和电解质的强弱没有必然联系,决定于溶液中自由移动离子的浓度和离子的电荷数。但温度升高时,弱电解质电离程度增大,离子浓度增大,导电性会增强。
考向二 电离方程式的书写
典例1 下列物质在指定条件下电离方程式书写正确的是
A.Na2CO3溶于水 Na2CO3+
B.Al(OH)3酸式电离 Al(OH)3H+++H2O
C.NaHS溶于水HS−的电离 HS−+H2OH2S+OH−
D.NaHSO4加热熔化 NaHSO4Na++
【解析】A项,应为Na2CO32Na++;B项,应用可逆号;C项,是HS−的水解方程式。
【答案】D
2.下列物质在水溶液中的电离方程式书写正确的是
A.CH3COOHH++CH3COO-
B.NaHSO4Na++H++ QUOTE
C.H3PO43H++ QUOTE
D.NaHCO3Na++H++ QUOTE
通关秘籍
(1)注意两符号:强电解质电离用“”表示全部电离,弱电解质电离用“”表示部分电离。
(2)遵循两守恒:原子守恒、电荷守恒。即在电离方程式两边原子的种类和数目相同。在电解质溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,电解质溶液呈电中性。
(3)注意分步:弱酸的一级电离常数与二级电离常数(或多级电离常数)之间一般相差约103或104倍,不能合并各级电离,要分步书写电离方程式。
1.下列叙述中正确的是
A.物质的溶解过程,实质上就是其电离过程
B.H2SO4溶于水能导电,液态H2SO4不导电,故H2SO4不是电解质
C.1 L 0.1 ml·L-1的H2SO4溶液中含有0.2 ml H+
D.1 L 0.1 ml·L-1的HClO溶液中含有0.1 ml H+
2.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
3.用如图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是
A.向亚硫酸钠溶液中通入氯气
B.向硝酸银溶液中通入少量氯化氢
C.向氢碘酸饱和溶液中通入少量氧气
D.向氢氧化钠溶液中通入少量氯气
4.下列有关FeCl3和氨水的理解正确的是
A.FeCl3和氨水均为电解质
B.氨水中NH3·H2O的电离方程式为NH3·H2 O===+OH-
C.向浓氨水中滴加FeCl3饱和溶液可制备Fe(OH)3胶体
D.氨水与FeCl3溶液发生反应的离子方程式为Fe3++3NH3·H2O===3+Fe(OH)3↓
5.某学习小组成员在讨论问题时各抒己见,下列是其中的四个观点,你认为正确的是
A.某单质固体能导电,则该单质一定是金属单质
B.某化合物的水溶液能导电,则该化合物一定是电解质
C.某化合物固态不导电,熔融态导电,则该化合物很可能是离子化合物
D.某纯净物常温下为气态,固态不导电,则构成该纯净物的微粒中一定有共价键
6.下列说法正确的一组是
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤⑥B.②④⑤C.只有④D.只有⑤
7.一种矿泉水标签上印有的主要矿物质成分及含量(单位为mg·L−1)为:Ca—48.00、K—39.00、Mg—3.10、Zn—0.08、F—0.02等,则对此矿泉水的叙述正确的是
A.该矿泉水不导电B.该矿泉水能导电
C.该矿泉水是电解质D.该矿泉水是非电解质
8.同一温度下,强电解质溶液a.弱电解质溶液 b.金属导体 c.三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是
A.b>a>c B.a=b=c
C.c>a>b D.b>c>a
9.下列说法正确的是
A.NaHCO3是强电解质,故NaHCO3的电离方程式为NaHCO3===Na++H++COeq \\al(2-,3)
B.室温下,0.1 ml/L的BOH溶液的pH=11,则BOH的电离方程式为BOHB++OH-
C.NaHSO4熔化电离方程式为NaHSO4===Na++H++SOeq \\al(2-,4)
D.CaCO3的饱和水溶液导电性很弱,故CaCO3的电离方程式为CaCO3Ca2++COeq \\al(2-,3)
10.现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________,既能跟盐酸反应又能跟NaOH溶液反应的是______________。(填序号)
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)_____________________。
(3)④与足量的NaOH浓溶液在加热条件下反应的离子方程式为_______________。
1.[2019北京] 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
2.[2018·北京]下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O
B. 常温时,0.1 ml·L-1氨水的pH=11.1:NH3·H2O QUOTE +OH−
C. 由Na和C1形成离子键的过程:
D. 电解精炼铜的阴极反应:Cu2+ +2e−Cu
3.[2015·上海]与氢硫酸反应有沉淀生成的电解质是
A.硫酸铜B.氢氧化钠 C.硫酸亚铁D.二氧化硫
变式拓展
1.【答案】D
【解析】三氧化硫本身不能电离出离子,SO3是非电解质,A错误;离子数目多的溶液中,离子浓度不一定大,离子所带电荷数不一定多,其导电能力不一定强,B错误;NaHSO4在熔融状态下只能电离出Na+、,C错误;NH3是非电解质,但其溶于水后可形成电解质NH3·H2O,溶液能导电,D正确。
2.【答案】B
【解析】本题主要考查电离方程式的正误判断。A.CH3COOH 是弱电解质,电离方程式要使用可逆符号,CH3COOHH++CH3COO-,故A错误。B.NaHSO4Na++H++ QUOTE ,故B正确。C. H3PO4是三元弱酸,其电离分步进行,H3PO4H++ QUOTE , QUOTE H++ QUOTE , QUOTE H++ QUOTE ,D.NaHCO3是强电解质,电离方程式要用等号,而且电离出的阴离子是碳酸氢根离子,NaHCO3Na++ QUOTE ,故D错误。
考点冲关
1.【答案】C
【解析】A项,物质溶解不一定电离,如C2H5OH溶解;B项,H2SO4为电解质;D项,HClO为弱电解质,不完全电离。
2.【答案】C
【解析】Fe既不是电解质也不是非电解质,A错误;NH3是非电解质,BaSO4是强电解质,B错误;CaCO3是盐,是强电解质,H3PO4是中强酸,是弱电解质,C2H5OH是非电解质,C正确;H2O是弱电解质,D错误。
3.【答案】C
【解析】C项,向氢碘酸中通入少量氧气,反应的离子方程式为4H++4I-+O2===2I2+2H2O,离子浓度明显减小,溶液导电性减弱,灯泡变暗。
4.【答案】D
【解析】氨水是混合物,不是电解质,A项错误。NH3·H2O为弱电解质,电离方程式中应该用可逆号,B项错误。氨水与氯化铁溶液反应生成Fe(OH)3沉淀,故C项错误,D项正确。
5.【答案】C
【解析】能导电的固体单质不一定是金属单质,如石墨,故A错误;某化合物的水溶液能导电,但该化合物不一定是电解质,也可能是非电解质,如二氧化硫的水溶液能导电,但电离出阴、阳离子的是亚硫酸而不是二氧化硫,所以二氧化硫是非电解质,故B错误;某化合物固态不导电,熔融态导电,该化合物可能是离子化合物,如硫酸钡,硫酸钡晶体中不含自由移动的离子,所以固体硫酸钡不导电,在熔融状态下,硫酸钡电离出阴、阳离子而导电,故C正确;某纯净物常温下为气态,固态不导电,则构成该纯净物的微粒中不一定含有共价键,如稀有气体是单原子分子,不含化学键,故D错误。
6.【答案】C
【解析】CaCO3、BaSO4虽难溶于水,但它们是电解质,故①错误;单质既不是电解质,也不是非电解质,故②错误;强酸与弱酸中氢离子浓度不能直接进行比较,故③错误;熔融的H2SO4不能导电,故⑤错误。
7.【答案】B
【解析】由题中信息知,该矿泉水不是纯净物,故该矿泉水既不是电解质也不是非电解质,C、D项错误;该矿泉水中存在钙离子、钾离子、镁离子等,因此可以导电,A项错误。
8.【答案】A
【解析】金属导体随温度升高导电能力减弱;强电解质不存在电离平衡,升高温度,溶液中的离子浓度不变,离子运动加快导电能力增强;弱电解质存在着电离平衡,升高温度,弱电解质的电离程度增大,溶液中的离子浓度增大,随温度的升高,弱电解质的导电能力增加。
9.【答案】B
【解析】A项,HCOeq \\al(-,3)在水中不全部电离,NaHCO3应分步电离,第一步为全部电离;B项,BOH为弱碱;C项,熔化时HSOeq \\al(-,4)不再电离;D项,CaCO3在水中完全电离用“===”连接。
10.【答案】(1)①②③④ ②④⑥
(2)+H2OH2CO3+OH-
(3)++2OH-+NH3↑+2H2O
【解析】(1)强电解质是指在水溶液中或熔融状态下能完全电离的化合物,根据其概念可判断答案为①②③④。
(2)NaHCO3属于强碱弱酸盐,其溶液水解导致溶液呈碱性,水解方程式为+H2OH2CO3+OH-。
(3)因NaOH的浓溶液是足量的,故OH-既能与反应,也能与反应。
直通高考
1.【答案】B
【解析】
【分析】本题A、B、C选项应区分电离和电解的概念。电离是电解质溶于水或熔融状态下,解离成能够自由移动的离子的过程。根据其电离程度可分为强电解质和弱电解质,几乎全部电离的是强电解质(如A选项),只有少部分电离的是弱电解质(如C选项);是将电能转化为化学能的一个装置(构成:外加电源,电解质溶液,阴阳电极)。使电流通过电解质溶液或熔融电解质而在阴,阳两极引起还原氧化反应的过程(如B选项)。
【详解】A.NaCl为强电解质,NaCl溶于水,NaCl在水分子作用下,自发解离为Na+和Cl-,故电离方程式为NaCl=Na++Cl-,故A不符合题意;
B.电解氯化铜溶液,铜离子向阴极移动,得电子,发生电极反应为:Cu2++2e-=Cu,氯离子向阳极移动,失电子,发生电极反应为:2Cl-+2e-=Cl2,所以电解总反应为:Cu2++2Cl-Cu+Cl2↑,故B符合题意;
C.CH3COOH为弱电解质,溶于水部分电离,因此电离方程式为CH3COOH CH3COO-+H+,故C不符合题意;
D.由图可知,反应H2(g)+Cl2(g)=2HCl(g)的反应热等于断裂反应物分子中的化学键吸收的总能量(436 kJ/ml+243 kJ/ml=679 kJ/ml),与形成生成物分子中化学键放出的总能量(431 kJ/ml×2= 862 kJ/ml)之差,即放热183kJ/ml,放热∆H为负值,所以H2(g)+Cl2(g)=2HCl(g) ∆H=-183kJ/ml,故D不符合题意;
综上所述,本题应选B。
【点睛】本题所选四个实验(或原理)均取材于课本,可见高考题越来越回归于课本。本题综合考查化学用语,涉及强、弱电解质的电离、电解方程式的书写,化学反应热的计算,题目把化学用语与化学反应原理巧妙地结合。
2.【答案】A
【解析】A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OHC17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1ml·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9ml·L-10.1ml·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2ONH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。
3.【答案】A
【解析】本题考查元素化合物知识,意在考查考生对元素化合物知识的掌握情况。H2S+CuSO4CuS↓+H2SO4,A选项正确;H2S+2NaOHNa2S+2H2O,B选项错误;FeSO4与H2S不反应,C选项错误;SO2+2H2S3S↓+2H2O,有沉淀生成,但SO2不是电解质,D选项错误。
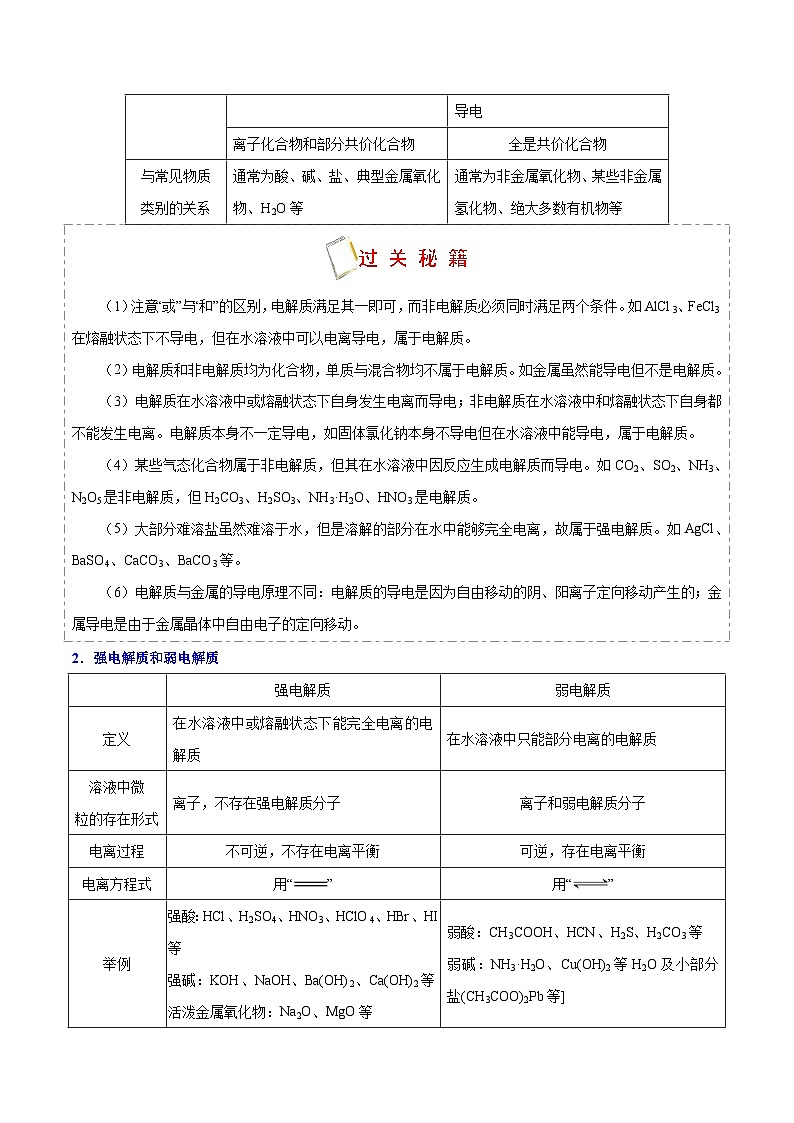
电解质
非电解质
定义
在水溶液中或熔融状态下能导电的化合物
在水溶液中和熔融状态下均不能导电的化合物
相同点
都是化合物
可溶于水,可不溶于水
不同点
在一定条件下能电离
不能电离
在水溶液中或熔融状态下能导电
在水溶液中和熔融状态下均不能导电
离子化合物和部分共价化合物
全是共价化合物
与常见物质
类别的关系
通常为酸、碱、盐、典型金属氧化物、H2O等
通常为非金属氧化物、某些非金属氢化物、绝大多数有机物等
强电解质
弱电解质
定义
在水溶液中或熔融状态下能完全电离的电解质
在水溶液中只能部分电离的电解质
溶液中微
粒的存在形式
离子,不存在强电解质分子
离子和弱电解质分子
电离过程
不可逆,不存在电离平衡
可逆,存在电离平衡
电离方程式
用“”
用“”
举例
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等
强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2等
活泼金属氧化物:Na2O、MgO等
绝大部分盐:BaSO4、BaCl2等
弱酸:CH3COOH、HCN、H2S、H2CO3等
弱碱:NH3·H2O、Cu(OH)2等H2O及小部分盐 QUOTE (CH3COO)2Pb等]
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C12H22O11(蔗糖)
BaSO4
C2H5OH
H2O
A
B
C
D
NaCl溶于水
电解CuCl2溶液
CH3COOH在水中电离
H2与Cl2反应能量变化
NaClNa++Cl−
CuCl2Cu2++2Cl−
CH3COOHCH3COO−+H+
H2(g)+Cl2(g) 2HCl(g)
ΔH=−183kJ·ml−1
高考化学 考点44 水的电离学案(含解析): 这是一份高考化学 考点44 水的电离学案(含解析),共6页。学案主要包含了水的电离,c与c的反比关系图像等内容,欢迎下载使用。
高考化学 考点43 电离平衡常数及相关计算学案(含解析): 这是一份高考化学 考点43 电离平衡常数及相关计算学案(含解析),共6页。
高考化学 考点42 弱电解质的电离平衡学案(含解析): 这是一份高考化学 考点42 弱电解质的电离平衡学案(含解析),共6页。学案主要包含了弱电解质的电离特点与影响因素,电离度,一元强酸与一元弱酸的比较,弱电解质分布系数的图像分析等内容,欢迎下载使用。












