




北京市鲁迅中学2023-2024学年高一上学期期中考试化学试题(原卷版+解析版)
展开
这是一份北京市鲁迅中学2023-2024学年高一上学期期中考试化学试题(原卷版+解析版),文件包含精品解析北京市鲁迅中学2023-2024学年高一上学期期中考试化学试题原卷版docx、精品解析北京市鲁迅中学2023-2024学年高一上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
高一化学
2023.11
本试卷分第一部分(选择题)和第二部分(非选择题)两部分,全卷共100分。考试时间60分钟。
可能用到的相对原子质量:C——12,O——16,Na——23
第一部分(共51分)
一、选择题:本大题共17小题,每小题3分,共51分。在每小题的4个选项中,只有1项是符合题目要求的。
1. 下列物质中,属于电解质的是
A. CuB. NaOHC. NaCl溶液D. 乙醇
【答案】B
【解析】
【分析】在水溶液或熔融状态下能导电的化合物称之为电解质:
【详解】A.Cu为金属单质,既不是电解质也不是非电解质,故A错误
B.NaOH的水溶液或者熔融状态均能导电,则为电解质,故B正确;
C.NaCl溶液虽然能导电,但其为混合物,所以不属于电解质,故C错误;
D.乙醇无论在水溶液还在熔融状态下均不导电,不属于电解质,故D错误;
答案选B。
2. 下列变化中,需要加入氧化剂才能实现的是
A. B. C. D.
【答案】D
【解析】
【详解】A.过程中,Fe元素化合价降低,需要加入还原剂,A不符合题意;
B.过程中氢元素化合价降低,需加入还原剂,B不符合题意;
C.未发生元素化合价的改变,不需要加入氧化剂,C不符合题意;
D.过程中,C元素的化合价升高,被氧化,加入氧化剂能实现该过程,D符合题意;
答案选D。
3. 下列物质中不能导电的是
A. 盐酸B. 干燥的固体C. 熔融的D. 溶液
【答案】B
【解析】
【分析】在水溶液中或熔融状态下存在自由移动的离子才具有导电性;金属中存在自由移动的电子,也能导电;
【详解】A.盐酸为混合物,既不是电解质也不是非电解质,含有自由移动离子,能导电,故A不选;
B.干燥的固体属于电解质,不含自由移动的离子不能导电,故B选;
C.熔融的,属于电解质,含有自由移动的离子,能导电,故C不选;
D.溶液为混合物,既不是电解质也不是非电解质,含有自由移动离子,能导电,故D不选;
故选B。
4. 下列说法正确是
A. 金属铜能导电,但它不是电解质,是非电解质
B. 、冰水、液氨都属于纯净物
C. 、等非金属氧化物均属于酸性氧化物
D. 、、在水中均能电离出氢离子,按分类属于酸
【答案】B
【解析】
【详解】A.金属Cu能导电,但铜是单质,不属于化合物,既不是电解质,也不是非电解质,A错误;
B.、冰水、液氨都属于纯净物,B正确;
C.CO无法与碱反应生成盐和水,不属于酸性氧化物,C错误;
D.HCl、在水中电离出阳离子全部是氢离子,按分类属于酸,在水中电离出的阳离子是钠离子和氢离子,属于盐,D错误;
故选B。
5. 下列各组离子能在溶液中大量共存的是
A. K+、OH-、Ba2+、Cl-B. Fe3+、、Mg2+、OH-
C. Cu2+、、Cl-、Ag+D. Ca2+、H+、Cl-、
【答案】A
【解析】
【详解】A.四种离子相互之间不反应可以大量共存,故A符合题意;
B.镁离子、铁离子与氢氧根会生成沉淀不能大量共存,故B不符合题意;
C.氯离子和银离子会生成沉淀不能大量共存,故C不符合题意;
D.氢离子、钙离子与碳酸根不能大量共存,故D不符合题意;
综上所述答案为A。
6. 下列离子方程式书写正确的是
A. 实验室用大理石和稀盐酸制取:
B. 将Cu丝插入溶液中:
C. 往澄清石灰水中通入二氧化碳:
D. 氢氧化钡溶液与稀硫酸反应:
【答案】C
【解析】
【详解】A,实验室用大理石和稀盐酸反应制取二氧化碳,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,A错误;
B.Cu与Ag+反应生成Cu2+和Ag,反应的离子方程式为Cu+2Ag+=Cu2++2Ag,B错误;
C.澄清石灰水中通入二氧化碳,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,离子方程式正确,C正确;
D.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,离子方程式为2H+++Ba2++2OH-=BaSO4↓+2H2O,D错误;
故答案选C。
7. 下列关于碳酸钠和碳酸氢钠的比较中,说法错误的是
A. 热稳定性:碳酸钠大于碳酸氢钠
B. 在其溶液中滴加澄清石灰水:它们都有白色沉淀生成
C. 做焰色试验:它们的火焰都呈黄色
D. 与相同浓度的盐酸反应产生CO2的速率:碳酸钠大于碳酸氢钠
【答案】D
【解析】
【详解】A.碳酸氢钠加热发生分解反应,而碳酸钠加热不分解,故A正确;
B.Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O(NaHCO3足量),所以在其溶液中滴加澄清石灰水,它们都有白色沉淀生成,故B正确;
C.钠元素的焰色试验呈黄色,两种物质都是钠盐,所以焰色试验呈黄色,故C正确;
D.碳酸钠与盐酸反应先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳,故相同条件下,与相同浓度的酸反应的速率为碳酸钠小于碳酸氢钠,故D错误;
故本题选D。
8. 是一种重要的化工原料,下列叙述中正确的是
A. 纯净的在中安静地燃烧,发出蓝色火焰
B. 通入冷的石灰乳中,制得漂白液
C. 能与水反应生成HClO和HCl,久置氯水的酸性变强
D. 过量的Fe在中燃烧,生成
【答案】C
【解析】
【详解】A.纯净的在中安静地燃烧,发出苍白色火焰,A错误;
B. 通入冷的石灰乳中,制得漂白粉,B错误;
C. 能与水反应生成HClO和HCl,次氯酸不稳定见光分解为盐酸和氧气,故久置氯水主要成分为盐酸、酸性变强,C正确;
D. Fe在中燃烧生成,与铁是否过量无关,D错误;
答案选C。
9. 图a~c分别为在不同条件下的导电实验(X、Y均表示石墨电极)的微观示意图。
下列说法中,不正确是
A. 图a中的代表的离子是
B. 图a表示的是干燥的固体不导电
C. 由图b可知在通电条件下才能发生电离
D. 由图b和c均可判断,X是与电源正极相连的电极
【答案】C
【解析】
【详解】A.半径大于,因此代表的是,A项正确;
B.NaCl固体不导电是因为和按照一定规则紧密排布,不能自由移动,图a表示的是干燥的NaCl固体不导电,B项正确;
C.NaCl在水溶液中就可以发生电离,而不是在通电条件下才能发生电离,C项错误;
D.由图b和c均可看出,向电源正极移动, 则X是与电源正极相连的电极,D项正确;
答案选C。
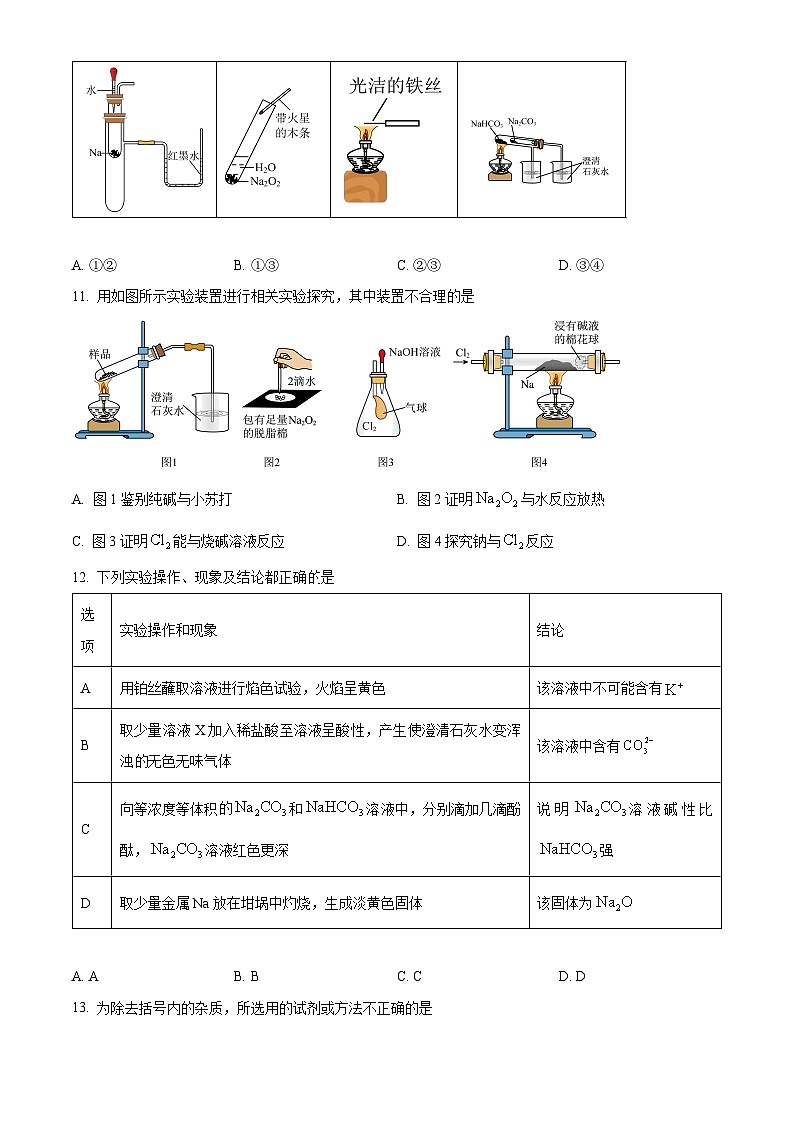
10. 下列实验装置能达到实验目的的是
A. ①②B. ①③C. ②③D. ③④
【答案】A
【解析】
【详解】①在试管中存在一定量的空气,钠与水对反应放热,放出的热量使空气膨胀,导致U型管中的红墨水左边液面下降,右边液面上升,①能达到实验目的;②过氧化钠与水反应生成的氧气能使带火星的木条复燃,②能达到实验目的;③钾元素的焰色试验,需要透过蓝色的钴玻璃观察,③不能达到实验目的;④比较碳酸钠、碳酸氢钠的热稳定性,应把碳酸氢钠放在小试管中,碳酸钠放在大试管中,小试管连接的澄清石灰水变浑浊,就能证明稳定性碳酸钠大于碳酸氢钠,④不能达到实验目的,故A正确,B、C、D错误;
故答案为:A 。
11. 用如图所示实验装置进行相关实验探究,其中装置不合理的是
A. 图1鉴别纯碱与小苏打B. 图2证明与水反应放热
C. 图3证明能与烧碱溶液反应D. 图4探究钠与反应
【答案】A
【解析】
【详解】A.加热固体试剂,试管口应略向下倾斜,故选A;
B.向包有过氧化钠的脱脂棉滴2滴水,脱脂棉燃烧,证明与水反应放热,故不选B;
C.锥形瓶中滴入氢氧化钠溶液,若气球膨胀,说明锥形瓶内气体减少,证明能与烧碱溶液反应,故不选C;
D.氯气通过热的金属钠,玻璃管内有白烟生成,说明钠与发生反应,故不选D;
选A。
12. 下列实验操作、现象及结论都正确的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.钾的焰色需透过紫色钴玻璃观察,用铂丝蘸取溶液进行焰色试验,火焰呈黄色,则该溶液中一定含有Na+,可能含有,故A错误;
B.取少量溶液X加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体,该溶液中含有或HCO,故B错误;
C.向等浓度等体积的和溶液中,分别滴加几滴酚酞,碳酸钠溶液的碱性更强,溶液红色更深,故C正确;
D.取少量金属Na放在坩埚中灼烧,生成淡黄色固体Na2O2,故D错误;
选C。
13. 为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3固体粉末(NaHCO3),加热分解
B. NaHCO3溶液(Na2CO3),应通入足量的CO2气体
C. CO2(O2),将混合气体通过灼热的铜网
D. Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
【答案】D
【解析】
【详解】A.NaHCO3受热分解生成Na2CO3,从而加热分解可以除去Na2CO3固体粉末中的NaHCO3杂质,故A正确;
B.Na2CO3溶液与CO2、H2O反应生成NaHCO3,NaHCO3不与CO2反应,通入过量的CO2气体,可以将NaHCO3中混有的Na2CO3除去,故B正确;
C.将混合气体通过灼热的铜网,O2与铜在加热条件下生成氧化铜固体,CO2与铜不反应,可以达到除杂的目的,故C正确;
D.Na2SO4与Ba(OH)2反应生成硫酸钡和NaOH,反应后过滤只能除去硫酸钡,不会除去NaOH,引入了新杂质,故D错误;
故选D。
14. 现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是
①Ca(OH)2 ②盐酸 ③BaCl2 ④NaOH ⑤加热
A. ②③B. ①③C. ③④D. ②⑤
【答案】A
【解析】
【详解】①二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别;
②加入盐酸,碳酸钠开始不生成气体,而碳酸氢钠立即生成气体,现象不同,可以鉴别;
③碳酸钠与氯化钡反应生成沉淀,而碳酸氢钠与氯化钡不反应,现象不同,可以鉴别;
④碳酸氢钠与NaOH反应生成碳酸钠和水,现象不明显,而碳酸钠与NaOH不反应,不能鉴别;
⑤在溶液中加热,都不分解,没有明显现象,不能鉴别;
综上,能将两者区分的是②③;
答案选A。
15. 下列实验中的颜色变化,与氧化还原反应无关的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】分析:A项,白色沉淀变为红褐色沉淀时的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3;B项,红色褪色是HClO表现强氧化性;C项,白色沉淀变为黑色时的反应为2AgCl+Na2S=Ag2S+2NaCl;D项,气体由无色变为红棕色时的反应为2NO+O2=2NO2。
详解:A项,NaOH溶液滴入FeSO4溶液中产生白色Fe(OH)2沉淀,白色沉淀变为红褐色沉淀时的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应前后元素化合价有升降,为氧化还原反应;B项,氯水中存在反应Cl2+H2OHCl+HClO,由于氯水呈酸性,石蕊溶液滴入后溶液先变红,红色褪色是HClO表现强氧化性,与有色物质发生氧化还原反应;C项,白色沉淀变为黑色时的反应为2AgCl+Na2S=Ag2S+2NaCl,反应前后元素化合价不变,不是氧化还原反应;D项,Cu与稀HNO3反应生成Cu(NO3)2、NO气体和H2O,气体由无色变为红棕色时的反应为2NO+O2=2NO2,反应前后元素化合价有升降,为氧化还原反应;与氧化还原反应无关的是C项,答案选C。
点睛:本题考查氧化还原反应的判断,分析颜色变化的原因、理解氧化还原反应的特征是解题的关键。
16. 下列实验过程中产生的现象与如图所示坐标图形相符合的是
A. 稀盐酸滴加到一定量溶液中(横坐标是稀盐酸的体积,纵坐标为数目)
B. 稀盐酸滴加到溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
C. 溶液滴入溶液中(横坐标是溶液的体积,纵坐标为沉淀质量)
D. 稀硫酸滴加到溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
【答案】D
【解析】
【详解】A.稀盐酸滴加到一定量溶液中,不断减小,减小到0后不会再增大,A错误;
B.稀盐酸滴加到溶液中虽然生成氯化银沉淀,但是同时生成了硝酸,溶液中的离子浓度不会减小到0后再增大(若两种溶液的浓度相同,则恰好反应时溶液中的离子浓度变为原来的一半),所以溶液的导电能力也不会减小到0后再增大,B错误;
C.NaOH溶液滴入溶液中生成碳酸钡沉淀,沉淀质量从0逐渐增大到最大值后不变,C错误;
D.稀硫酸滴加到溶液中发生的离子反应为,溶液中的离子浓度逐渐减小,二者恰好反应时离子浓度达到最小值,继续加入稀硫酸,离子浓度又逐渐增大到最大值(最大值由稀硫酸中的离子浓度决定)后不变,所以溶液的导电能力先减小后增大到不变,D正确;
故选D。
17. 在一定条件下。使12g CO和O2的混合气体充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重7g,原混合气体中O2的质量分数可能是
A. 33.3%B. 50%C. 58.3%D. 66.7%
【答案】A
【解析】
【详解】依次发生反应:2CO+ O22CO2、2 Na2O2+2 CO2=2Na2CO3+ O2,总反应方程式为CO+ Na2O2= Na2CO3,固体质量增加的质量相当于燃烧的CO的质量,
①如果混合气体中CO不足量,混合气体中CO的质量为7g,O2的质量为12g-7g=5g,O2在混合气体中的质量分数=41.7%;
②若混合气体中O2不足量,设7gCO完全燃烧消耗O2的质量为x,则:
2CO+ O22CO2
56:32=7g:x
解得x=4g,混合气体中O2的质量分数= 33.3%,
故答案为:A。
第二部分(共49分)
二、填空题:本大题共5小题,共49分。
18. 我国科学家用CO2人工合成淀粉时,第一步需要将CO2转化为甲醇,反应的化学方程式为:。
(1)做还原剂的物质是____________,碳元素的化合价____________(填“升高”或“降低”)。
(2)反应中每生成1个CH3OH,消耗CO2____________个,转移电子____________个。
【答案】(1) ①. H2 ②. 降低
(2) ①. 1 ②. 6
【解析】
【小问1详解】
该反应中H元素化合价升高,做还原剂的物质是H2,碳元素的化合价从+4价降低至-2价;
【小问2详解】
根据方程式的系数可知,反应中每生成1个CH3OH,消耗1个CO2,氢元素从0升高至+1价,生成1个CH3OH消耗3个氢气,转移6个电子。
19. 写出下列电离方程式
(1)硫酸_______________________
(2)氢氧化钙_______________________
(3)碳酸氢钠____________________
(4)硫酸氢钠____________________
(5)碳酸钠__________________
【答案】(1)
(2)
(3)
(4)
(5)
【解析】
【小问1详解】
硫酸电离时生成氢离子、硫酸根离子,其电离方程式为;
【小问2详解】
氢氧化钙电离时生成钙离子、氢氧根离子,其电离方程式为;
【小问3详解】
碳酸氢钠电离出钠离子和碳酸氢根离子,电离方程式为;
【小问4详解】
硫酸氢钠电离出钠离子、氢离子、硫酸根离子,电离方程式为;
【小问5详解】
碳酸钠电离时生成钠离子和碳酸根离子,其电离方程式为。
20. 请写出下列离子方程式
(1)铁和稀盐酸______________
(2)硫酸和氢氧化钡______________
(3)碳酸钙和盐酸______________
(4)氧化铜和硫酸______________
(5)铝与氯化铜溶液______________
【答案】(1)
(2)
(3)
(4)
(5)
【解析】
【小问1详解】
铁和稀盐酸反应生成氯化亚铁和氢气,离子方程式为:;
【小问2详解】
硫酸和氢氧化钡反应生成硫酸钡沉淀和水,离子方程式为:;
【小问3详解】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,离子方程式为:;
【小问4详解】
氧化铜和硫酸反应生成硫酸铜和水,离子方程式为:;
【小问5详解】
铝与氯化铜溶液反应生成氯化铝和铜,离子方程式为:。
21. 写出要求的方程式
(1)①离子方程式____________________________;
(2)②离子方程式______________________;
(3)③化学方程式____________________________;
(4)④溶液中,离子方程式______________________;
(5)⑤固体,化学方程式______________________;
(6)⑥溶液中,离子方程式______________________;
(7)⑦化学方程式____________________________;
(8)⑧离子方程式______________________;
(9)⑨离子方程式______________________;
【答案】(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
【解析】
【小问1详解】
①是钠和水反应生成NaOH和氢气,反应的离子方程式;
【小问2详解】
②是过氧化钠和水反应生成氢氧化钠和氧气,离子方程式;
【小问3详解】
③是过氧化钠和二氧化碳反应生成碳酸钠和氧气,化学方程式;
【小问4详解】
④是碳酸钠溶液中通入二氧化碳生成碳酸氢钠,离子方程式;
【小问5详解】
⑤是碳酸氢钠固体受热分解生成碳酸钠和二氧化碳和水,化学方程式;
【小问6详解】
⑥是碳酸氢钠溶液与NaOH反应生成碳酸钠和水,离子方程式;
【小问7详解】
⑦是铁和氯气在加热条件下反应生成氯化铁,反应的化学方程式;
【小问8详解】
⑧氯气和水反应生成HCl和HClO,次氯酸是弱酸不可拆,保留化学式,离子方程式;
【小问9详解】
⑨氯气与NaOH溶液反应生成NaCl、NaClO和水,离子方程式。
22. 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气。请回答下列问题:
I.实验室制备和收集氯气的常用装置如下图。
(1)利用该装置制备氯气的化学方程式为__________。
(2)在实验过程中饱和食盐水的作用是__________。
(3)实验装置接口的连接顺序为e→__________→ → → →i→h→g→f。
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl的作用是还原性和__________,若反应产生5个Cl2,则反应转移的电子数是__________。
【答案】22.
23. 洗气,除掉Cl2中的HCl杂质
24. dcab 25. ①. 酸性(或成盐) ②. 10
【解析】
【分析】浓盐酸和二氧化锰加热生成氯气,氯气通过饱和食盐水B吸收氯化氢气体,通过浓硫酸干燥,向上排空气法收集氯气,最后使用氢氧化钠溶液吸收尾气;
【小问1详解】
二氧化锰和浓盐酸加热制备氯气,还生成氯化锰、水,反应的化学方程式为;
【小问2详解】
浓盐酸具有挥发性,挥发出氯化氢气体导致氯气不纯;在实验过程中饱和食盐水的作用是洗气,除掉Cl2中的HCl杂质;
【小问3详解】
发生装置得到氯气,应该先除杂再干燥,故通过饱和食盐水后再通过浓硫酸干燥,氯气密度大于空气且有毒,使用万用瓶装置长进短出收集,然后使用氢氧化钠溶液吸收尾气减小污染,故实验装置接口的连接顺序为e→d→c→a→b→i→h→g→f,故答案为:dcab;
【小问4详解】
在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Cl元素的化合价升高,该反应中生成两种盐体现盐酸的酸性、生成氯气时失去电子体现HCl的还原性,氯元素化合价从-1升高至0价,每反应产生5个Cl2,有10个氯原子变价,则转移10个电子。①验证和水反应是否为放热反应
②检验Na2O2与反应有生成
③观察的焰色试验
④比较、的稳定性
选项
实验操作和现象
结论
A
用铂丝蘸取溶液进行焰色试验,火焰呈黄色
该溶液中不可能含有
B
取少量溶液X加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
该溶液中含有
C
向等浓度等体积的和溶液中,分别滴加几滴酚酞,溶液红色更深
说明溶液碱性比强
D
取少量金属Na放在坩埚中灼烧,生成淡黄色固体
该固体为
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
相关试卷
这是一份北京市第一五九中学2023-2024学年高一上学期期中考试化学试题(原卷版+解析版),文件包含精品解析北京市第一五九中学2023-2024学年高一上学期期中考试化学试题原卷版docx、精品解析北京市第一五九中学2023-2024学年高一上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份北京市顺义区第九中学2023-2024学年高一上学期期中考试化学试题(原卷版+解析版),文件包含精品解析北京市顺义区第九中学2023-2024学年高一上学期期中考试化学试题原卷版docx、精品解析北京市顺义区第九中学2023-2024学年高一上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份北京市第一五六中学2021-2022学年高三上学期期中考试化学试题(原卷版+解析版),文件包含精品解析北京市第一五六中学2021-2022学年高三上学期期中考试化学试题原卷版docx、精品解析北京市第一五六中学2021-2022学年高三上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。









