





所属成套资源:新高考新教材广西专版2024届高考化学二轮总复习专题课件
新高考新教材广西专版2024届高考化学二轮总复习专题10化学反应速率与化学平衡课件
展开
这是一份新高考新教材广西专版2024届高考化学二轮总复习专题10化学反应速率与化学平衡课件,共60页。PPT课件主要包含了内容索引,专项突破•素能提升,%或05,1-α,×10-5,对点演练,选择合适催化剂等,第二步找数据,第三步代数计算,应考训练等内容,欢迎下载使用。
考点一 外界条件对化学反应速率的影响
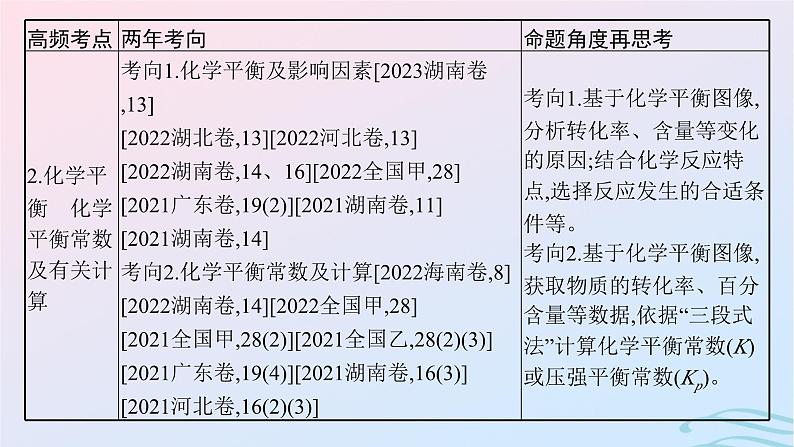
考点二 化学平衡 化学平衡常数及有关计算
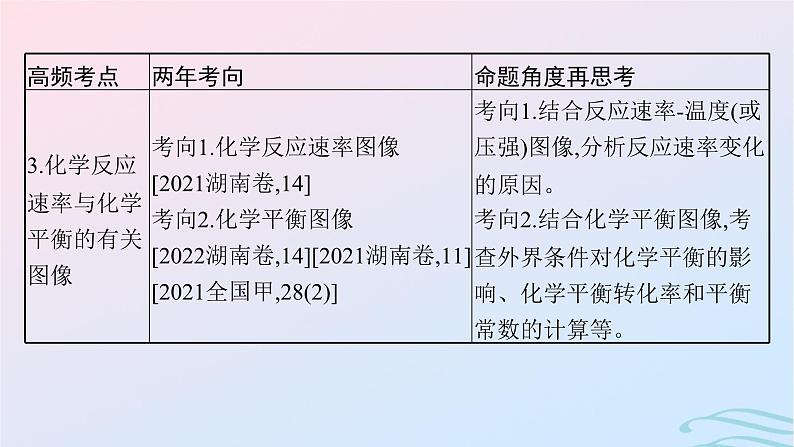
考点三 化学反应速率与化学平衡的有关图像
【考情分析•定向备考】
【要点归纳•夯基提能】
1.掌握计算化学反应速率的两种方法(1)根据定义式及图表中数据计算:微点拨①计算时一定要注意溶液的体积,不能盲目地把Δn当作Δc代入公式进行计算;②还要注意单位及规范书写。(2)根据“比例关系”计算。对于反应“mA(g)+nB(g) pC(g)+qD(g)”,则有v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。 要注意物质的状态
2.从不同角度认识反应速率常数(1)假设基元反应(能够一步完成的反应)为aA(g)+bB(g) === cC(g)+dD(g),其速率可表示为v=kca(A)cb(B),式中的k称为反应速率常数或速率常数。微点拨①反应速率常数(k)表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面积等因素的影响;②通常反应速率常数越大,反应进行得越快。(2)正、逆反应的速率常数与平衡常数的关系。
3.从“有效碰撞”角度认识外界条件对化学反应速率的影响(1)活化分子和有效碰撞。①能够发生有效碰撞的分子叫做活化分子。活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最低能量,即活化分子比普通分子多出的那部分能量。②能够发生化学反应的碰撞叫做有效碰撞。 两个条件缺一不可发生有效碰撞的两个条件:一是反应物分子必须具有足够的能量(即活化分子);二是分子碰撞时要有合适的取向。
微点拨活化能是影响化学反应速率的内因。相同条件下,不同化学反应的速率不同,主要是活化能大小不同引起。一般情况,反应的活化能越小,化学反应速率越大,反之,反应的活化能越大,反应速率越小。
(2)影响化学反应速率的外界因素。
(3)“惰性气体”(非反应气体)对化学反应速率的影响。
【明确考向•真题演练】
真题示例1- 1.(2022广东卷)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )。
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 ml·L-1·min-1
解析 由图可知,无催化剂时,随着反应进行,生成物的浓度也在增加,说明反应也在进行,A项错误。由图可知,催化剂Ⅰ比催化剂Ⅱ催化效果好,反应速率大,说明催化剂Ⅰ使反应活化能更低,B项错误。由图可知,使用催化剂Ⅱ时,在0~2 min内Y的浓度变化了2.0 ml·L-1,而a曲线表示的X的浓度变化了2.0 ml·L-1,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂Ⅱ时X的浓度随时间t的变化,C项错误。使用催化剂Ⅰ时,在0~2 min内,Y的浓度变化了4.0 ml·L-1,
在选择使用催化剂Ⅰ和350 ℃条件下反应,0~2 min生成CH3OH的平均反应速率为 μml·L-1·min-1;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400 ℃的反应条件,原因是 。
相同催化剂,400 ℃的反应速率更大;相同温度,催化剂Ⅱ副产物浓度低,甲烷与甲醇比例高
解析 (1)温度t下,向容积为10 L的抽空的密闭容器中通入0.1 ml CO2和0.1 ml H2,反应平衡后测得容器中n(CH4)=0.05 ml,则CO2的转化率为
解析 (1)若甲烷的转化率为α,则此时甲烷的浓度为c(CH4)×(1-α),根据速率方程,可以得出r2=(1-α)r1。(2)根据速率方程,可以得出甲烷浓度越大,反应速率越大,A项正确。速率方程中没有涉及H2的浓度,即r的大小与H2的浓度无关,B项错误。随着反应进行,甲烷浓度减小,反应速率减小,乙烷的生成速率逐渐减小,C项错误。降低温度,反应速率会减小,D项正确。
方法技巧利用“三段式法”巧解化学反应速率计算题。(1)写出有关反应的化学方程式。(2)找出各物质的起始浓度、转化浓度和某时刻浓度。(3)根据已知条件列出“三段式”进行计算。
对点演练1- 1.(2023广东汕头金山中学一模)还原CO制备C可通过下列两个反应实现:
723 K下,在初始压强相同(均为12.0 kPa)的甲、乙两密闭容器中分别发生反应Ⅰ、反应Ⅱ,得到部分气体的分压随时间的变化关系如图所示。下列说法错误的是( )。
A.甲容器中,10~40 min内用H2表示的平均反应速率v(H2)=0.15 kPa·min-1B.增大起始时容器的压强,CO的平衡转化率增大C.此条件下,选择CO还原CO的效率更高D.723 K时,反应Ⅱ的平衡常数Kp=119
1- 2. T1 ℃时,在一密闭容器中发生反应4NO(g) N2(g) +2NO2(g),其正反应速率表达式为v正=k正·cn(NO),测得速率和浓度的关系如下表。
则n= ,k正= ml-3·L3·s-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将 (填“增大”“减小”或“不变”)。
方法技巧(1) 在相同的浓度下,可用速率常数大小比较化学反应速率的大小。(2)同一化学反应,温度不同,速率常数不同,但浓度不影响速率常数。
考向2 判断外界条件对化学反应速率的影响真题示例
A.该反应的ΔH0,A项错误;因为正反应ΔH>0,随温度的升高n(H2O)应呈现较大的增大趋势,由题图a走势可知,B项错误;向恒容密闭容器中充入惰性气体,由于容器容积不变,各组分的浓度不发生变化,平衡常数不变,平衡不发生移动,C项正确;BaSO4为固体,向平衡体系中加入固体,平衡不发生移动,氢气的平衡转化率不变,D项错误。
2- 2.(2021河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N === X+Y;②M+N === X+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )。
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3 ml·L-1·min-1B.反应开始后,体系中Y和Z的浓度之比保持不变C.如果反应能进行到底,反应结束时62.5%的M转化为ZD.反应①的活化能比反应②的活化能大
解析 达到平衡后,再充入少量氢气,平衡向正反应方向移动,二氧化碳的平衡转化率增大,A项正确;其他条件不变,加入催化剂,能降低反应的活化能,正、逆反应速率均增大,B项正确;其他条件不变,在恒容密闭容器中充入氩气,反应体系中各物质浓度均没有变化,化学反应速率不变,平衡不移动,C项错误;其他条件不变,降低温度,活化分子的数目和百分数均减少,有效碰撞次数减少,正、逆反应速率均减小,D项正确。
A.L线表示平衡时n(H2O)随温度的变化B.其他条件不变时,若扩大容器容积,则v正减小,v逆增大C.x=5.16D.使用催化剂,可降低反应的活化能,减小ΔH的值
易错警示若一个反应分多步进行,活化能越大,反应速率越小,整个总反应的反应速率由慢反应决定。
【易错易混•防范失分】
1.判断化学平衡状态的“三要素”(1)分析反应条件,看清反应体系是恒温恒容、恒温恒压还是绝热容器。(2)分析反应特点,看清反应前后气体分子总数是否发生变化,确定反应过程中气体总物质的量、总压强是否变化。
(3)巧用“正逆相等,变量不变”作出判断。
微点拨分析可逆反应时,要注意反应的特殊情况,看清是否有固体参加或生成,是否存在固体的分解反应等。
2.掌握化学平衡移动的判断方法(1)根据勒夏特列原理判断。通过比较改变外界条件,平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
(2)根据浓度商(Q)与平衡常数(K)的关系判断(相同温度)。 判断前提条件根据比较浓度商(Q)与化学平衡常数(K)的大小来判断平衡移动的方向。①若Q>K,平衡向逆反应方向(或向左)移动;②若Q=K,平衡不发生移动;③若Qv逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A项错误;催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B项错误;恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C项正确;恒容下,充入一定量的CH2=CH2(g),平衡向正反应方向移动,但是CH2=CH2(g)的平衡转化率减小,D项错误。
2- 2.(2022河北卷)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
(1)下列操作中,能提高CH4(g)平衡转化率的是 。 A.增加CH4(g)用量B.恒温恒压下通入惰性气体C.移除CO(g)D.加入催化剂
解析 (1)A.增加CH4(g)用量可以提高H2O(g)的转化率,但是CH4(g)平衡转化率减小,A项不符合题意;B.恒温恒压下通入惰性气体,相当于减小体系压强,反应混合物中各组分的浓度减小,反应Ⅰ的化学平衡正向移动,能提高CH4(g)平衡转化率,B项符合题意;C.移除CO(g),减小了反应混合物中CO(g)的浓度,反应Ⅰ的化学平衡正向移动,能提高CH4(g)平衡转化率,C项符合题意;D.加入催化剂不能改变平衡状态,故不能提高CH4(g)平衡转化率,D项不符合题意。综上所述,上述操作中,能提高CH4(g)平衡转化率的是BC。
2- 3. 硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:
(1)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0 MPa、550 ℃时α= ,判断的依据是 。影响α的因素有 。
(2)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为 , 平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
答案 (1)0.975 该反应气体分子数减少,增大压强,α提高。5.0 MPa>2.5 MPa=p2,所以p1=5.0 MPa 温度、压强和反应物的起始浓度(组成)
解析 (1)要分析反应在5.0 MPa、500 ℃时的α,首先必须判断此时的压强对应题图p1、p2、p3中哪一个。在其他条件相同时,正反应是气体分子数减少的反应,压强越大SO2平衡转化率α越大,可确定此时对应压强为p1,SO2平衡转化率α=0.975。
下列说法错误的是( )。A.当满足2v逆(H2S)=v正(H2)时,反应达到平衡状态B.采用高温、低压条件,有利于提高CH4的平衡转化率C.图中M点时,保持温度不变,再向容器中充入3 ml CH4和6 ml H2S,达到新平衡时,CH4的物质的量分数小于H2的物质的量分数D.图中N点对应温度下,以物质的量分数表示的化学平衡常数
解析 反应速率比等于化学计量数之比,2v逆(H2S)=v正(H2)表示正逆反应方向,能说明达到平衡状态,A项正确。由图知,温度升高,CH4的物质的量分数减小,说明平衡正向移动,正反应方向是气体分子数增大的反应,则减小压强,平衡正向移动,则采取高温、低压条件,有利于提高CH4的平衡转化率,B项正确。恒容密闭容器中,达平衡时,向容器内加入3 ml CH4和6 ml H2S,建立等效平衡,相当于压强增大一倍,则平衡逆向移动,达到新平衡时,CH4的物质的量分数大于H2的物质的量分数,C项错误。N点温度下,设CH4转化了x ml,列三段式:
反应过程中气体分子总数不变,改变压强平衡不移动
(2)由(1)中的数据可知A点时 ;该反应为放热反应,升高温度,平衡向逆反应方向移动,p(NO2)增大,由图可知,当lg p(SO3)=1时,T1、T2温度下对应的lg p(NO2)分别为2、3,温度为T1下的lg p(NO2)小于温度为T2下的lg p(NO2),即温度为T1下的p(NO2)小于温度为T2下的p(NO2),故有T10,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大。( )(6)改变条件,平衡正向移动,反应物的平衡转化率一定增大。( )
1.利用图像“断点”判断化学反应速率的影响因素(1)当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,使速率(v)-时间(t)图像的曲线出现不连续的情况,根据出现“断点”前后的速率大小,即可对外界条件的变化情况作出判断,如图所示:
t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)。
(2)常见含“断点”的速率变化图像分析:
微点拨在速率-时间图像中,外界条件改变时,要判断是否出现“断点”,若出现“断点”,改变的条件可能是改变温度、改变压强或使用催化剂。若只改变反应物的浓度或生成物的浓度,速率-时间图像不会出现“断点”。
2.转化率(α)-时间(t)-温度(T)或压强(p)图像及分析以mA(g)+nB(g) pC(g)+qD(g)为例:
(1)图甲中,T2>T1,升高温度,αA减小,说明平衡逆向移动,正反应的ΔHp2,增大压强,αA增大,说明平衡正向移动,正反应是气体总分子数减小的反应。(3)若纵坐标表示A的百分含量,则甲中正反应的ΔH>0,乙中正反应是气体总分子数增大的反应。
3.恒温线(或恒压线)图像及分析
(1)纵坐标代表反应物的转化率(α)或平衡浓度(c),横坐标代表温度(T)或压强(p)。(2)采用“定一议二”法,即将自变量(温度或压强)之一看作恒量,讨论另外两个量的关系。
微点拨分析化学反应速率和平衡图像的三个步骤:①判断反应速率是增大还是减小;②确定v(正)、v(逆)的相对大小;③判断化学平衡的移动方向及移动结果(包括平衡转化率、物质的浓度、百分含量等)。
考向1 化学反应速率图像真题示例
(2021辽宁卷)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期。下列说法错误的是( )。
A.其他条件相同时,催化剂浓度越大,反应速率越大B.其他条件相同时,降冰片烯浓度越大,反应速率越大C.条件①,反应速率为0.012 ml·L-1·min-1D.条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min
A.从反应开始至达到平衡时,以CO2表示的平均反应速率为0.04 ml·L-1·min-1B.该反应在A、B两点的正反应速率之比为vA∶vB=25∶4C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态D.T ℃时,该反应的平衡常数为K=8
A.0~t2时,v正>v逆B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>ⅡC.t2时刻改变的条件是向密闭容器中加入CD.Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠv逆,t1~t2,反应到达平衡,v正=v逆,A项错误。t2时刻改变条件后达到新平衡,逆速率不变,说明改变条件后与原平衡等效,平衡不移动,因此达到平衡时A的体积分数Ⅰ=Ⅱ,B项错误。向密闭容器中加入C,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图像,C项正确。该反应是在恒温下进行,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠ=KⅡ,D项错误。
易错警示分析化学反应速率图像的三个易错点。
考向2 化学平衡图像真题示例
2- 2.(2022全国乙)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题。(1)已知下列反应的热化学方程式:①2H2S(g)+3O2(g) ══ 2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·ml-1②4H2S(g)+2SO2(g) ══ 3S2(g)+4H2O(g) ΔH2=+94 kJ·ml-1③2H2(g)+O2(g) ══ 2H2O(g) ΔH3=-484 kJ·ml-1计算H2S热分解反应④2H2S(g) ══ S2(g)+2H2(g) ΔH4= kJ·ml-1。
(2)较普遍采用的H2S处理方法是克劳斯工艺,即利用反应①和②生成单质硫。另一种方法是利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ,缺点是 。 (3)在1 470 K、100 kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 ,平衡常数Kp= 。
(4)在1 373 K、100 kPa反应条件下,对于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S)∶n(Ar)越小,H2S平衡转化率 ,理由是 。 ②n(H2S)∶n(Ar)=1∶9对应图中曲线 ,计算其在0~0.1 s之间,H2S分压的平均变化率为 kPa·s-1。
答案 (1)+170(2)能获取可作燃料的氢气 消耗能源(3)50% 4.76(4)①越高 恒压条件下,H2S的分压越小,越有利于H2S分解反应的正向进行 ②d 24.9
(2)反应④可生成氢气,因此优点为“能获取可作燃料的氢气”;二者的反应条件不同,反应④需要高温分解,因此缺点是消耗能源。
(4)①H2S分解反应是气体化学计量数增大的反应,因此恒压条件下,H2S的分压越小,越有利于H2S分解反应正向进行,即H2S的平衡转化率越大。②由图像和转化率大小关系可知,曲线a、b、c、d、e分别表示n(H2S)∶n(Ar)为4∶1、1∶1、1∶4、1∶9和1∶19时的转化率与时间的关系,因此n(H2S)∶n(Ar)=1∶9对应的是曲线d。设起始时H2S的物质的量为1 ml,则Ar的物质的量为9 ml,由题图可知,当0.1 s时H2S的转化率为24%,则:
方法技巧解答化学平衡图像题的思维模板。解题时,要先分析反应特点(反应物和生成物的状态、反应前后气体总分子数的变化、ΔH的正负),再分析化学平衡图像,并联想规律,得出结论。
科研人员研究压强对催化剂活性的影响:在1 073 K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。
为分析某催化剂对该反应的选择性,将 1 ml NH3和2 ml O2充入1 L密闭容器中,在不同温度、相同时间下,测得有关物质的量关系如图1。
①该催化剂在低温时对反应 (填“Ⅰ”或“Ⅱ”)的选择性更好。 ②高于840 ℃时,NO 的产率降低的可能原因是 (填字母)。 A.NH3溶于水B.反应活化能增大C.反应Ⅰ的平衡常数变小D.催化剂活性降低
(2)NH3是造成水体富营养化的重要原因之一,用 NaClO 溶液氧化可除去氨氮。其反应机理如图2所示(其中H2O和NaCl略去)。
①NaClO氧化NH3的总反应的化学方程式为 。 ③为了提高氨氮的去除率,在实际工艺过程中温度控制在 15~30 ℃,其可能的原因是 。
答案 (1)①Ⅱ ②CD(2)①2NH3+3NaClO === N2+3H2O+3NaCl ②1.5③温度过低时化学反应速率小,去除效率低;温度过高时,促进HClO的分解(或 NaClO 分解),NaClO 的利用率降低,且氨在温度过高时易挥发
解析 (1)①由图1知,在低温时,生成N2比生成NO多,故该催化剂在低温时对反应Ⅱ选择性更好;②由于反应用到了催化剂,故此时NO产率降低有可能是因为温度过高导致催化剂活性下降,另外此反应正向为放热反应,升高温度,平衡逆向移动,也会导致NO产率下降,故选CD。(2)①由图2知,初步确定总反应的反应物为NaClO、NH3,生成物为N2,根据元素质量守恒,结合题干信息,确定生成物中还有H2O、NaCl,配平得总反应方程式为2NH3+3NaClO === N2+3H2O+3NaCl。②去除率较高,余氯较低,说明去除效果最佳,由图3可知符合要求的最佳值约为1.5。③控温15~30 ℃,可从温度过低和过高两个角度回答,即温度过低时化学反应速率小,去除效率低;温度过高时,促进HClO的分解(或 NaClO 分解), NaClO 的利用率降低,且氨在温度过高时易挥发。
方法技巧突破化学反应速率和平衡图像的“三技巧”。
有可逆反应A(g)+3B(g)2C(g) ΔH0B.由图可知,1 100 ℃时Al2O3几乎失去催化活性C.不加催化剂时,温度越高,反应速率越大,达到平衡所需的时间越短D.A点达到平衡时,若此时气体总压强为p,则平衡常数Kp=0.25p
1. 已知H2S分解反应:2H2S(g) 2H2(g)+S2(g),在无催化剂及Al2O3催化下,恒容密闭容器中只充入H2S,在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
解析 由图可知,升高温度,H2S的转化率增大,说明升高温度,平衡向正反应方向移动,正反应为吸热反应,ΔH>0,A项正确。1 100 ℃,有催化剂和无催化剂时,H2S的转化率相等,表明Al2O3几乎失去催化活性,B项正确。不加催化剂时,温度越高,反应速率越大,达到平衡所需的时间越短,C项正确。A点达到平衡时,H2S的转化率为50%,设起始充入H2S的物质的量为x ml,列出三段式:
2. 向20 mL 0.20 ml·L-1 H2O2溶液中加入少量KI溶液,发生以下反应: ⅰ.H2O2+I- === H2O+IO-,ⅱ.H2O2+IO- === H2O+O2↑+I-。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算成标准状况)如下:
下列判断正确的是( )。A.反应ⅰ是放热反应B.反应ⅱ决定整个反应的速率C.IO-是H2O2分解反应的催化剂D.0~20 min的平均反应速率:v(H2O2)=5.0×10-3 ml·L-1·min-1
4. 二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以CO2、H2为原料制备二甲醚涉及的主要反应如下:
(2)在压强、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
答案 (1)-204.7 kJ·ml-1(2)① 高于300 ℃时,以反应Ⅱ为主,反应Ⅱ为吸热反应,温度升高平衡正向移动,CO2的平衡转化率增大 D(3)①降低温度或及时分离出产物CH3OCH3或H2O(任写一条) ②C(4)①减小 ②0.8
(4)①降低温度平衡向放热反应方向进行(即ΔH
相关课件
这是一份新高考新教材广西专版2024届高考化学二轮总复习专题9电化学课件,共60页。PPT课件主要包含了内容索引,考点二电解原理,专项突破•素能提升,归纳总结,解题思路,Na+,题型突破等内容,欢迎下载使用。
这是一份新高考新教材广西专版2024届高考化学二轮总复习专题8化学反应的热效应课件,共54页。PPT课件主要包含了内容索引,考点一反应热,考点二反应热的计算,专项突破•素能提升,N2↑,H2O,2计算方法,对点演练,应考训练等内容,欢迎下载使用。
这是一份新高考新教材广西专版2024届高考化学二轮总复习专题7物质结构与性质课件,共60页。PPT课件主要包含了内容索引,专项突破•素能提升,对点演练,第二步逐项分析,sp2,方法技巧,归纳总结,sp3,H2O,晶体密度的计算等内容,欢迎下载使用。









