



重庆市巴渝学校2023-2024学年高二上学期期中(半期)考试化学试题(原卷版+解析版)
展开
这是一份重庆市巴渝学校2023-2024学年高二上学期期中(半期)考试化学试题(原卷版+解析版),文件包含精品解析重庆市巴渝学校2023-2024学年高二上学期期中半期考试化学试题原卷版docx、精品解析重庆市巴渝学校2023-2024学年高二上学期期中半期考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
考试时间:75分钟,总分:100分
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试范围:选择性必修一第一章至第三章。
6.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32
第I卷(选择题,共42分)
一、选择题(每小题3分且只有一个正确选项,共14小题)
1. 下列反应或过程属于熵减的是
A. 氯化钠从溶液中结晶析出B. 胆矾晶体溶于水
C. 固态碘升华D. 碳酸钙分解
【答案】A
【解析】
【详解】对同一种物质,气态时熵最大,液态时的次之,固态时的最小。因此由气体→液体→固体的反应或过程属于熵减,故选A。
2. 下列说法正确的是
A. 活化分子之间的碰撞一定是有效碰撞
B. 任何有能量变化的过程都是化学变化过程
C. 放热反应在任何条件下都容易自发进行,而吸热反应在任何条件下都不容易自发进行
D. 升高温度、增加反应物的浓度和使用催化剂都能增加单位体积内活化分子数目,加快化学反应速率
【答案】D
【解析】
【详解】A.活化分子之间的碰撞不一定是有效碰撞,能够发生化学反应的碰撞才是有效碰撞,A不正确;
B.有能量变化的过程不一定是化学变化过程,如物质仅发生状态变化时,也有能量的变化,B不正确;
C.放热反应在常温下有时也不能自发进行,吸热反应在常温下也可能自发进行,C不正确;
D.升高温度能增大活化分子数和活化分子百分数,增加反应物的浓度可增大单位体积内活化分子数,使用催化剂可降低反应的活化能,从而增加单位体积内活化分子数目,从而加快化学反应速率,D正确;
故选D。
3. 在下列各说法中,正确的是
A. 热化学方程式中的化学计量数可以是分数B. 表示放热反应,表示吸热反应
C. 的大小与热化学方程式中的计量数无关D. 与反应放出的热就是的燃烧热
【答案】A
【解析】
【分析】
【详解】A.热化学方程式中化学计量数表示的是物质的量,所以可以是整数,也可以是分数,A正确;
B.表示吸热反应,表示放热反应,B错误;
C.的数值与化学计量数对应,随化学计量数的改变而改变,C错误;
D.充分燃烧生成液态水放出的热量称为的燃烧热,此时不能确定反应后水的状态,D错误;
故选A。
4. 为阿伏加德罗常数,下列说法正确的是
A. 与足量反应,生成和的混合物,钠失去电子数为
B. 粉与足量S粉加热充分反应转移的电子数为
C. 溶液中含有的数目为
D. 常温下,的溶液中,体系中的数目为
【答案】B
【解析】
【详解】A.1mlNa与足量O2反应,生成Na2O和Na2O2的混合物,Na元素均由0价升高为+1价,钠失去电子数为NA,故A错误;
B.Fe与S加热时反应生成FeS,5.6gFe粉与足量S粉加热充分反应转移的电子数为×2×NA/ml=0.2NA,故B正确;
C.Fe2+在水中能水解,溶液中含有Fe2+的数目小于0.01NA,故C错误;
D.只知道氢离子浓度,溶液体积不知,不能计算体系中H+的数目,故D错误;
故选:B。
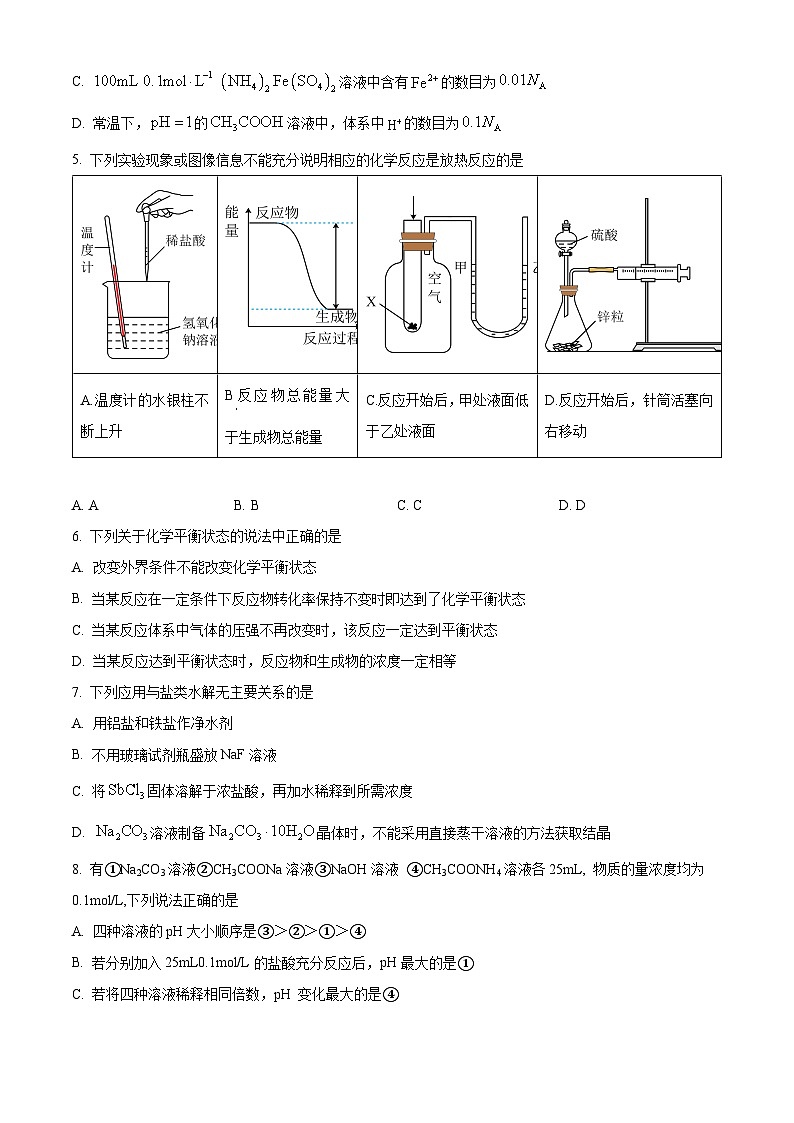
5. 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.温度计的水银柱不断上升说明稀盐酸和氢氧化钠溶液的反应为放热反应,故A不符合题意;
B.由图可知,该反应为反应物总能量大于生成物总能量的放热反应,故B不符合题意;
C.反应开始后,甲处液面低于乙处液面说明X和Y的反应为放热反应,故C不符合题意;
D.锌与稀硫酸反应生成硫酸锌和氢气,反应生成的氢气会使针筒活塞向右移动,则反应开始后,针筒活塞向右移动不能说明锌与稀硫酸的反应为放热反应,故D符合题意;
故选D。
6. 下列关于化学平衡状态的说法中正确的是
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
【答案】B
【解析】
【分析】
【详解】A.改变外界条件可以改变化学平衡状态,A错误;
B.当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态,B正确;
C.当某反应体系中气体的压强不再改变时,对于体积不变的反应不一定达到平衡状态,C错误;
D.当某反应达到平衡状态时,反应物和生成物的浓度保持不变,不一定相等,D错误;
答案选B。
7. 下列应用与盐类水解无主要关系的是
A. 用铝盐和铁盐作净水剂
B. 不用玻璃试剂瓶盛放NaF溶液
C. 将固体溶解于浓盐酸,再加水稀释到所需浓度
D. 溶液制备晶体时,不能采用直接蒸干溶液的方法获取结晶
【答案】D
【解析】
【详解】A.铝盐和铁盐能在水中发生水解生成胶体,如、,胶体具有吸附性,能吸附水中悬浮颗粒物,可以用于净水,故A不选;
B.NaF在水中发生水解,,生成的HF能腐蚀玻璃,所以不用玻璃试剂瓶盛放NaF溶液,故B不选;
C.易水解,,浓盐酸中溶液能抑制其水解,故C不选;
D.溶液直接蒸干,得到固体,用溶液制备晶体时可采用加热浓缩,冷却结晶的方法,与水解无关,故D选;
故选D。
8. 有①Na2CO3溶液②CH3COONa溶液③NaOH溶液 ④CH3COONH4溶液各25mL, 物质的量浓度均为0.1ml/L,下列说法正确的是
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25mL0.1ml/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH 变化最大的是④
D. 升高温度,四种溶液的pH均减小
【答案】B
【解析】
【详解】A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的酸性,醋酸铵溶液呈中性,所以四种溶液pH的大小顺序是③>①>②>④,A错误;
B.分别加入等体积,等浓度的盐酸充分反应后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,④中为CH3OOH和NH4Cl,HCO3-离子水解显碱性,所以pH最大的是①,B正确;
C.稀释时强碱的pH变化程度大,所以四种溶液稀释相同倍数,pH变化最大的是③,C错误;
D.升高温度,水的离子积常数增大,氢氧化钠中氢氧根浓度不变,氢离子浓度增大,pH减小,D错误;
答案选B。
【点睛】①等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小;②稀释时强碱的pH变化程度大。
9. 两种盐的稀溶液:aml·L-1NaX溶液和bml·L-1NaY溶液。下列说法不正确的是( )
A. 若a=b,且pH(NaX)>pH(NaY),则酸性HXb,且c(X-)=c(Y-),则溶液中c(HX)>c(HY)
C. 若a=b,且c(X-)=c(Y-)+c(HY),则HX为强酸
D. 若两溶液等体积混合后c(X-)+c(HX)=c(Y-)+c(HY)=0.1ml·L-1,则a=b=0.1ml·L-1
【答案】D
【解析】
【详解】两种溶液浓度相同,,说明NaX的碱性更强,对应的的水解程度更强,因此酸性,故A正确;
B.并且,根据物料守恒,,所以溶液中,故B正确;
C.且,因此可以看出没有水解,因此HX为强酸,故C正确;
D.两种溶液混合以前,根据物料守恒,,若等体积混合,则混合后的体积是混合前的两倍,此时c(X-)+c(HX)=,c(Y-)+c(HY)=,又因为c(X-)+c(HX)=c(Y-)+c(HY)=0.1ml/L,则a=b=0.2,故D错误;
故选:D。
10. 常温下,下列溶液中各组离子可能大量共存的是
A. 的溶液:、、、
B. 的溶液中:、、、
C. 在能与Al反应生成的溶液中:、、、
D. 由水电离产生的的溶液:、、、
【答案】D
【解析】
【详解】A.Al3+与发生双水解反应,不能大量共存,A项不符合题意;
B.pH=8的溶液呈碱性,Ba2+与形成BaCO3沉淀,不能大量共存,B项不符合题意;
C.与Al反应生成H2的溶液可能呈强酸性、也可能呈强碱性,无论酸性、还是碱性条件下都不能大量存在,碱性条件下不能大量存在,C项不符合题意;
D.水电离产生的c(H+)=1×10-12ml/L的溶液可能呈酸性、也可能呈碱性,碱性条件下不能大量存在,酸性条件下K+、、、Cl-能大量共存,D项符合题意;
答案选D。
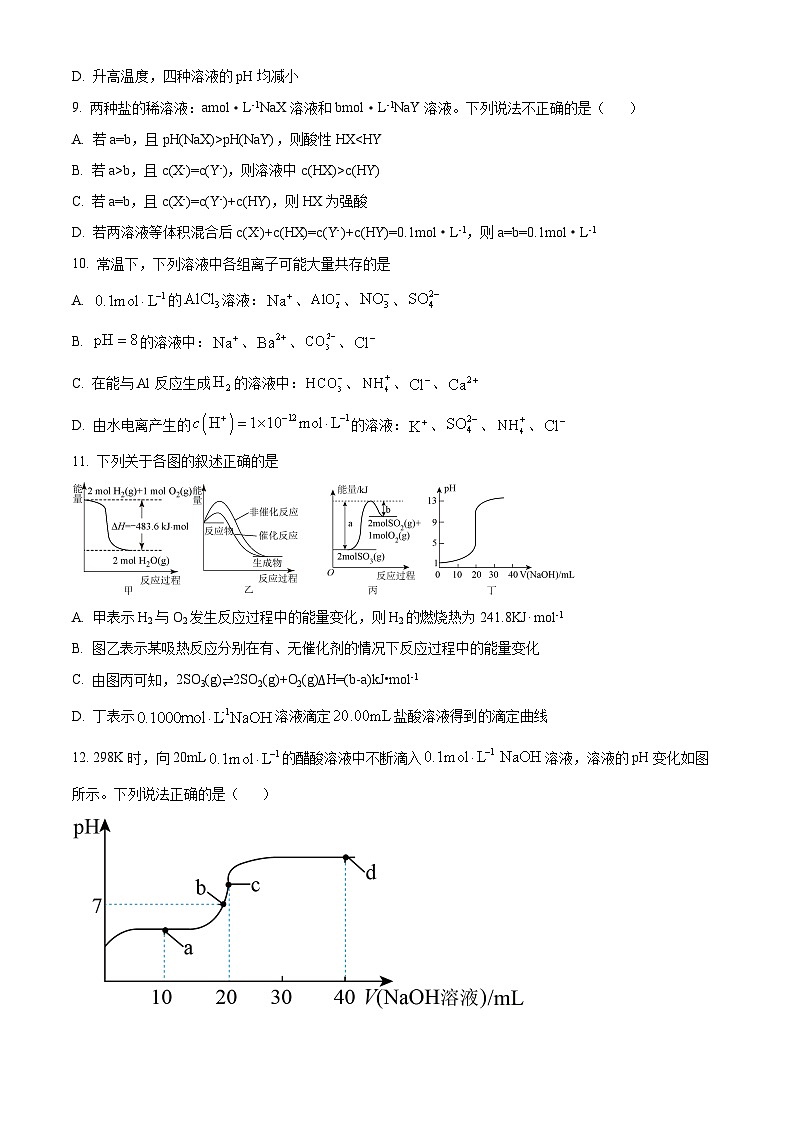
11. 下列关于各图的叙述正确的是
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8KJ· ml-1
B. 图乙表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 由图丙可知,2SO3(g)⇌2SO2(g)+O2(g)∆H=(b-a)kJ•ml-1
D. 丁表示溶液滴定盐酸溶液得到的滴定曲线
【答案】D
【解析】
【分析】
【详解】A.氢气的燃烧热是1ml氢气燃烧生成液态水放出的能量,所以H2的燃烧热不是241.8KJ· ml-1,故A错误;
B.图乙中生成物的总能量小于反应物总能量,图乙表示放热反应,故B错误;
C.由图丙可知,三氧化硫的分解反应吸热,2SO3(g)⇌2SO2(g)+O2(g)∆H=(a-b)kJ•ml-1,故C错误;
D.由图丁可知,盐酸的起始浓度为,溶液滴定的盐酸溶液,恰好反应时消耗氢氧化钠溶液的体积是,故D正确;
选D。
12. 298K时,向20mL的醋酸溶液中不断滴入溶液,溶液的pH变化如图所示。下列说法正确的是( )
A b点溶液中:
B. d点溶液中:
C. 水的电离程度大小关系:b点>c点
D. a点溶液中:
【答案】D
【解析】
【详解】A.b点溶液显中性,则,根据电荷守恒,存在,A项错误;
B.d点溶液中溶质为NaOH和,且,溶液呈碱性,醋酸根离子水解,所以溶液中离子浓度大小顺序是,B项错误;
C.b点醋酸过量,抑制了水的电离,c点为醋酸钠溶液,水解促进水的电离,故水的电离程度:c点>b点,C项错误;
D.a点溶液中的溶质为等物质的量的和,溶液呈酸性,所以,且醋酸的电离程度大于的水解程度,故溶液中粒子浓度大小顺序是,D项正确;
答案选D。
13. 25℃,下列叙述正确的是
A. 0.1 ml·L-1氨水中,c(OH-)=c(NH)
B. 10 mL 0.02 ml·L-1 HCl溶液与10 mL 0.02 ml·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C. 0.1 ml·L-1的NaHCO3(aq)中: c (CO)+c (OH-)=c (H2CO3)+c (H+)
D. 0.1 ml·L-1某二元弱酸酸式盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
【答案】C
【解析】
【详解】A.根据电荷守恒:在氨水中c(OH-)=c(NH)+ c(H+),故A错误;
B.酸碱混合后碱过量,过量的c(OH-)=,所以c(H+)=10-12ml/L,所以pH=12,故B错误;
C.0.1 ml·L-1的NaHCO3(aq)中根据质子守恒:c(CO)+c(OH-)=c(H2CO3)+c(H+),故C正确;
D.根据物料守恒0.1 ml·L-1某二元弱酸酸式盐NaHA溶液中,c(Na+)=c(A2-)+c(HA-)+c(H2A),故D错误;
故选C。
14. 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
A. P3>P4,y轴表示B的转化率
B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度
D. P3<P4,y轴表示混合气体的平均摩尔质量
【答案】A
【解析】
【分析】图Ⅰ中对比a、b可知,P2>P1,增大压强,C%升高,说明平衡正向移动,故x=1;对比b、c可知,T1>T2,降低温度,C%升高,说明平衡正向移动,故正反应为放热反应,即升温和降压均可使反应向逆反应方向移动。
【详解】A.由分析可知,该反应是气体分子数减小的反应,也是放热反应;若y轴表示B的转化率,同一压强下,升高温度,平衡逆向移动,B的转化率降低;同一温度下,增大压强,平衡正向移动,B的转化率升高,则P3>P4,A正确;
B.由分析可知,该反应是放热反应;若y轴表示B的体积分数,同一压强下,升高温度,平衡逆向移动,B的体积分数升高,B错误;
C.若y轴表示混合气体的密度,在恒容容器内,体系的密度始终不变,C错误;
D.由分析可知,该反应是气体分子数减小的反应,也是放热反应;若y轴表示混合气体的平均摩尔质量;同一压强下,升高温度,平衡逆向移动,混合气体的平均摩尔质量降低;同一温度下,增大压强,平衡正向移动,混合气体的平均摩尔质量增大,则P3>P4,D错误;
故选A。
二、填空题(共4小题)
15. 酸碱滴定和氧化还原滴定是常见的两种滴定方法。
I.氧化还原滴定:化学兴趣小组欲准确测定某市售双氧水中的含量:取双氧水至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为。
(1)滴定时,将高锰酸钾标准溶液注入___________(填“酸”或“碱”)式滴定管中。
(2)滴定到达终点的现象是___________。
(3)根据实验测得,消耗溶液,那么的浓度为___________。
Ⅱ.酸碱中和滴定:常温下,用溶液分别滴定等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(4)滴定盐酸的曲线是图___________(填“1”或“2”)。
(5)滴定前的电离度为___________。[电离度×100%]
(6)达到B、D状态时,反应消耗的溶液的体积图1___________(填“>”“ ②.
【解析】
【小问1详解】
高锰酸钾标准液具有强氧化性,所以只能使用酸式滴定管。
【小问2详解】
滴定反应是高锰酸钾与过氧化氢反应,过氧化氢将高锰酸钾还原为锰离子,紫红色的高锰酸钾溶液会变无色,当恰好完全反应时再滴入半滴,溶液会显浅紫红色,所以滴定到达终点的现象是滴入最后半滴高锰酸钾溶液,溶液呈浅紫红色,且30秒内不褪色。
【小问3详解】
根据反应方程式进行计算,的浓度为。
【小问4详解】
等浓度的盐酸和醋酸溶液,由于醋酸是弱酸不完全电离,所以溶液中的氢离子浓度盐酸大于醋酸,初始pH盐酸小于醋酸,图1的初始pH小于图2的初始pH,所以滴定盐酸的曲线是图1。
【小问5详解】
滴定前盐酸的pH=1,所以盐酸溶液的浓度为0.1ml/L,由于盐酸和醋酸的浓度相等,所以醋酸溶液的浓度也为0.1ml/L;滴定前醋酸溶液的pH为3,所以溶液中氢离子浓度为10-3ml/L,所以醋酸的电离度为
【小问6详解】
达到B、D状态时,溶液呈中性,氯化钠不水解,醋酸钠水解使溶液呈碱性,若要溶液呈中性,则溶液中留有一部分醋酸分子,所以反应消耗的氢氧化钠溶液的体积图1>图2。
当时,恰好达到滴定终点,E点溶质为醋酸钠,由于醋酸根会发生水解而使溶液呈碱性,水解方程式为:。
16. 合成氨的反应对人类解决粮食问题贡献巨大。合成氨反应的化学方程式为N2(g)+3H2(g)2NH3(g),回答下列问题:
(1)已知键能:H-H436kJ•ml-1,N-H391kJ•ml-1,N≡N946kJ•ml-1。则N2(g)+3H2(g)2NH3(g)反应中生成17gNH3_____(填“吸收”或“放出”)_____kJ热量。
(2)恒温下,将amlN2与bmlH2的混合气体通入2L的恒容密闭容器中,进行合成氨反应,当反应进行到5s时,有0.1mlNH3生成。
①0~5s内用H2表示该反应的平均反应速率v(H2)=_____ml•L-1•s-1。
②实验测得反应进行到t时刻时,nt(N2)=3ml,nt(H2)=8ml,nt(NH3)=6ml,则a=_____,b=_____。
③再经一段时间后反应达到平衡,此时混合气体总物质的量为13ml,则平衡时NH3的物质的量为_____ml。
④下列可以说明该反应达到平衡状态的是_____(填标号)。
A.c(N2):c(NH3)=1:2 B.3v正(H2)=2v逆(NH3)
C.容器内气体的密度不再变化 D.混合气体的压强不再变化
⑤若在不同条件下进行上述反应,测得反应速率分别为
Ⅰ.v(N2)=0.3ml•L-1•min-1
Ⅱ.v(H2)=0.4ml•L-1•min-1
Ⅲ.n(NH3)=0.5ml•L-1•min-1
其中反应速率最慢的是_____(填标号)。
【答案】(1) ①. 放出 ②. 46
(2) ①. 0.015 ②. 6 ③. 17 ④. 10 ⑤. D ⑥. II
【解析】
小问1详解】
断键吸收的总能量-成键放出的总能量 ,的物质的量为1ml,对应,故反应中生成17gNH3放出46kJ热量;
故答案为:放出;46;
【小问2详解】
①由题干信息可知,,故;
故答案为:0.015;
②实验测得反应进行到t时刻时,nt(NH3)=6ml,根据化学反应方程式可知,消耗n(NH3)=,消耗的n(H2)=,故a=3ml+3ml=6ml,b=9ml+8ml=17ml;
故答案为:6;17;
③设此时反应的氮气的物质的量为x,则有,,解得x=5,故平衡时NH3的物质的量为;
故答案为:10;
④A.c(N2):c(NH3)=1:2,正逆反应速率不一定相等,不一定处于化学平衡状态,A错误;
B.当2v正(H2)=3v逆(NH3),说明该反应达到平衡状态,B错误;
C.由题干信息可知,总质量不变,体积不变,故密度一直不变,容器内气体的密度不再变化,不能说明该反应达到平衡状态,C错误;
D.因反应前后是体积可变反应,故混合气体的压强不再变化,说明该反应达到平衡状态,D正确;
故答案为:D;
⑤Ⅰ.v(N2)=0.3ml⋅L−1⋅min−1相当于v(H2)=ml⋅L−1⋅min−1,Ⅲ.v(NH3)=0.5ml⋅L−1⋅min−1相当于v(H2)=ml⋅L−1⋅min−1,故其中反应速率最慢的是Ⅱ;
故答案为:Ⅱ。
17. 盐类水解在实验室和生产生活中有广泛的应用。
I.25℃时,和两溶液的pH均为11。
(1)两溶液中,由水电离的分别是:溶液中___________;溶液中___________。
(2)各取上述两种溶液,分别加水稀释到,pH变化较大的是___________(填化学式)溶液。
(3)为探究纯碱溶液呈碱性是由引起的,请你设计一个简单的实验方案___________。
Ⅱ.现有25℃时的氨水溶液。
(4)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________;所得溶液的pH___________(填“”或“=”)7,用离子方程式表示其原因:___________。
(5)若向该氨水中加入稀硫酸至溶液的,此时,则___________。
(6)现有浓度均为的氢氧化钠和氯化铵溶液,按体积比混合后的溶液中各离子的浓度由大到小的顺序是___________。
(7)的水溶液呈___________(填“酸”“中”或“碱”)性,原因是___________(用离子方程式表示);实验室在配制的溶液时,常将固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需浓度,目的是___________。
(8)净水的原理是(用离子方程式表示)___________。
(9)泡沫灭火器内装有饱和溶液和溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为___________。
(10)已知草酸是二元弱酸,常温下测得的的pH为4.8,则溶液中___________(填>,
相关试卷
这是一份湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题(原卷版+解析版),文件包含精品解析湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题原卷版docx、精品解析湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
这是一份广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题(原卷版+解析版),文件包含精品解析广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题原卷版docx、精品解析广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
这是一份广西希望高中2023-2024学年高二上学期11月期中化学试题(原卷版+解析版),文件包含精品解析广西希望高中2023-2024学年高二上学期11月期中化学试题原卷版docx、精品解析广西希望高中2023-2024学年高二上学期11月期中化学试题解析版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。








