




所属成套资源:【高考二轮】2023年高考化学二轮复习高频考点必刷1000题(广东专用)
最新高考化学总复习高频考点必刷1000题 必练12 反应机理、化学反应速率与化学平衡40题(广东专用)
展开
这是一份最新高考化学总复习高频考点必刷1000题 必练12 反应机理、化学反应速率与化学平衡40题(广东专用),文件包含必练12反应机理化学反应速率与化学平衡40题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练12反应机理化学反应速率与化学平衡40题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共55页, 欢迎下载使用。
第一,用什么资料,怎样使用资料;第二,在那些核心考点上有所突破,准备采取什么样的措施;第三,用时多长,怎样合理分配。
2、怎样查漏。
第一,教师根据一轮复习的基本情况做出预判;第二,通过检测的方式了解学情。
3、怎样补缺。
第一,指导学生针对核心考点构建本专题的知识网络,归纳本专题的基本题型和解题思路;
第二,结合学情教师要上好核心考点的讲授课;
第三,针对学生在检测或考试当中出现的问题,教师要做好系统性讲评;
第四,根据学生存在的问题进行跟踪性训练;
第五,教育学生在对待错题上一定要做到:错题重做,区别对待,就地正法。
第六,抓好“四练”。练基本考点,练解题技巧,练解题速度,练答题规范。
【尖子生创造营】2023年高考化学总复习高频考点必刷1000题(广东专用)
必练12 反应机理、化学反应速率与化学平衡40题
【化学反应机理】
1.(2022·广东高考真题)在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
【答案】D
【解析】
A.由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;
B.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;
C.由图可知,使用催化剂II时,在0~2min 内Y的浓度变化了2.0ml/L,而a曲线表示的X的浓度变化了2.0ml/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了4.0ml/L,则(Y) ===2.0,(X) =(Y) =2.0=1.0,故D正确;
答案选D。
2. (2021·广东高考真题) 反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A. a为随t的变化曲线B. 时,
C. 时,的消耗速率大于生成速率D. 后,
【答案】D
【解析】由题中信息可知,反应经历两步:①;②。因此,图中呈不断减小趋势的a线为X的浓度随时间的变化曲线,呈不断增加趋势的线为Z的浓度随时间的变化曲线,先增加后减小的线为Y的浓度随时间的变化曲线。
【详解】A.X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,由图可知,为随的变化曲线,A正确;
B.由图可知,分别代表3种不同物质的曲线相交于时刻,因此,时,B正确;
C.由图中信息可知,时刻以后,Y的浓度仍在不断减小,说明时刻反应两步仍在向正反应方向发生,而且反应①生成Y的速率小于反应②消耗Y的速率,即时的消耗速率大于生成速率,C正确;
D.由图可知,时刻反应①完成,X完全转化为Y,若无反应②发生,则,由于反应②的发生,时刻Y浓度的变化量为,变化量之比等于化学计量数之比,所以Z的浓度的变化量为,这种关系在后仍成立, 因此,D不正确。
综上所述,本题选D。
3. (2022东莞市上学期期末考试)BASF高压法采用CH3OH和CO制备醋酸的循环过程如图所示,下列说法错误的是
A. HI在流程中起催化作用
B. 循环过程需不断补充CO和甲醇
C. 循环总过程不涉及氧化还原反应
D. 反应总方程式:CH3OH+CO→CH3COOH
【答案】C
【解析】
A.催化剂往往会参与反应的过程,但是在反应前后其质量和性质保持不变,结合图中信息可知,HI参与了反应转化为碘甲烷,但碘甲烷又可以转化为HI,故其为催化剂,A正确;
B.该循环的总反应方程式为CO+CH3OH→CH3COOH,故此循环中CH3OH、CO是反应物,需要不断补充,B正确;
C.由总反应方程式为CO+CH3OH→CH3COOH可知,碳元素化合价发生变化,故涉及氧化还原反应,C错误;
D.该循环的总反应方程式为CO+CH3OH→CH3COOH,D正确;
故选C。
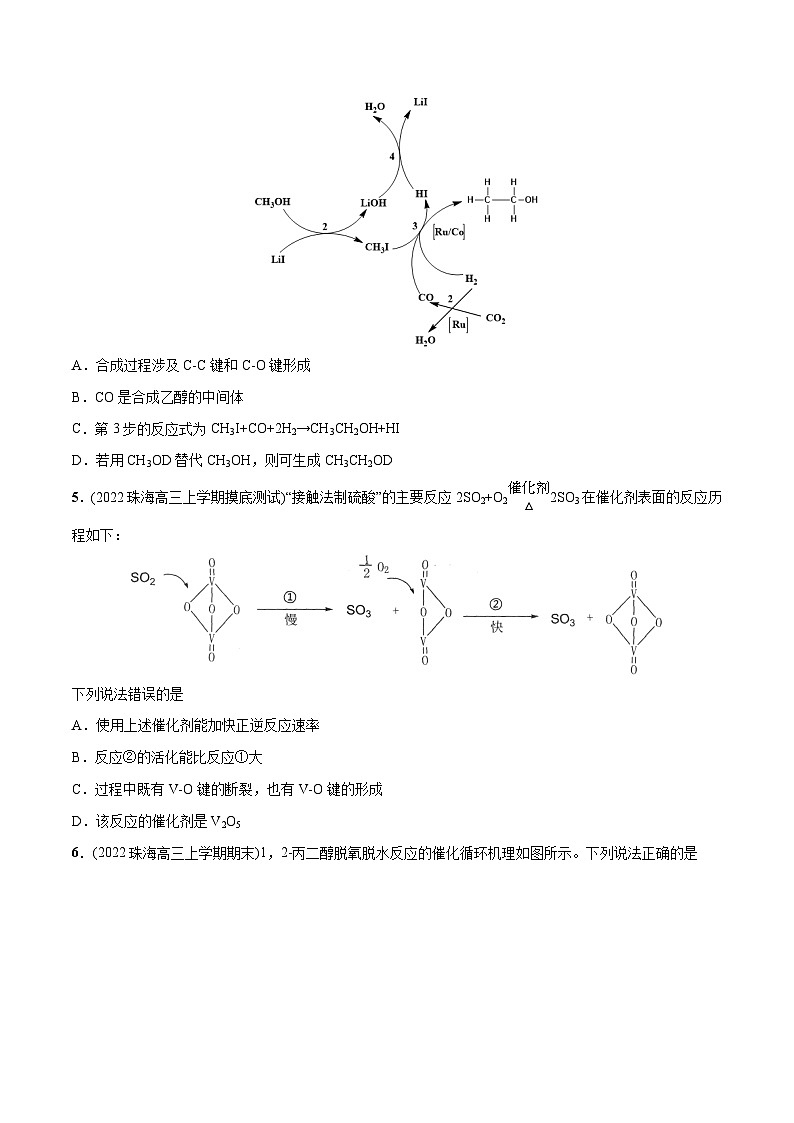
4.(2022佛山一模)利用CH3OH、CO2与H2合成CH3CH2OH的反应主要历程如图所示。下列说法错误的是
A.合成过程涉及C-C键和C-O键形成
B.CO是合成乙醇的中间体
C.第3步的反应式为CH3I+CO+2H2→CH3CH2OH+HI
D.若用CH3OD替代CH3OH,则可生成CH3CH2OD
【答案】D
【解析】
A.根据图示可知:在反应3中有C-C键和C-O键形成,A正确;
B.根据图示可知:在反应开始时无CO,在反应结束时生成物中无CO,因此CO是合成乙醇的中间体,B正确;
C.根据图示可知第3步反应的反应物是CH3I、CO、H2,生成物是CH3CH2OH及HI,则该反应的化学方程式为:CH3I+CO+2H2→CH3CH2OH+HI,C正确;
D.根据反应3可知反应产生乙醇中的-OH上H原子种类取决于H2中的H原子的种类,而与CH3OH上的H原子种类无关,所以若用CH3OD替代CH3OH,生成的乙醇仍然是CH3CH2OH ,而不会是CH3CH2OD,D错误;
故合理选项是D。
5.(2022珠海高三上学期摸底测试)“接触法制硫酸”的主要反应2SO2+O2eq \(,\s\up7(催化剂) ,\s\d5(△))2SO3在催化剂表面的反应历程如下:
下列说法错误的是
A.使用上述催化剂能加快正逆反应速率
B.反应②的活化能比反应①大
C.过程中既有V-O键的断裂,也有V-O键的形成
D.该反应的催化剂是V2O5
【答案】B
【解析】
A.催化剂能同等程度加快正逆反应速率,故A正确;
B.活化能越大反应越慢,反应②的活化能比反应①小,故B错误;
C.反应①有V-O键的断裂,反应②有V-O键的形成,故C正确;
D.根据图示, V2O5是该反应的催化剂,故D正确;
故选B。
6.(2022珠海高三上学期期末)1,2-丙二醇脱氧脱水反应的催化循环机理如图所示。下列说法正确的是
A.过程①②均有键断裂,过程③④均有键断裂
B.丙烯与HBr发生加成反应只得到一种产物
C.该过程中催化剂通过增大反应的活化能来提高化学反应速率
D.该过程的化学方程式为2
【答案】D
【解析】
A.由循环机理图可知过程④中断裂O-M,形成碳碳双键,不存在C-C的断裂,故A错误;
B.丙烯为不对称烯烃,与溴化氢加成可能得到1-溴丙烷或2-溴丙烷,故B错误;
C.催化剂通过降低反应的活化能来提高化学反应速率,故C错误;
D.由循环机理图可知最终生成物有HCHO、CH3CHO、CH3CH=CH2和水,MO3为催化剂,反应正确,故D正确;
故选:D。
7.(2022潮州高三上学期期末)我国科研人员通过控制光沉积的方法构建Cu2O-Pt/SiC/IrOx型复合材料光催化剂,其中Fe2+和Fe3+离子渗透Nafin膜可协同CO2、H2O分别反应,构建了一个人工光合作用体系,其反应机理如图,下列说法错误的是
A.该反应为2CO2+2H2O2HCOOH+O2
B.该反应能量转化形式为光能→化学能
C.图中a、b分别代表Fe2+、Fe3+
D.转化HCOOH的路径中,CO2被氧化为HCOOH
【答案】D
【解析】
A.根据图示可知,反应物为二氧化碳和水,生成物为甲酸和氧气,因此该反应方程式为2CO2+2H2O2HCOOH+O2,故A正确;
B.由“人工光合作用体系”可知,该反应能量转化形式为光能→化学能,故B正确;
C.观察图中物质转化关系可知,b代表Fe3+,用于氧化H2O,a代表Fe2+,用于还原CO2,故C正确;
D.转化HCOOH的路径中,CO2被还原为HCOOH,故D错误;
答案选D。
8. (2022佛山二模) 催化某清洁反应是获得甲苯的常用途径,反应机理如图所示。下列说法错误的是
A. 若R为,则X为乙醇 B. 是催化剂、还原剂
C. 反应过程存在键的断裂和形成 D. 活性炭可以负载高分散的,提高催化剂活性
【答案】C
【解析】A.由历程可知,反应物为氢气、 ,生成物为X和甲苯,若R为,则在反应 中乙基-Pd、H-Pd键断裂得到Pd,同时H与乙基结合得到乙醇,故X为乙醇,A正确;B.在整个反应历程中Pd参与反应历程后又生成Pd,在反应前后本身没有改变,是整个反应的催化剂,在反应过程中,Pd化合价由0升为+2价,也是还原剂,B正确;C.反应过程不存在键的断裂,在 生成乙醇的过程中也不存在键的形成,C错误;D.活性炭可以负载高分散的,增加与反应物的接触面积,提高催化剂活性,D正确;
答案选C。
9. (2022广州二模)硫化氢的转化是资源利用的研究课题。将H2S和空气的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化历程如图所示。下列说法正确的是
A. 历程①发生反应H2S+Cu2+=CuS↓+2H+
B. 历程②中CuS作氧化剂
C. 历程③中n(Fe2+):n(O2)=1:4
D. 转化的总反应为H2S=H2+S
【答案】A
【解析】
A.根据图示可知历程①是Cu2+与H2S气体发生复分解反应产生CuS黑色沉淀和H+,根据电荷守恒及物质的拆分原则,可知发生的该反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,A正确;
B.在历程②中,CuS与Fe3+发生氧化还原反应,产生S、Cu2+、Fe2+,该反应的方程式为:CuS+2Fe3+=S+Cu2++2Fe2+,S元素化合价升高,失去电子被氧化,作还原剂;Fe元素化合价降低,得到电子被还原,Fe3+作氧化剂,B错误;
C.在历程③中,Fe2+与O2发生氧化还原反应,产生Fe3+、H2O,根据氧化还原反应过程中电子转移守恒可知:n(Fe2+):n(O2)=4:1,C正确;
D.根据流程图可知总反应方程式为:2H2S+O2=2S↓+2H2O,D错误;
故合理选项是A。
10. (2022广州一模)炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是
A. 可减少CO2的排放
B. Fe3O4和CaO均可循环利用
C. 过程①和④的转化均为氧化还原反应
D. 过程①的反应中有非极性键的断裂和生成
【答案】D
【解析】
A.反应②利用二氧化碳、和氧化钙反应生成碳酸钙,第④步中二氧化碳与铁生成四氧化三铁和CO,可减少CO2的排放, A正确;
B.根据反应过程可知Fe3O4和CaO均可循环利用,①中消耗Fe3O4,④中生成Fe3O4,②中消耗CaO,③中生成CaO,B正确;
C.过程①中CO转化为CO2,④中CO2转化为CO,均有化合价的变化,故转化均为氧化还原反应,C正确;
D.过程①的反应为CO与Fe3O4反应,生成CO2,CO极性键断裂,CO2非极性键生成,没有非极性键的断裂,D错误;
答案选D。
11. (2022华附、省实、广雅、深中四校联考)中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理如图所示。下列说法不正确的是
A. 上述合成氨的过程属于氮的固定B. 该过程中,LDH降低了反应的活化能
C. 该过程有极性键、非极性键的断裂和生成D. 高温高压的条件有利于提高氨的产率
【答案】D
【解析】
A.由图可知,发生反应为2N2+6H2O=4NH3+3O2,因此合成氨的过程属于氮的固定,故A正确;
B.催化剂可降低反应的活化能,加快反应速率,故B正确;
C.发生反应为2N2+6H2O=4NH3+3O2,反应物和生成物中均存在单质和化合物,即该过程有极性键、非极性键的断裂和生成,故C正确;
D.常温常压水为液态,正反应是气体体积增大的反应,所以高压的条件不利于提高氨的产率,故D错误;
故选D。
12.(2022惠州一模)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
A.总反应为N2O(g)+CO(g)=CO2(g)+N2(g) ΔH=ΔH1+ΔH2
B.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O
C.该反应正反应的活化能小于逆反应的活化能
D.总反应的ΔH=-226 kJ·ml-1
【答案】B
【解析】
A.根据图甲,①
②
根据盖斯定律①+②得N2O(g)+CO(g)=CO2(g)+N2(g) ΔH=ΔH1+ΔH2,故A正确;
B.总反应为N2O(g)+CO(g)=CO2(g)+N2(g),不需向反应器中补充Pt2O+和Pt2O,故B错误;
C.该反应正反应的活化能为134 kJ·ml-1,逆反应的活化能为360kJ·ml-1,故C正确;
D.根据图乙,总反应的ΔH=(134-360) kJ·ml-1=-226 kJ·ml-1,故D正确;
故选B。
13. (2022江门一模)常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力(吸附时会放出热量),并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法正确的是
A.物质b分子有三种官能团
B.该过程中有非极性共价键的断裂
C.升温将有利于CO2的吸附
D.该材料的吸附作用具有选择性,利用此法利于“碳达峰”目标的实现
【答案】D
【解析】
A.物质b只含有一种官能团酯基,选项A错误;
B.该过程中有C-O键的断裂,C=O的断裂,但没有非极性共价键的断裂,选项B错误;
C.吸附时会放出热量,即反应为放热反应,升高温度平衡向放热反应的方向移动,不利于CO2的吸附,选项C错误;
D.MOFA对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷反应生成b,所以利用此法可减少CO2的排放,利于“碳达峰”目标的实现,选项D正确;
答案选D。
14.(2022梅州二模))固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示,下列说法正确的是
A.反应①②③均为氧化还原反应
B.转化过程中所涉及的元素均呈现了两种价态
C.Li3N、LiOH两种化合物中含有的化学键完全相同
D.假设每一步均完全转化,每消耗1 ml N2,同时生成1.5 ml O2
【答案】D
【解析】
A.反应②是Li3N+3H2O=3LiOH+NH3,属于非氧化还原反应,故A错误;
B.转化过程中,H元素只显+1价,故B错误;
C.Li3N中只含离子键,LiOH中含有离子键、共价键,故C错误;
D.假设每一步均完全转化,根据电子守恒,每消耗1 ml N2 ,同时生成1.5 ml O2,故D正确;
故选D。
15.(2022清远市高三上学期期末)科学家研究二甲醚(DME)在分子筛(用表示)上的水解反应,其反应进程中能量变化如图所示。下列说法错误的是
A.根据反应图示可知,在相同的催化剂作用下,化学反应也存在多种反应途径
B.升高温度,stepwise路径和cncerted路径的反应速率都加快,有利于提高反应物的转化率
C.由于,DME水解反应更易以stepwise路径进行
D.根据图示可知,DME首先与分子筛结合形成
【答案】C
【解析】
A.根据反应图示可知,分子筛上,二甲醚的水解反应有stepwise路径和cncerted路径,故A正确;
B.升高温度,stepwise路径和cncerted路径的反应速率都加快,正反应吸热,升高温度,平衡正向移动,有利于提高反应物的转化率,故B正确;
C.对于stepwise路径,为,为,决定stepwise路径反应速率的步骤为第一步,而,故反应更易以cncerted路径进行,故C错误;
D.根据图示可知,DME首先与分子筛结合形成,故D正确;
故选C。
16.(2022汕头市高三下学期第一次模拟考试)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法不正确的是
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该历程中反应速率最慢的一步:
D.该催化循环中Fe元素的化合价发生了变化
【答案】D
【解析】
A.根据反应进程图像可知,甲酸在催化剂的作用下,分解成CO2和H2,即该过程中的总反应为HCOOHCO2↑+H2↑,故A说法正确;
B.根据反应机理图可知,甲酸电离产生H+和HCOO-,HCOO-参与反应,与催化剂结合放出二氧化碳,若H+浓度过大,抑制甲酸的电离,使c(HCOO-)降低,反应速率减慢,若H+浓度降低,反应Ⅲ→Ⅳ速率减慢,故B说法正确;
C.活化能越大,反应速率越慢,根据反应进程图像可知,,活化能最大,反应速率最慢,故C说法正确;
D.虽然铁连接的原子数和种类发生了改变,但是配离子的电荷数没变,因此Fe元素化合价不变,故D说法错误;
答案为D。
17.(2022韶关市高三上学期综合测试)为了减少CO2的排放,可利用含铈(Ce)催化剂实现CO2与甲醇反应,该反应的催化循环原理如图所示,有关说法正确的是
A.该反应的催化剂为Ce-O-Ce-OH
B.反应②的类型为取代反应
C.物质A为CO2
D.反应过程中Ce的化合价发生了变化
【答案】A
【解析】
分析图像可知物质A为CH3OH,物质B为CO2;反应②为加成反应;反应过程中Ce的化合价没有发生变化,将3步反应加和可得总反应为CO2+2CH3OH→H2O+O═C(OCH3)2。
【详解】
A. 反应①A+Ce-O-Ce-OH→H2O+Ce-O-Ce-OCH3,②Ce-O-Ce-OCH3+B→,③+A→Ce-O-Ce-OH+,由①③③可得总反应:CO2+2CH3OH→H2O+O=C(OCH3)2,该反应的催化剂为Ce-O-Ce-OH,故A正确;
B. 根据反应②,Ce-O-Ce-OCH3+B→,根据原子守恒和反应的结构特点,可知物质B为CO2,反应②为加成反应,故B错误;
C. 根据反应①,A+Ce-O-Ce-OH→H2O+Ce-O-Ce-OCH3,根据元素原子守恒和结构,可知物质A为CH3OH,故C错误;
D. 根据物质Ce-O-Ce-OH、Ce-O-Ce-OCH3、,反应过程中Ce的化合价没有发生变化,故D错误;
故选A。
18. (2022深圳一模)气相离子催化剂(Fe+、C+、Mn+等)具有优良的催化效果。其中,在Fe+催化下乙烷氧化反应的机理如图所示(图中---为副反应)。下列说法正确的是
A. FeO+、N2均为反应中间体
B. X既含极性共价键也含非极性共价键
C. 该机理涉及的反应均为氧化还原反应
D. 每生成1mlCH3CHO,消耗N2O的物质的量大于2ml
【答案】D
【解析】
A.FeO+先生成后消耗,是反应中间体,N2由N2O转化得到,是产物,A错误;
B.由原子守恒可知XH2O,O与H形成极性共价键,B错误;
C.该机理中C2H6+FeO+=[(C2H5)Fe(OH)+],该反应无化合价变化,不是氧化还原反应,C错误;
D.该反应总反应方程式为C2H6+2N2O=CH3CHO+2N2+ H2O,由于发生副反应[(C2H5)Fe(OH)+]→Fe+,Fe化合价降低,有电子转移,则每生成1mlCH3CHO,消耗N2O的物质的量大于2ml,D正确;
故选:D。
19.(2022粤港澳大湾区二模)研究表明:MgO基催化剂广泛应用于的转化过程,图是我国科研工作者研究MgO与作用最终生成Mg与的物质相对能量-反应进程曲线。下列说法不正确的是
A.反应中甲烷被氧化
B.中间体比更稳定
C.该反应的速率控制步骤对应的活化能是29.5kJ/ml
D.转化为的焓变为-145.1 kJ/ml
【答案】C
【解析】
A.由图可知,该过程的总反应为,反应过程中CH4中C元素的化合价升高,作还原剂,被氧化,故A正确;
B.能量越低越稳定,由图可知,中间体的能量比更低,则比更稳定,故B正确;
C.该反应的反应速率取决于活化能最大的步骤,由图可知,该反应中活化能最大的步骤是HOMgCH3到过渡态2的步骤,该步骤的活化能为299.8kJ/ml,故C错误;
D.由图可知,转化为的焓变为-149.4kJ/ml-(-4.3kJ/ml)=-145.1 kJ/ml,故D正确;
答案选C。
20. 苯与的催化反应历程如图所示。关于该反应历程,下列说法正确的是
A. 苯与的催化反应为放热反应
B. 该反应历程,苯与的催化反应可生成溴苯、邻二溴苯
C. 苯与的催化反应决速步伴随着极性键的断裂与形成
D. 从反应速率角度,苯与Br2的催化反应主反应为取代反应,原因是该反应活化能更低
【答案】D
【解析】
A.由图可知,苯与Br2的加成反应是吸热反应,取代反应是放热反应,故A错误;
B.该反应历程,苯与Br2的催化反应可生成溴苯,但不能生成邻二溴苯,故B错误;
C.由于转化为的活化能最大,反应速率最慢,故是总反应的决速步骤,但步骤中不存在极性键的断裂,故C错误;
D.第三步中取代反应的活化能低,生成物本身所具有的能量低,更稳定,故苯与Br2的催化反应主反应为取代反应,故D正确;
故选D。
21.CH3-CH=CH-COOCH3有两种立体异构体和,由CH3CHO和Ph3P=CHCOOCH3反应制取这两种异构体的历程中能量变化如图
已知:在立体结构中,实线表示该键在纸平面上,实楔形线表示该键在纸前方,虚线表示该键在纸后方。
下列说法正确的是( )
A.比稳定
B.温度升高,CH3CHO的转化率减小
C.生成的过程中,速率最快的是由生成的反应
D.两个反应历程中,中间产物相同
【答案】C
【解析】A.图像中比能量高,稳定,A错误;
B.图像该反应历程中生成两种物质都是吸热反应,温度升高,CH3CHO的转化率增大,B错误。
C.由生成的过程活化能最小,反应速率快,C正确;
D.两个反应历程中,是生成的中间产物,是生成的中间产物,两个过程中间产物不同,D错误;
故选C。
22.反应 的能量与反应历程如下图所示。下列说法正确的是
A. 第1步为决速步骤 B. 第2步为吸热过程
C. 焓变等于第1、3步活化能之差 D. 该反应适宜在强酸性条件下进行
【答案】A
【解析】A.第 1 步反应的正活化能最大,反应速率最慢,第1步决定整个反应的快慢,A 项正确;B.第 2 步为放热过程,B 项错误;C.焓变与活化能大小无关,只与反应物和产物自身能力有关,C 项错误; D.从化学平衡角度考虑,碱性条件下有利于反应的正向移动,强酸性条件下不利于中间体的生成,D 项错误。
故选A。
23. 某种含二价铜的催化剂[CuⅡ(OH)(NH3)]+可用于汽车尾气脱硝。催化机理如图1所示,反应过程中不同态物质体系所具有的能量如图2所示。下列说法正确的是
A. 该脱硝过程总反应的焓变△H>0
B. 由状态①到状态⑤所发生的反应均为氧化还原反应
C. 状态③到状态④的变化过程中有O—H键的形成
D. 总反应的化学方程式为4NH3(g)+2NO(g)+2O2(g)3N2(g)+6H2O(g)
【答案】C
【解析】A.根据图2可知,反应物的总能量大于生成物的总能量,为放热反应,则总反应焓变,A错误;B.由图1可知,状态①到状态②中Cu的化合价没有发生变化,不是氧化还原反应,B错误;
C.状态③到状态④的变化过程为,有O―H键的形成,C正确;D.由图1知,该脱硝过程反应物有:NH3、NO、O2,生成物有H2O、N2,由图1所给数据知,反应物NH3为2ml,NO为2ml,O2为0.5ml,生成物N2为2ml,H2O为3ml,故该脱硝过程总反应的化学方程式为:,化整得:,D错误;
故选:C。
【化学反应速率与化学平衡】
24.(2022·广东高考真题)恒容密闭容器中, BaSO4(s)+4H2(g) ⇌ BaS(s)+4H2O(g) 在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
【答案】C
【详解】
A.从图示可以看出,平衡时升高温度,氢气的物质的量减少,则平衡正向移动,说明该反应的正反应是吸热反应,即ΔH>0,故A错误;
B.从图示可以看出,在恒容密闭容器中,随着温度升高氢气的平衡时的物质的量减少,则平衡随着温度升高正向移动,水蒸气的物质的量增加,而a曲线表示的是物质的量不随温度变化而变化,故B错误;
C.容器体积固定,向容器中充入惰性气体,没有改变各物质的浓度,平衡不移动,故C正确;
D.BaSO4是固体,向平衡体系中加入BaSO4,不能改变其浓度,因此平衡不移动,氢气的转化率不变,故D错误;
故选C。
25.(2022珠海高三上学期摸底测试)碘循环工艺不仅能吸收SO2降低环境污染,又能同时制得氢气,流程如图。下列说法不合理的是
A.膜反应器中HI在500℃可以完全分解为H2和I2
B.H2、I2、H2O2都含有非极性键
C.分离器中的物质分离的操作为蒸馏
D.反应器中控制温度为20℃~100℃,温度过高会使I2升华,减少SO2的吸收
【答案】A
【解析】
A.HI分解是可逆反应,因此膜反应器中HI在500℃部分分解为H2和I2,故A错误;
B.H2、I2、H2O2分别含有H-H、I-I、O-O非极性键,故B正确;
C.分离器中含有硫酸和氢碘酸,两者的沸点不同,因此将分离器中的物质分离的操作为蒸馏,故C正确;
D.由于单质碘易升华,因此反应器中控制温度为20℃~100℃,温度过高会使I2升华,减少SO2的吸收,故D正确。
综上所述,答案为A。
26.(2022珠海高三上学期期末)以天然气为原料合成氨是新的生产氮肥的方法,具有污染小、成本低等诸多特点,其过程如下:
下列说法不正确的是
A.反应②的原子利用率小于100%
B.过程③可以通过物理变化实现
C.过程④采取高温条件的目的是为了提高平衡转化率
D.过程⑤理论上当n(NH3):n(O2)=1:1时,恰好完全反应
【答案】C
【解析】
A.反应②是CO2、NH3在一定条件下条件下反应产生CO(NH2)2、H2O,生成物中不仅有尿素,还有H2O,因此原子利用率小于100%,A正确;
B.过程③是分离空气的成分得到N2、O2,由于没有新物质生成,因此该变化过程是物理变化,B正确;
C.过程④是N2、H2合成NH3,该反应的正反应是气体体积减小的放热反应,反应条件采取高温条件是因为在该温度下催化剂的活性最大,而不能提高物质的平衡转化率,C错误;
D.氨气与氧气反应生成硝酸铵的过程中,根据电子守恒和元素守恒可得总反应为2NH3+2O2NH4NO3+H2O,所以理论上n(NH3):n(O2)=1:1时恰好完全反应,D正确;
故合理选项是C。
27.(2022湛江一模)反应 Si(s)+3HCl(g) ⇌ SiHCl3(g)+H2(g) △H 是工业上制备高纯硅的重要中间过程。一定压强下,起始投入原料的值和温度与的平衡产率的变化关系如图所示。下列说法错误的是
A.该反应为放热反应,B.M、N点的分压:
C.的值越大平衡产率越高D.M、N点的逆反应速率:
【答案】C
【解析】
A.温度升高,的平衡产率减小,说明反应向逆反应方向移动,正反应为放热反应,选项A正确;
B.M点的平衡产率大,其物质的量大、温度高,故分压大,选项B正确;
C.由图可知,的值增大至7时,的平衡产率降低至接近于0,选项C错误;
D.M点温度较高,浓度较大,逆反应速率,选项D正确。
答案选C。
28.(2022潮州高三上学期期末)下列有关热化学方程式N2O4(g) ⇌ 2NO2(g) ΔH=+57 kJ·ml-1说法正确的是
A.升高体系温度正反应速率增大,逆反应速率也增大
B.若容器体积不变,气体密度不变时说明该反应已经达到化学平衡状态
C.温度不变,向平衡后的容器中再加入少量N2O4,平衡常数K值变大
D.增大体系的压强,平衡右移,同时提高N2O4的反应速率和转化率
【答案】A
【解析】
A.升高体系温度,正逆反应活化能均降低,活化分子百分数增大,分子之间有效碰撞次数增加,导致正反应速率增大,逆反应速率也增大,A正确;
B.反应混合物都是气体,气体的质量不变,若容器体积不变,则反应混合物的密度始终不变,因此不能据此判断反应是否达到平衡状态,B错误;
C.化学平衡常数只与温度有关,温度不变,则化学平衡常数K就不变,C错误;
D.增大体系的压强,物质的浓度增大,化学反应速率加快;同时由于该反应的正反应是气体体积增大的反应,增大压强,化学平衡向气体体积减小的逆反应方向移动,导致N2O4的平衡转化率降低,D错误;
故合理选项是A。
29. (2022佛山二模) 一定条件下,将CO2和H2按物质的量为1∶3的投料比充入某刚性密闭容器中,发生反应:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH= - 49.5 kJ·ml-1测得CO2的物质的量浓度随反应时间的变化如图所示,下列说法正确的是
A. 0~5分钟,共放出的热量
B. CO2和H2的转化率相等时,反应达到平衡
C. 时,改变的外界条件可能是降温
D. 平衡常数一定大于
【答案】C
【解析】A.不确定容器的体积,不能确定反应的二氧化碳的物质的量,不能计算反应放出热量数值,不是放出0.4×49.5=19.8kJ热量,A错误;B.反应中CO2和H2按反应的系数比投料,则两者的转化率一直相等,不能用来判断反应是否达到平衡,B错误;C.反应为放热反应,降低温度平衡正向移动,二氧化碳的浓度减小,符合图像,C正确;D.对于确定反应,平衡常数只受温度的影响,不确定是否温度一定改变,故不能判断两者K值的大小,D错误;
故选C。
30. (2022广州二模)物质X能发生如下反应:①X→mY;②X→nZ(m、n均为正整数)。恒容体系中X、Y、Z的浓度c随时间t的变化曲线如图所示,下列说法不正确的是
A. m=n=1
B. t1时,c(X)=c(Y)
C. 反应的活化能:①T2
B.反应速率v(a)=v(b)
C.在T1温度下,反应至t1时达平衡状态
D.在T1温度下,反应在0—t3内的平均速率为
【答案】D
【解析】
A.反应温度T1和T2,以c(NO2)随t变化曲线比较,II比III后达平衡,所以T2>T1,故A错误;
B.升高温度,反应速率加快,T2>T1,则反应速率v(a)>v(b),故B错误;
C.T1温度下,反应至t1时c(NO2)=c(N2O4),t1之后c(NO2)、c(N2O4)仍在变化,说明t1时反应没有达到平衡状态,故C错误;
D.T1时,在0-t3内,,则0-t3内,故D正确;
答案选D。
35.(2022汕头市高三上学期期末质量监测)2021年为我国实现碳达峰、碳中和关键的一年,综合利用的技术不断创新。某实验小组研究和反应得到合成气的原理为:CO2(g)+CH4(g) ⇌ 2CO(g)+2H2(g) 。向体积为1L的密闭容器中充入和,反应过程中的平衡转化率与温度、压强的关系如图所示。下列有关说法正确的是。
A.该反应的
B.压强:
C.1100℃时,该反应的平衡常数为12.96
D.反应达到平衡后在容器内再充入和,此时的转化率会增大
【答案】C
【解析】
A.由题干图示可知,压强相同时,温度升高,CO2的转化率增大,说明升高温度平衡正向移动,故该反应的,A错误;
B.由题干图示可知,温度相同时,p2压强下CO2的转化率更大,结合反应方程式可知,增大压强,化学平衡逆向移动,CO2的转化率减小,故压强:,B错误;
C.1100℃时,根据三段式分析可知,,该反应的平衡常数为K===12.96,C正确;
D.反应达到平衡后在容器内再充入和,相当于对容器增大压强,化学平衡逆向移动,故此时的转化率会减小,D错误;
故答案为:C。
36.(2022深圳二模)T1℃时,向1L密闭容器中充入10mlH2和3mlSO2发生反应:3H2(g)+SO2(g)⇌H2S(g)+2H2O(g) △H
相关试卷
这是一份最新高考化学总复习高频考点必刷1000题 必练13 微观探析与离子反应30题(广东专用),文件包含必练13微观探析与离子反应30题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练13微观探析与离子反应30题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份最新高考化学总复习高频考点必刷1000题 必练04 化学与劳动教育20题(广东专用),文件包含必练04化学与劳动教育20题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练04化学与劳动教育20题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份最新高考化学总复习高频考点必刷1000题 必练03 化学与生产生活30题(广东专用),文件包含必练03化学与生产生活30题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练03化学与生产生活30题尖子生创造营2023年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。









