



所属成套资源:高考化学一轮复习【夯实基础】复习精讲精练
第37讲 弱电解质的电离平衡 -备战2023年高考化学【一轮·夯实基础】复习精讲精练
展开这是一份第37讲 弱电解质的电离平衡 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第37讲弱电解质的电离平衡原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第37讲弱电解质的电离平衡解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共73页, 欢迎下载使用。
【复习目标】
1.理解弱电解质在水溶液中的电离平衡。
2.理解电离平衡常数,掌握电离平衡常数的相关计算。
3.能举例说明离子反应与平衡在生产、生活中的应用。
【知识精讲】
考点一 弱电解质的电离平衡及影响因素
1.强、弱电解质
(1)强电解质:在水溶液或熔融状态下能全部电离的电解质。包括以下几种:
(2)弱电解质:在水溶液或熔融状态下部分电离的电解质。包括以下几种:
(3)电离方程式的书写
①强电解质:“强等号”,如H2SO4的电离方程式为H2SO4===2H++SOeq \\al(2-,4)。
②弱电解质:“弱可逆”
a.一元弱酸,如CH3COOH的电离方程式为CH3COOHCH3COO-+H+。
b.一元弱碱,如NH3·H2O的电离方程式为NH3·H2ONHeq \\al(+,4)+OH-。
c.多元弱酸,分步电离,分步书写,如H2CO3的电离方程式为
H2CO3H++HCOeq \\al(-,3)、HCOeq \\al(-,3)H++COeq \\al(2-,3)。
d.多元弱碱,分步电离,一步书写,如Fe(OH)3的电离方程式为Fe(OH)3Fe3++3OH-。
e.两性物质双向电离,如Al(OH)3的电离方程式为
H++AlOeq \\al(-,2)+H2OAl(OH)3Al3++3OH-。
③酸式盐
a.强酸的酸式盐,如NaHSO4
在水溶液中的电离方程式为NaHSO4===Na++H++SOeq \\al(2-,4);
熔融状态下的电离方程式为NaHSO4===Na++HSOeq \\al(-,4)。
b.弱酸的酸式盐,如NaHCO3的电离方程式为
NaHCO3===Na++HCOeq \\al(-,3),HCOeq \\al(-,3)H++COeq \\al(2-,3)。
2.电离平衡的概念
在一定条件下(如温度、压强等),当弱电解质电离的速率和离子结合成分子的速率相等时,电离过程达到平衡状态。
3.电离平衡的建立与特征
(1)开始时,v(电离)最大,而v(结合)为eq \a\vs4\al(0)。
(2)平衡的建立过程中,v(电离)eq \a\vs4\al(>)v(结合)。
(3)当v(电离)eq \a\vs4\al(=)v(结合)时,电离过程达到平衡状态。
4.电离平衡的影响因素
①内因:电解质本身的性质决定了其电离程度的大小。
②外因:
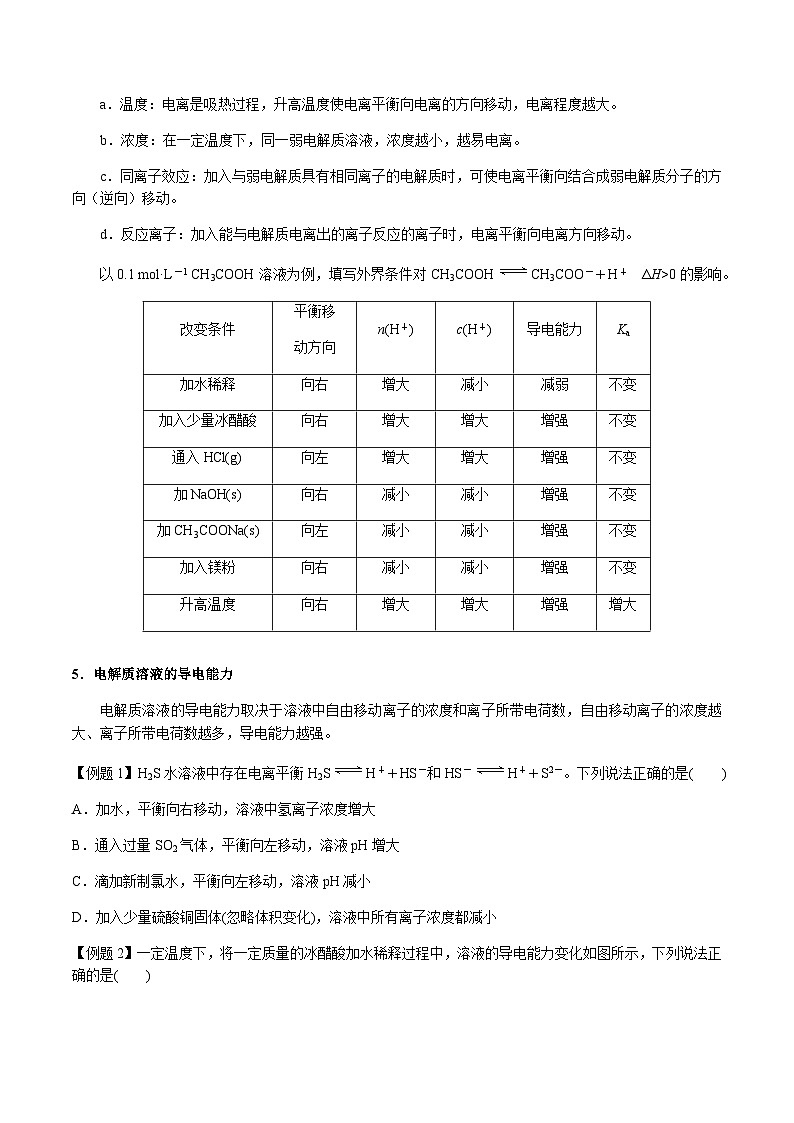
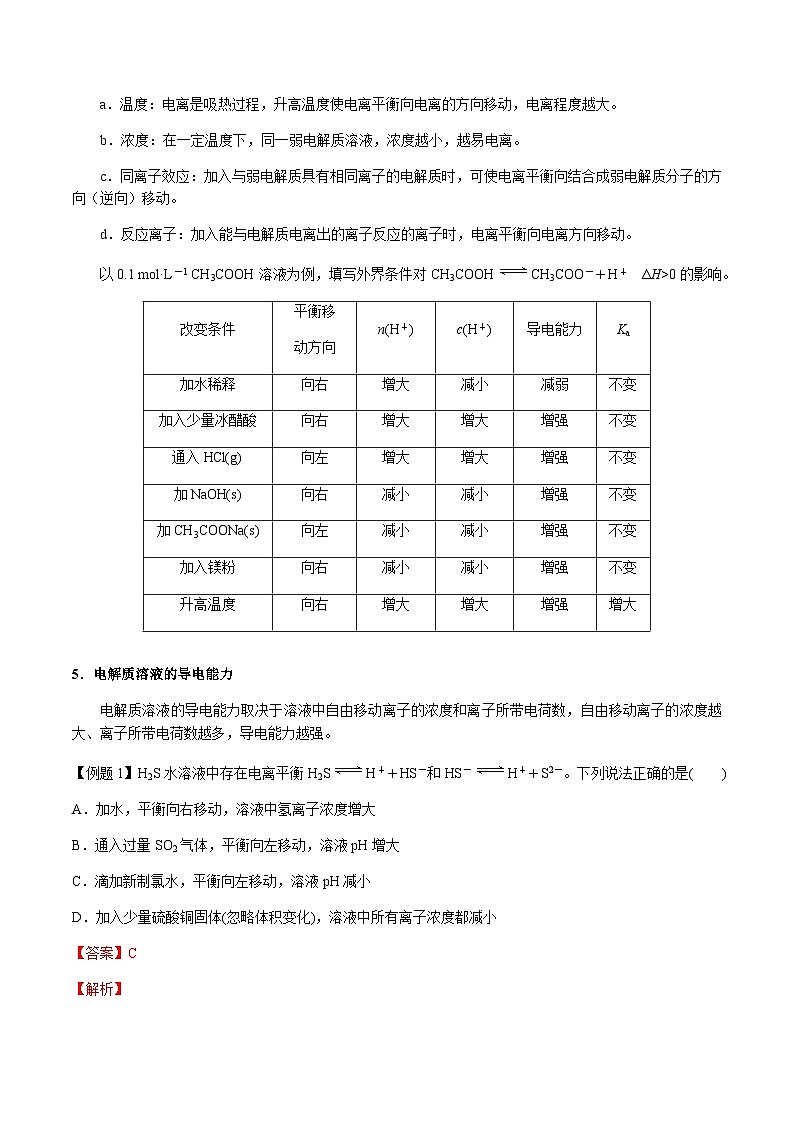
a.温度:电离是吸热过程,升高温度使电离平衡向电离的方向移动,电离程度越大。
b.浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
c.同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向(逆向)移动。
d.反应离子:加入能与电解质电离出的离子反应的离子时,电离平衡向电离方向移动。
以0.1 ml·L-1 CH3COOH溶液为例,填写外界条件对CH3COOHCH3COO-+H+ ΔH>0的影响。
5.电解质溶液的导电能力
电解质溶液的导电能力取决于溶液中自由移动离子的浓度和离子所带电荷数,自由移动离子的浓度越大、离子所带电荷数越多,导电能力越强。
【例题1】H2S水溶液中存在电离平衡H2SH++HS-和HS-H++S2-。下列说法正确的是( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
【例题2】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点CH3COOH的电离程度:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1 ml·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
【例题3】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,
回答下列问题:
(1)a、b、c三点溶液的pH大小顺序________(用a、b、c回答,下同)
(2)a、b、c三点,CH3COOH的电离程度________。
(3)a、b、c三点溶液用1 ml·L-1 NaOH溶液中和,消耗NaOH溶液的体积________。
考点二 电离平衡常数及应用
1.概念:
一定条件下,当一元弱电解质达到电离平衡时,溶液中弱电解质电离所生成的各离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,简称电离常数。
2.表达式
(1)对于一元弱酸HA:HAH++A-,电离平衡常数Ka=eq \f(c(H+)·c(A-),c(HA ))。
(2)对于一元弱碱BOH:BOHB++OH-,电离平衡常数Kb=eq \f(c(B+)·c(OH-),c(BOH))。
3.特点
(1)电离平衡常数与温度有关,与浓度无关,升高温度,K值增大。
(2)电离平衡常数反映弱电解质电离程度的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。
eq \x(K越大)→eq \x(越易电离)→eq \x(酸(碱)性越强)
(3)多元弱酸的各级电离常数的大小关系是K1≫K2≫K3……,故其酸性取决于第一步电离。
4.电离平衡常数的四大应用
(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(4)判断粒子浓度或浓度比值的变化
利用温度不变电离常数就不变来判断溶液中粒子浓度或者比值的变化情况,有时候还会结合Kw一起进行判断,如:
向0.1 ml·L-1 CH3COOH溶液中加水稀释,eq \f(c(CH3COO-),c(CH3COOH))=eq \f(c(CH3COO-)·c(H+),c(CH3COOH)·c(H+))=eq \f(Ka,c(H+)),加水稀释,c(H+)减小,Ka值不变,则eq \f(c(CH3COO-),c(CH3COOH))增大。
5.电离度
(1)概念
在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质分子总数的百分比。
(2)表示方法
α=eq \f(已电离的弱电解质分子数,溶液中原有弱电解质的总分子数)×100%,也可表示为
α=eq \f(一元弱电解质的某离子浓度,弱电解质的初始浓度)×100%
(3)影响因素
①相同温度下,同一弱电解质,浓度越大,其电离度(α)越小。
②相同浓度下,同一弱电解质,温度越高,其电离度(α)越大。
(4)电离度(α)与电离平衡常数(Ka、Kb)之间的关系
①一元弱酸(以CH3COOH为例)
设常温下,浓度为c ml·L-1的醋酸的电离度为α
CH3COOHCH3COO-+H+
起始(ml·L-1) c 0 0
转化(ml·L-1) c·α c·α c·α
平衡(ml·L-1) c-cα≈c c·α c·α
Ka=eq \f(cα·cα,c)=cα2、α=eq \r(\f(Ka,c)),c(H+)=cα=eq \r(Ka·c)。
②一元弱碱(如NH3·H2O,电离常数为Kb)
同理可得:Kb=cα2,c(OH-)=cα=eq \r(Kb·c)。
6.关于电离平衡常数的计算(以弱酸HX为例)
HX H+ + X-
eq \a\vs4\al(起始/,(ml·L-1)) c(HX) 0 0
eq \a\vs4\al(平衡/,(ml·L-1)) c(HX)-c(H+) c(H+) c(H+)
则Ka=eq \f(c(H+)·c(X-),c(HX)) =eq \f(c2(H+),c(HX)-c(H+))。
(1)已知c(HX)和c(H+),求电离平衡常数
由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则Ka=eq \f(c2(H+),c(HX)),代入数值求解即可。
(2)已知c(HX)和电离平衡常数,求c(H+)
由于K值很小,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=eq \r(Ka·c(HX)) ,代入数值求解即可。
【例题4】正误判断(正确的打“√”,错误的打“×”)
(1)H2CO3的电离常数表达式:Ka=eq \f(c2(H+)·c(COeq \\al(2-,3)),c(H2CO3))。( )
(2)弱电解质的电离平衡右移,电离平衡常数一定增大。( )
(3)电离平衡常数大的酸溶液中的c(H+)一定比电离平衡常数小的酸溶液中的c(H+)大。( )
(4)向CH3COOH溶液中滴加相同浓度的氨水,eq \f(c(NHeq \\al(+,4)),c(NH3·H2O))先增大再减小。( )
(5)某一弱电解质,电离度越大,电离常数就越大。( )
【例题5】已知数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2===HCN+NaNO2
②NaCN+HF===HCN+NaF
③NaNO2+HF===HNO2+NaF
由此可判断下列叙述中不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
【例题6】已知室温时,0.1 ml·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
【例题7】部分弱酸的电离平衡常数如下表:
按要求回答下列问题:
(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为___________________。
(2)同浓度的HCOO-、HS-、S2-、HCOeq \\al(-,3)、COeq \\al(2-,3)、ClO-结合H+的能力由强到弱的顺序为_________。
考点三 一元强酸(碱)与一元弱酸(碱)的比较
1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较
(1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较
(2)相同pH、相同体积的盐酸与醋酸溶液的比较
2.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
(2)相同体积、相同pH值的盐酸、醋酸
3.判断强酸、强碱的方法
证明室温下某酸(HA)是弱酸:
常见设计思路:
【例题8】相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
【例题9】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4,现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
A.曲线Ⅱ为氢氟酸稀释时pH变化曲线
B.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C.b点溶液中水的电离程度比c点溶液中水的电离程度小
D.从b点到d点,溶液中eq \f(c(R-),c(HR)·c(OH-))保持不变(HR代表HClO或HF)
【例题10】浓度均为0.10 ml·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lgeq \f(V,V0)的变化如图所示。下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:a点大于b点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lgeq \f(V,V0)=2时,若两溶液同时升高温度,则eq \f(cM+,cR+)增大
【例题11】在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是___________(用字母表示,下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是_________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是______________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________________。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________________,反应所需时间的长短关系是________________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是______。
(7)将c(H+)相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为________。
【真题演练】
1.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
2.(2022·湖北·高考真题)根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。
已知:,,下列酸性强弱顺序正确的是( )
A.B.
C.D.
3.(2022·湖北·高考真题)
下图是亚砷酸和酒石酸混合体系中部分物种的图(浓度:总为,总T为)。下列说法错误的是( )
A.的为
B.的酸性比的强
C.时,的浓度比的高
D.时,溶液中浓度最高的物种为
4.(2022·辽宁·高考真题)下列符号表征或说法正确的是( )
A.电离:B.位于元素周期表p区
C.空间结构:平面三角形D.电子式:
5.(2022·浙江·高考真题)下列物质属于强电解质的是( )
A.B.C.D.
【答案】C
6.(2022·浙江·高考真题)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
7.(2021·浙江·高考真题)下列物质属于弱电解质的是( )
A.CO2B.H2OC.HNO3D.NaOH
8.(2021·浙江·高考真题)下列物质属于强电解质的是( )
A.KOHB.H3PO4C.SO3D.CH3CHO
9.(2020·海南·高考真题)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是( )
A.该酸-lgKa ≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH= 7.0时,c(HA)
10.(2020·北京·高考真题)室温下,对于1L0.1ml•L-1醋酸溶液。下列判断正确的是( )
A.该溶液中CH3COO-的粒子数为6.02×1022
B.加入少量CH3COONa固体后,溶液的pH降低
C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1ml
D.醋酸与Na2CO3溶液反应的离子方程式为CO+2H+=H2O+CO2↑
11.(2020·全国·高考真题)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是( )
A.海水酸化能引起浓度增大、浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.CO2能引起海水酸化,其原理为H++
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
12.(2020·全国·高考真题)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为___________。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为____________________________________。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为_____ml;产生“气泡”的化学方程式为____________________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______________________________________(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____________kg(保留整数)。
【课后精练】
第I卷(选择题)
1.(2022·浙江·马寅初中学高三阶段练习)下列物质属于强电解质的是( )
A.Ca(OH) 2B.CuC.盐酸D.CH4
2.(2022·河南省叶县高级中学阶段练习)铬酸()可用于镀铬、制颜料,也可用于某些釉和彩色玻璃的生产。常温下,下列事实能说明是弱电解质的是( )
A.易溶于水
B.的溶液pH>2
C.发生电离:
D.用物质的量浓度相同的NaCl溶液和溶液进行导电性实验,比较灯泡的亮度
3.(2022·江苏南京·开学考试)根据下列实验操作和现象所得出的结论正确的是( )
A.AB.BC.CD.D
4.(2022·河南濮阳·期末)常温下,pH均为2、体积均为V0的HA、 HB、HC三种酸溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( )
A.常温下:Ka(HB)> Ka(HA)
B.水的电离程度:b点
5.(2022·福建泉期末)用如图装置分别进行导电性实验,使小灯泡明显变暗的实验操作是( )
A.向溶液中加入适量固体
B.向饱和溶液中滴加适量溶液
C.向溶液中加入适量固体
D.向稀溶液中加入适量固体
6.(2022·浙江·瑞安中学高二开学考试)相同温度下,三种酸在一定物质的量浓度下的电离度如下表所示,下列正确的是( )
A.HD是强酸
B.该温度下Ka:HB
D.由表可知在相同温度下,弱酸HB浓度越小其电离平衡常数越大
7.(2022·安徽亳州期末)下列说法错误的是( )
A.加热蒸干溶液并灼烧可得到
B.向水中加入金属钠,能促进水的电离,冷却至室温后,保持不变
C.某些单质可与水反应同时生成强电解质和弱电解质
D.弱电解质溶液的导电性肯定弱于强电解质溶液的导电性
8.(2022·天津市咸水沽第一中学高三开学考试)已知酸性,下列有关叙述中正确的是( )
①向溶液中通入少量二氧化碳的离子反应方程式为
②向和混合溶液中加入足量溶液,用萃取后,取上层中的液体少许并加入溶液,有淡黄色沉淀生成
③向溶液中滴加少量氯水,反应的离子方程式为
④“84”消毒液(有效成分)和“洁厕灵”(主要成分盐酸)混合使用时放出氯气,其离子方程式为
⑤在海带灰的浸出液(含有)中滴加得到,其离子方程式为
A.②④B.①③⑤C.②③D.①④⑤
9.(2022·河北省博野中学期中)下列事实能说明醋酸是弱电解质的是:( )
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1 ml·L-1醋酸的pH比0.1 ml·L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥0.1 ml·L-1醋酸钠溶液pH=8.9
⑦大小相同的锌粒和相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦B.③④⑥⑦C.③④⑤⑥D.①②
10.(2022·河北省博野中学期中)下表中物质的分类组合正确的是( )
A.AB.BC.CD.D
11.(福建省泉州市2023届高三毕业班8月质量监测)25℃时,用0.1 ml/L NaOH溶液分别滴定20 mL浓度均为0.1 ml/L的HCl、CH3COOH,所加NaOH溶液的体积与反应后溶液pH的关系如图所示。现用0.1 ml/L NaOH溶液滴定20 mL浓度均为0.1 ml/L的HCl和CH3COOH的混合酸溶液,下列叙述正确的是( )
A.CH3COOH的电离常数Ka约为
B.滴定混合酸至pH=4.4时,仅发生反应:HCl+NaOH=NaCl+H2O
C.滴定混合酸至pH=7时,
D.滴定混合酸至pH=8.2时,
12.(2022·浙江·马寅初中学高三阶段练习)
25℃时H2S的Ka1(H2S)=9×10-8,Ka2(H2S)=1.1×10-12。下列说法正确的是( )
A.相同温度下,Na2S溶液pH值大于NaHS溶液
B.某温度下,将pH=6的H2S溶液稀释100倍,pH可能为8
C.25℃时,等浓度Na2S和NaHS混合溶液,水电离出的氢离子浓度为1.1×10-12ml/L
D.往H2S溶液中滴入NaOH溶液的过程中,一直减小
13.(2022·内蒙古·海拉尔第二中学模拟预测)已知甘氨酸在水中存在三种微粒,它们的转化关系如下:
pI 为该溶液中−COO−和H3−数目相等时的pH,K1和 K2分别表示:−COOH 和H3−的解离常数,K1=10−2.4,K2=10−9.4。其各微粒在水中的分布系数(各微粒数目占三种微粒总数的百分比)如图所示。下列判断错误的是:( )
A.a点对应的 pH=2.4
B.pH=4 时,c(A±)>c(A-)>c(A+)
C.甘氨酸溶液的 pI=6
D.甘氨酸溶于水后溶液显酸性
14.(2022·福建龙岩期末)将的醋酸溶液温度升高10℃。下列说法不正确的是( )
A.增大
B.水的离子积常数增大
C.的电离程度增大
D.溶液中存在:
15.(2022·全国课时练习)表中数据是几种弱酸常温下的电离平衡常数:
下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释溶液,减小
D.向弱酸溶液中加少量溶液,恢复到常温,该弱酸的电离平衡常数不变
16.(2022·河南·高三阶段练习)乙二胺[H2N(CH2 )2NH2 ]是一种二元弱碱,在水中的电离方式与氨相似。25℃时,用 HCl调节0.10ml·L-1乙二胺溶液的pH,溶液中含氮物种的分布系数(δ)与pH的关系如图所示(如乙二胺的分布系数δ[ H2N(CH2)2NH2]= )。下列说法错误的是( )
A.乙二胺第一步电离的方程式为H2N(CH2)2NH2+ H2O⇌H2N(CH2)2NH+ OH-
B.曲线L3表示δ[H2N(CH2)2NH2]与pH的关系
C.Q点对应溶液的pH=8.39
D.M、N点溶液中c(Cl- )相等
第II卷(非选择题)
17.(2022·河南省叶县高级中学阶段练习)25℃下,溶液加水稀释,所得体积为V的溶液的pH随变化关系如图所示,结合表中给出的电离常数(25℃下)回答下列问题:
(1)25℃时,在的溶液中,由水电离出的浓度为_______。
(2)的电离常数约为______________,、、三种酸的酸性由强到弱的顺序为______________。
(3)图中b_______(填“>”“<”或“=”)1。
(4)下列操作能使上述醋酸溶液中减小的是_______(填字母)。
A.降低温度B.加水稀释
C.加少量的固体D.加少量冰醋酸
(5)的高铼酸()与pH=13的NaOH溶液等体积混合,所得溶液呈中性。体积相同的高铼酸和醋酸溶液的pH均为2,若将两溶液稀释100倍,则pH变化较大的是_______。
18.(2022·福建泉州期末)已知:25℃时,、、。
(1)常温下,将pH和体积均相同的和溶液分别稀释,溶液pH随加水体积的变化如图:
①曲线I代表___________溶液(填“”或“”)。
②a、b两点对应的溶液中,水的电离程度a___________b(填“”、“”或“”)。
③向上述溶液和溶液分别滴加等浓度的溶液,当恰好中和时,消耗溶液体积分别为和,则___________ (填“”、“”或“”)。
④酸度()也可表示溶液的酸碱性,。。常温下,的硝酸溶液___________。
(2)25℃时,往溶液中加入溶液。
①当,生成,水解的离子方程式为_______________________________________。
②当,溶液显___________性(填“酸”、“碱”或“中”),原因是________________________________(结合数据计算说明)。
③等浓度等体积的、混合,溶液中___________。
19.(2022·江西省万载中学阶段练习)通常用Ka表示弱酸的电离平衡常数,请回答下列问题:
(1)已知亚磷酸(H3PO3)为二元弱酸,常温下Ka1=1.6×10-2,Ka2=7×10-7。
①Na2HPO3属于___________(填“正盐”或“酸式盐”)。
②已知常温下Ka(CH3COOH)=1.8×10-5,写出亚磷酸溶液与醋酸钠溶液反应的离子方程式________________________________。
(2)常温下,取0.3ml∙L-1HY溶液与0.3ml∙L-1NaOH溶液等体积混合不计混合后溶液体积变化,测得混合溶液pH=9
①c(OH-)-c(HY)=____________ ml∙L-1
②常温下HY的电离平衡常数Ka=___________。
(3)电解法制取有广泛用途的Na2FeO4,工作原理如图所示。
①a极为___________极。
②Ni极为___________极。
③左侧的电极反应式为___________。
④右侧的电极反应式为___________。
20.(2022·四川·雅安中学阶段练习)硫酸、盐酸、醋酸、碳酸、氨水及其盐是生活中常见的物质。
(1)等浓度的五种溶液①(NH4)2CO3、②NH4Cl、③NH4HSO4、④CH3COONH4、⑤NH3·H2O,则c()由大到小排列的顺序为_________ (用序号比较)。
(2)25°C时,浓度均为0.1ml·L-1的盐酸和醋酸溶液,下列说法正确的是 。
A.两溶液的pH相同
B.两溶液的导电能力相同
C.两溶液中由水电离出的c(OH-)相同
D.中和等物质的量的NaOH,消耗两溶液的体积相同
(3)25°C时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是_________。
(4)①常温下,pH=5的NaHSO4溶液中水的电离程度______pH=9的NH3·H2O中水的电离程度(填“>”“=”或“<”);
②等体积等物质的量浓度的NaHSO4与氨水混合后溶液呈___________性 (填“酸、中、碱”),针对该混合溶液下列说法正确的是_________ (填选项代号)。
A.c()+c(H+)=c()+c(OH- )
B.c(Na+)=c(H+)+c()
C.c()=c()+c(NH3·H2O)
③常温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+ )+c()______2c() (填“>”“=”或“<”);
④常温下,向100mL0.2ml·L-1NaHSO4溶液加入0.2ml·L-1Ba(OH)2溶液,则恰好完全沉淀时溶液的pH=________。
21.(2022·广东·东莞四中高三阶段练习)
I.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈_______(填“酸”、“碱”或“中”)性,其原因是___________________________________(用离子方程式表示)。
(2)常温下,浓度均为0.1 ml∙L−1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是_______(填序号)。
(3)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为__________________________________________。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg∙L−1。处理含镉废水可采用化学沉淀法。Ksp(CdCO3)=4.0×10−12,Ksp(CdS)=8.0×10−27;回答下列问题:
(4)向废水中加入Na2S除镉后,当S2−浓度达到8.0×10−8 ml∙L−1时,废水中Cd2+的浓度为_______ml∙L−1,此时是否符合生活饮用水卫生标准?_______(填“是”或“否”)。
(5)室温下,反应CdCO3(s)+S2−(aq)⇌CdS(s)+(aq)达到平衡,该反应的平衡常数K=_______。
22.(2022·福建·莆田华侨中学期中)25 ℃时,三种酸的电离平衡常数如下:
(1)下列四种离子结合H+的能力由大到小的顺序是_______(填编号)
a.CO b.ClO- c.CH3COO- d.HCO
(2)下列反应不能发生的是:_______(填编号)
a.CO+ CH3COOH=CH3COO-+ CO2↑+ H2 O
b.ClO-+ CH3COOH=CH3COO-+ HClO
c.CO+ HClO=HCO+ ClO-
d.2ClO- + CO2 + H2O=CO+ 2HClO
(3)用蒸馏水稀释0.10 ml·L-1 的醋酸,则下列各式表示的数值随水量的增加而增大 的是_______(填编号)
A.B.C.D.
(4)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 ml·L-1 Ba(OH)2 溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
①原混合溶液中c(H+)=_______;c(Cl-)=_______
②A点的pH=_______。
(5)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是_______。
(6)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va_______Vb(填“>”、“<”或“=”)
改变条件
平衡移
动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
向右
增大
减小
减弱
不变
加入少量冰醋酸
向右
增大
增大
增强
不变
通入HCl(g)
向左
增大
增大
增强
不变
加NaOH(s)
向右
减小
减小
增强
不变
加CH3COONa(s)
向左
减小
减小
增强
不变
加入镁粉
向右
减小
减小
增强
不变
升高温度
向右
增大
增大
增强
增大
弱酸
HCOOH
H2S
H2CO3
HClO
电离平衡常数(25 ℃)
Ka=1.77×10-4
Ka1=1.3×10-7
Ka2=7.1×10-15
Ka1=4.4×10-7
Ka2=4.7×10-11
Ka=3.0×10-8
比较
项目
酸
c(H+)
pH
中和碱的能力
与活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
大
小
相同
相同
大
醋酸溶液
小
大
小
比较
项目
酸
c(H+)
c(酸)
中和碱的能力
与足量活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
相同
小
小
少
相同
醋酸溶液
大
大
多
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
加水稀释相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
实验方法
结论
①测0.01 ml·L-1 HA溶液的pH
pH=2,HA为强酸
pH>2,HA为弱酸
②测NaA溶液的pH
pH=7,HA为强酸
pH>7,HA为弱酸
③相同条件下,测相同浓度的HA和HCl(强酸)溶液的导电能力
若HA溶液的导电能力比HCl(强酸)溶液的弱,则HA为弱酸
④测相同pH的HA溶液与盐酸稀释相同倍数前后的pH变化
若HA溶液的pH变化较小,则HA为弱酸
⑤测等体积、等pH的HA溶液、盐酸分别与足量锌反应产生H2的快慢及H2的量
若HA溶液反应过程中产生H2较快且最终产生H2的量较多,则HA为弱酸
⑥测等体积、等pH的HA溶液和盐酸中和等浓度碱溶液所需消耗的碱的量
若HA溶液耗碱量大,则HA为弱酸
选项
实验操作和现象
结论
A
相同条件下,分别测量0.1ml/L和0.01ml/L醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
常温下,分别测定浓度均为0.1ml/LNaF和NaClO溶液的pH,后者的pH大
酸性:HF
KNO3和KOH的混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色
NO被还原为NH3
D
CuS的悬浊液中加入饱和MnSO4溶液可生成浅红色沉淀(MnS为浅红色)
Ksp(MnS)
HA
HB
HD
浓度/ml∙L-1
1
0.1
0.5
0.9
1
电离度/%
0.3
0.3
0.15
0.1
10
选项
A
B
C
D
强电解质
Al2(SO4)3
BaSO4
HClO
KCl
弱电解质
CH3COOH
H2O
CaCO3
Al(OH)3
非电解质
CO2
NH3·H2O
NH3
HI
弱酸
HClO
电离常数
物质
CH3COOH
NH3∙H2O
HCN
HClO
H2CO3
H2SO3
电离常数(Ka)
1.7×10−5
1.7×10−5
4.9×10−10
3×10−8
Ka1=4.3×10−7
Ka2=5.6×10−11
Ka1=1.5×10−2
Ka2=1.0×10−7
化学式
CH3 COOH
H2 CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
相关试卷
这是一份第36讲 等效平衡及其应用 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第36讲等效平衡及其应用原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第36讲等效平衡及其应用解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
这是一份第29讲 原电池、化学电源 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第29讲原电池化学电源原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第29讲原电池化学电源解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共90页, 欢迎下载使用。
这是一份第28讲 化学能与热能 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第28讲化学能与热能原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第28讲化学能与热能解析版-备战2023年高考化学一轮·夯实基础复习精讲精练售后微信403032929docx等2份试卷配套教学资源,其中试卷共89页, 欢迎下载使用。












