


所属成套资源:高考化学一轮复习【夯实基础】复习精讲精练
第38讲 水的电离和溶液的pH -备战2023年高考化学【一轮·夯实基础】复习精讲精练
展开
这是一份第38讲 水的电离和溶液的pH -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第38讲水的电离和溶液的pH原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第38讲水的电离和溶液的pH解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
【复习目标】
1.了解水的电离、离子积常数(Kw)。
2.能进行溶液pH的简单计算,能正确测定溶液的pH。
3.能调控溶液的酸碱性,能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
【知识精讲】
考点一 水的电离与水的离子积常数
1.水的电离方程式
(1)水是极弱的电解质,能发生微弱的电离,其电离方程式为H2O+H2OH3O++OH-,可简写为H2OH++OH-,水的电离常数K电离=eq \f(c(H+)·c(OH-),c(H2O))。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7ml·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
2.水的离子积常数
当水的电离达到电离平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数。
(1)室温下:Kw=c(H+)·c(OH-)=1×10-14。
(2)影响因素:只与温度有关,升高温度,Kw增大。
(3)适用范围:Kw不仅适用于纯水,也适用于稀的电解质水溶液。
(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
3.影响水电离平衡的因素
填写外界条件对H2OH++OH- ΔH>0的具体影响
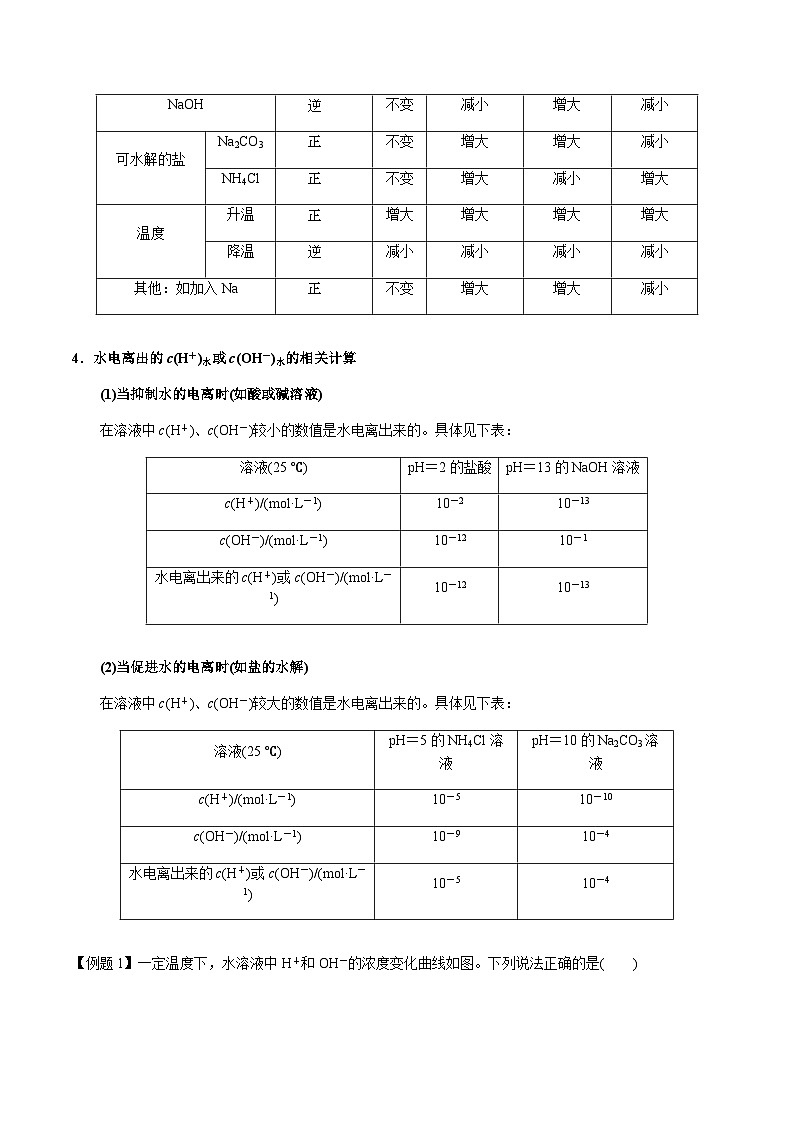
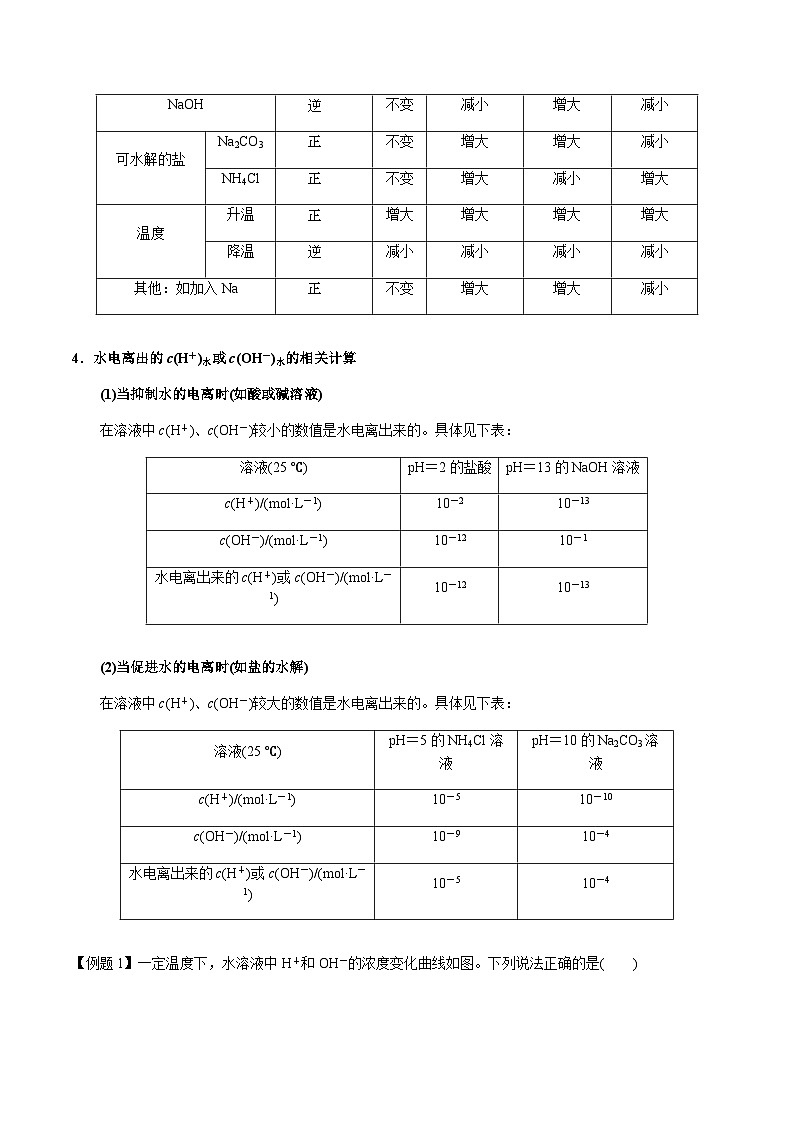
4.水电离出的c(H+)水或c(OH-)水的相关计算
(1)当抑制水的电离时(如酸或碱溶液)
在溶液中c(H+)、c(OH-)较小的数值是水电离出来的。具体见下表:
(2)当促进水的电离时(如盐的水解)
在溶液中c(H+)、c(OH-)较大的数值是水电离出来的。具体见下表:
【例题1】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
【例题2】室温下,pH=11的某溶液中水电离出的c(OH-)为( )
①1.0×10-7 ml·L-1 ②1.0×10-6 ml·L-1 ③1.0×10-3 ml·L-1 ④1.0×10-11 ml·L-1
A.③ B.④
C.①或③ D.③或④
【例题3】25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 ml·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)
C.1∶20∶1010∶109D.1∶10∶104∶109
【例题4】室温下,计算下列溶液中水电离出的。
(1)0.01 ml·L-1的盐酸中,=___________________________________。
(2)pH=4的亚硫酸溶液中, =___________________________________。
(3)pH=10的KOH溶液中,=___________________________________。
(4)pH=4的NH4Cl溶液中,=__________________________________。
(5)pH=10的CH3COONa溶液中,=______________________________。
考点二 溶液的酸碱性和pH
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
2.pH及其测量
(1)pH
①定义:c(H+)的负对数,pH=-lg_c(H+)。
②意义:pH越大,溶液的碱性越强,pH越小,溶液的酸性越强。
③适用范围:1×10-14 ml·L-1≤c(H+)≤1 ml·L-1的溶液。
(2)溶液的酸碱性与pH的关系(常温下)
(3)测量方法
①酸碱指示剂法
该法只能测其pH的大致范围,常见指示剂变色范围如下表:
②pH试纸法
用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照。
③pH计测定
通过仪器来精确测定溶液的pH。
3.溶液pH的计算
溶液pH计算的一般思维模型
(1)单一溶液的pH计算
强酸溶液:如HnA,设浓度为c ml·L-1,c(H+)=nc ml·L-1,pH=-lg c(H+)=-lg(nc)。
强碱溶液(25 ℃):如B(OH)n,设浓度为c ml·L-1,c(H+)=eq \f(10-14,nc) ml·L-1,pH=-lg c(H+)=14+lg(nc)。
(2)混合溶液pH的计算类型
①两种强酸混合:先求出c混(H+),再根据c混(H+)求pH。
c混(H+)=eq \f(c1(H+)V1+c2(H+)V2,V1+V2)。
②两种强碱混合:先求出c混(OH-),再根据Kw求出c混(H+),最后求pH。
c混(OH-)=eq \f(c1(OH-)V1+c2(OH-)V2,V1+V2)。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。
c混(H+)或c混(OH-)=eq \f(|c酸(H+)V酸-c碱(OH-)V碱|,V酸+V碱)。
(3)酸、碱溶液稀释时pH的变化
【例题5】常温下,关于溶液稀释的下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 ml·L-1
C.将1 L 0.1 ml·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
【例题6】计算常温时下列溶液的pH (忽略溶液混合时体积的变化):
(1)pH=2的盐酸与等体积的水混合,溶液的pH=________;
(2)pH=2的盐酸加水稀释到1 000倍,溶液的pH=________;
(3)0.1 ml·L-1的CH3COOH溶液(已知CH3COOH的电离常数K=1.8×10-5)的pH=________;
(4)0.1 ml·L-1 NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=eq \f(已电离的弱电解质浓度,弱电解质的初始浓度)×100%)的pH=________;
(5)常温下,将0.1 ml·L-1氢氧化钠溶液与0.06 ml·L-1硫酸溶液等体积混合,溶液的pH=________。
【例题7】在某温度时,测得0.01 ml·L-1NaOH溶液的pH为11。
(1)该温度下水的离子积常数Kw=________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=________。
【真题演练】
1.(2022·全国·高考真题)常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中,当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中
B.溶液Ⅱ中的HA的电离度为
C.溶液Ⅰ和Ⅱ中的不相等
D.溶液Ⅰ和Ⅱ中的之比为
2.(2022·浙江·高考真题)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是( )
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl(0.1ml·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
3.(2021·福建·高考真题)如图为某实验测得溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是( )
A.a点溶液的比c点溶液的小
B.a点时,
C.b点溶液中,
D.ab段,pH减小说明升温抑制了的水解
4.(2021·浙江·高考真题)某同学拟用计测定溶液以探究某酸HR是否为弱电解质。下列说法正确的是( )
A.25℃时,若测得溶液,则HR是弱酸
B.25℃时,若测得溶液且,则HR是弱酸
C.25℃时,若测得HR溶液,取该溶液,加蒸馏水稀释至,测得,则HR是弱酸
D.25℃时,若测得NaR溶液,取该溶液,升温至50℃,测得,,则HR是弱酸
5.(2021·浙江·高考真题)25℃时,下列说法正确的是( )
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 ml·L-1、0.10ml·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5ml
6.(2020·浙江·高考真题)下列说法不正确的是( )
A.的盐酸中
B.将溶液从常温加热至,溶液的变小但仍保持中性
C.常温下,溶液呈碱性,说明是弱电解质
D.常温下,为3的醋酸溶液中加入醋酸钠固体,溶液增大
7.(2020·浙江·高考真题)下列说法不正确的是( )
A.的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、溶液,所需的物质的量相同
C.相同温度下,pH相等的盐酸、溶液中,相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则
【课后精练】
第I卷(选择题)
1.(2022·上海市北虹高级中学期末)下列措施使得水的电离:H2OH++OH-正向移动的是( )
A.滴加盐酸B.加入 NaOH 固体
C.加热D.加水
2.(2021·重庆市天星桥中学阶段练习)下列有关pH=11的氨水和pH=11的碳酸钠溶液中水的电离程度的比较正确的是( )
A.前者大于后者B.前者等于后者C.前者小于后者D.无法确定
3.(2022·全国课时练习)某温度下,向一定体积的溶液中逐滴加入等浓度的溶液,溶液[]与的变化关系如图所示。下列说法正确的是( )
A.点,则点所示溶液呈酸性
B.该温度下水的离子积
C.点所示溶液呈中性,则、、三点中只有点溶液中水电离出的与水电离出的相等
D.点所示溶液中
4.(2022·新疆喀什·高三期末)下列关于弱电解质的电离平衡说法正确的是( )
A.CH3COOH溶液中存在电离平衡,而盐酸中不存在电离平衡
B.CH3COOH溶液中,CH3COOH达到电离平衡时,溶液中检测不出CH3COOH分子
C.氢碘酸的电离方程式为HI=H++I-
D.弱电解质溶液的导电能力一定比强电解质弱
5.(2022·山东临沂·二模)液氨具有微弱的导电性,加入钠单质可快速得到深蓝色溶液,并慢慢产生气泡,溶液导电能力显著提升。下列说法错误的是( )
A.液氨能够发生电离,有和生成
B.钠和液氨可发生反应:
C.蒸发钠的液氨溶液,蓝色会逐渐褪去
D.0.1ml钠投入液氨中生成0.01ml时,Na共失去0.02ml电子
6.(2022·宁夏·固原一中高三阶段练习)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1ml·L-1NaOH溶液:K+、Na+、、
B.0.1ml·L-1Na2CO3溶液:K+、Ba2+、、Cl-
C.加入KSCN显红色的溶液:K+、、Cl-、S2-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、
7.(2022·全国课时练习)某温度下,由组成的水的离子积为,已知,下列关于的叙述正确的是( )
A.该温度下,呈中性,其
B.该温度下,1L含的溶液的
C.该温度下,1L含的溶液的
D.该温度下,的溶液和的的溶液混合后(混合后溶液的体积变化忽略不计),所得溶液的
8.(2022·河南商丘·高二期末)常温下,向20mL0.1ml·L-1的HA溶液中逐滴加入0.1ml·L-1的烧碱溶液,溶液中由水电离出的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法错误的是( )
A.由图可知A-的水解平衡常数Kh约为1×10-9
B.B点溶液中粒子浓度之间存在:c(HA)氨水
15.(2022·重庆实验外国语学校阶段练习)常温下,向10VmLpH=a的稀硫酸中滴加VmLpH=b的NaOH溶液,所得溶液中c(Na+)=2c(SO),则a+b的值是( )
A.13B.14C.15D.无法确定
16.(2022·湖北·高三开学考试)常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.H2X的电离常数Ka1的数量级为10-2
B.水电离的(H+):N点c(HX-)>c(H+)=c(OH-)
第II卷(非选择题)
17.(2022·河南商丘·期末)已知部分弱酸的电离平衡常数如下表,根据表中数据回答下列问题。
(1)体积相同、pH相同的三种酸溶液①HCOOH ②HCN ③HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的顺序是_______(用序号表示)。
(2)25℃已知某浓度的HCOONa溶液pH=9,原因是____________________________。(用离子方程式表示),该溶液中由水电离出的OH-浓度为_______。
(3)浓度相同的四种溶液①HCOONa ②NaCN ③NaHCO3 ④Na2CO3,其碱性由强到弱的顺序是______________(用序号表示);其中HCOONa溶液中各离子浓度由大到小的顺序是______________。
(4)浓度均为0.1ml·L-1三种溶液①HCOONH4、②NH4CN、③NH4HCO3,这三种溶液中c(NH)从大到小的顺序为______________(用序号表示)。
18.(2022·四川·雅安中学阶段练习)运用相关原理,回答下列各小题:
(1)某H2SO4溶液的浓度是0.005 ml·L-1。
①此溶液的pH为_______;
②用水稀释到原来体积的100倍,pH为________;
③再继续稀释106倍,pH为________。
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、 OH-。根据题意,回答下列问题:
①若由0.1 ml·L-1 HA溶液与0.1 ml·L-1 NaOH溶液等体积混合而得,则溶液的pH____ 7( 填大小关系)。
②若溶液pH>7,则c(Na+)________c(A-), 理由是____________________________。
③若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法中正确的是______________ (填选项代号)。
A.若反应后溶液呈中性,则c(H+)+c(OH- )=2×10-7 ml·L-1
B.若V1=V2反应后溶液的pH 一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
19.(2021·广西玉林·期中)常温下,有浓度均为0.1ml·L-1的下列6种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3 溶液
(1)溶液③pH=10的原因是_____________________________________(用离子方程式表示,下同);溶液④pH=11的原因是 ___________________________。
(2)溶液①中各离子浓度由大到小的顺序是_________________。
(3)溶液①和③相比较,pH (NaCN)_______pH (CH3COONa) (填“>”“”“<”或“=”)。
21.(2021·山东·泰安一中高二期中)回答下列问题
(1)25℃时用氨水吸收甲酸可得到HCOONH4溶液,已知25℃时甲酸的电离常数Ka=1.8×10-4,NH3·H2O的电离常数Kb=1.8×10-5,HCOONH4 溶液显_______(填“ 酸性”、“ 中性” 或“ 碱性”);溶液中的离子浓度由大到小排列是_________________;请计算反应NH3·H2O+HCOOHNH+ H2O+HCOO-的平衡常数K=_______。
(2)25℃时,向20mL0.1ml/L的NaOH溶液中滴加0.1ml/L的CH3COOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7,已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,Ka的表达式:Ka= _________________。(用含“数字和V”的式子表示)
(3)已知25 ℃时有关弱酸的电离平衡常数:
同温度下,等pH值的a.NaHCO3、b.NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为_______(填序号)。
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液呈_______(填“酸性”,“中性”或“碱性”),醋酸体积_______氢氧化钠溶液体积(填“ >” 、“=”或“8.0
蓝色
甲基橙
<3.1
红色
3.1~4.4
橙色
>4.4
黄色
酚酞
<8.2
无色
8.2~10.0
浅红色
>10.0
红色
酸(pH=a)
碱(pH=b)
弱酸
强酸
弱碱
强碱
稀释10n倍
<a+n
a+n
>b-n
b-n
无限稀释
pH趋向于7
选项
探究方案及现象
探究目的
A
用pH计测量醋酸、盐酸的pH,比较溶液pH大小
醋酸是弱电解质
B
向久置的溶液中加入足量溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
不能被空气氧化
C
向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色
氧化性:
D
向盛有溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
具有还原性
A.演示喷泉实验
B.滴定实验中用标准碱液滴定盐酸接近滴定终点的操作
C.测稀硫酸的
D.制备氨水
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25°C)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7 Ka2=5.6×10-11
Ka=1.7×10-5
弱酸化学式
HCN
H2CO3
电离平衡常数
4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
弱酸
HClO
H2CO3
H2SO3
电离平衡常数(25℃)
相关试卷
这是一份高考化学一轮复习讲练 第8章 第26讲 水的电离和溶液的pH (含解析),共26页。试卷主要包含了了解水的电离、离子积常数,45,5,即有c=c=10-4,11 mL+26等内容,欢迎下载使用。
这是一份新高考化学一轮复习讲义 第8章 第47讲 水的电离和溶液的pH,共16页。试卷主要包含了全面,扎实训练学科基本技能,培养学生积极的学习态度,有计划等内容,欢迎下载使用。
这是一份2022年高考化学一轮复习讲义第8章第38讲 水的电离和溶液的pH (含解析),共19页。试卷主要包含了了解水的电离、离子积常数,3,则正常人血液的pOH,7 B.小于6,0蓝色等内容,欢迎下载使用。