



所属成套资源:高考化学一轮复习【夯实基础】复习精讲精练
第47讲 综合探究型实验 -备战2023年高考化学【一轮·夯实基础】复习精讲精练
展开
这是一份第47讲 综合探究型实验 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第47讲综合探究型实验原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第47讲综合探究型实验解析版-备战2023年高考化学一轮·夯实基础复习精讲精练售后微信403032929docx等2份试卷配套教学资源,其中试卷共90页, 欢迎下载使用。
【复习目标】
1.具有较强的问题意识,能提出化学探究问题,能做出预测和假设。
2.能预测物质的某些性质,并进行实验验证。
3.能根据物质的特征反应和干扰因素选取适当的检验试剂。
4.能观察并如实记录实验现象和数据,进行分析和推理,得出合理的结论。
【知识精讲】
考点一 性质探究类综合实验
1.物质性质探究、验证的实验角度
(1)物质氧化性、还原性及其强弱的判断。如探究SO2具有还原性的方法是将气体通入酸性KMnO4溶液中,通过观察酸性KMnO4溶液是否褪色来说明;如探究Fe3+的氧化性强于I2时,可利用FeCl3与淀粉KI溶液反应,通过溶液变蓝色来说明Fe3+的氧化性强于I2。
(2)验证同周期、同主族元素性质的递变规律,一般通过设计比较元素金属性、非金属性强弱的实验来完成。如通过比较Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg、Al的活泼性顺序。
(3)电解质强弱的判断。如探究化合物HA是弱电解质的方法是常温下配制NaA溶液,测pH,若pH>7,则说明HA为弱电解质。
(4)物质酸性强弱的判断。如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断。
(5)钢铁发生电化学腐蚀的规律探究。可以通过控制钢铁是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等设计实验,找出规律。
(6)热分解产物的性质探究、判断
①难溶性碳酸盐氧化物+CO2;
②碳酸的酸式盐碳酸的正盐+CO2+H2O;
③铵盐(NH4NO3除外)NH3+相应的酸(或酸性氧化物+H2O);
④硝酸盐金属(或金属氧化物、亚硝酸盐)+氮氧化物(NO或NO2)+O2;
⑤草酸晶体CO2+CO+H2O。
2.猜想型综合实验题的解答流程
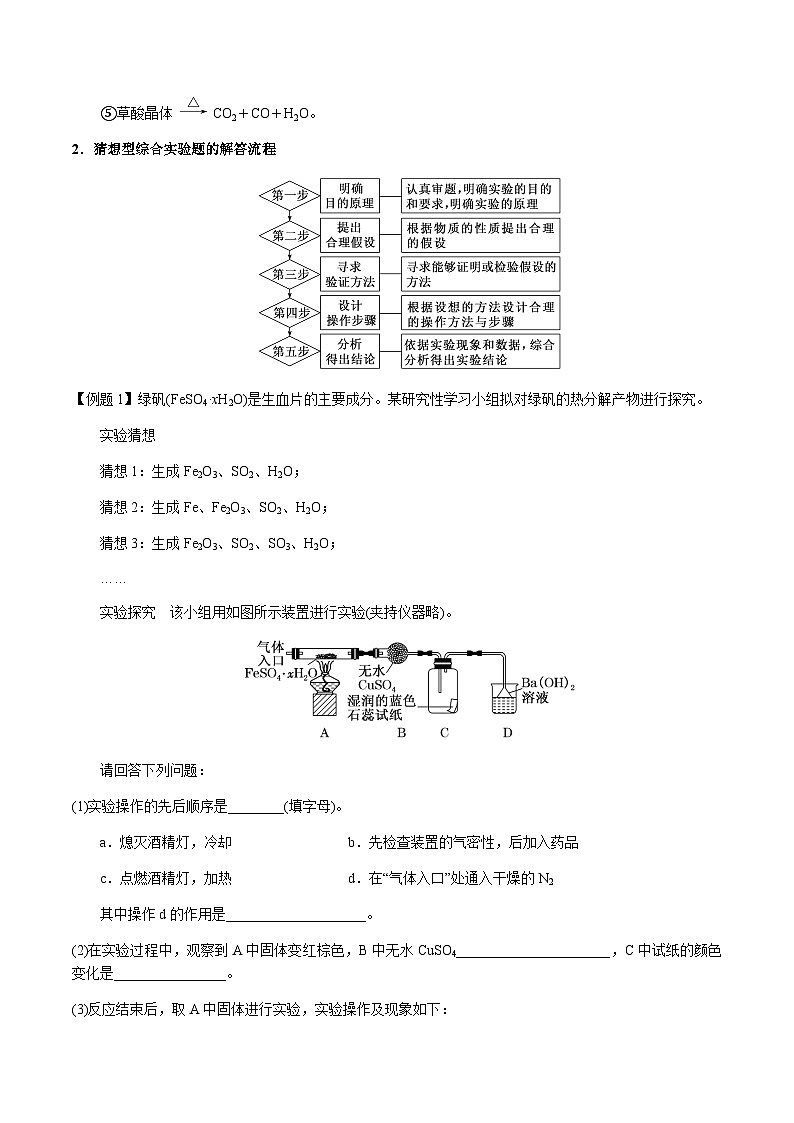
【例题1】绿矾(FeSO4·xH2O)是生血片的主要成分。某研究性学习小组拟对绿矾的热分解产物进行探究。
实验猜想
猜想1:生成Fe2O3、SO2、H2O;
猜想2:生成Fe、Fe2O3、SO2、H2O;
猜想3:生成Fe2O3、SO2、SO3、H2O;
……
实验探究 该小组用如图所示装置进行实验(夹持仪器略)。
请回答下列问题:
(1)实验操作的先后顺序是________(填字母)。
a.熄灭酒精灯,冷却b.先检查装置的气密性,后加入药品
c.点燃酒精灯,加热d.在“气体入口”处通入干燥的N2
其中操作d的作用是____________________。
(2)在实验过程中,观察到A中固体变红棕色,B中无水CuSO4______________________,C中试纸的颜色变化是________________。
(3)反应结束后,取A中固体进行实验,实验操作及现象如下:
①将固体加入盛有足量稀硫酸的试管中,固体完全溶解,且无气体放出;
②取①中溶液滴入适量KMnO4溶液中,KMnO4溶液不褪色;
③取①中溶液滴入KSCN溶液中,溶液变红色。
由此得出结论:红棕色固体为________。
(4)D中有白色沉淀生成,该沉淀的化学式为____________________。有同学认为还应该增加一个实验,取D中沉淀,加入一定量的盐酸以确定其组成,从而确定FeSO4·xH2O的分解产物,你认为是否需要?说明你的理由:____________________________________。
实验结论
(5)硫酸亚铁晶体加热分解的化学方程式为__________________________________。
考点二 定量测定类综合实验
1.物质(离子)检验的基本原则和方法
(1)物质检验的“三原则”:一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。
(2)物质检验的基本方法:
根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
①生成气体,如NHeq \\al(+,4)、COeq \\al(2-,3)的检验。
②生成沉淀,如Cl-、SOeq \\al(2-,4)的检验。
③显现特殊颜色,如Fe3+、苯酚的检验。
④焰色试验,检验金属或金属离子。
(3)物质检验的注意事项
①选取试剂要最佳:选取的试剂对试剂组中的各物质反应现象:溶液颜色的改变、沉淀的生成或溶解、气体的产生等要专一,使之一目了然。
②尽可能选择特效反应以减少干扰,如用品红溶液检验SO2,用KSCN溶液检验Fe3+,用湿润的红色石蕊试纸检验NH3。
③一定要注意避免离子间的相互干扰,如检验COeq \\al(2-,3)时,HCOeq \\al(-,3)会造成干扰;Fe2+遇氧化剂转化对Fe3+的检验造成干扰。
④注意离子检验所要求的环境,如酸碱性、浓度、温度的选择。
2.定量实验数据的测定方法
(1)沉淀法:先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行计算。
(2)测气体体积法:对于产生气体的反应,可以通过测量气体体积的方法测定样品纯度。
①常见测量气体体积的实验装置
②量气时应注意的问题
a.量气时应保持装置处于室温状态。
b.读数时要特别注意消除“压强差”,保持液面相平,还要注意视线与液面最低处相平,如上图(Ⅰ)(Ⅳ)应使量气管左侧和右侧的液面高度保持相平。
(3)测气体质量法
将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
(4)滴定法
利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
3.定量测定中的相关计算
(1)常用的计算方法
(2)常用的计算公式
①n=eq \f(m,M),n=eq \f(V,Vm),n=cV(aq)。
②物质的质量分数(或纯度)=eq \f(该物质的质量,混合物的总质量)×100%。
③产品的产率=eq \f(产品的实际产量,产品的理论产量)×100%。
④物质的转化率=eq \f(参加反应的原料量,加入原料的总量)×100%。
【例题2】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
(1)装置A制取SO2,反应的化学方程式为_____________________________。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置B应该使用的是________(填“冷水”或“温水”)浴。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是______。
(3)该实验装置存在可能导致NOSO4H产量降低的缺陷是________________________。
(4)测定亚硝酰硫酸的纯度:
准确称取1.380 g产品放入250 mL的碘量瓶中,加入0.100 0 ml·L-1、60.00 mL的KMnO4标准溶液和10 mL 25% H2SO4溶液,然后摇匀。用0.250 0 ml·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O===K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:____MnOeq \\al(-,4)+____C2Oeq \\al(2-,4)+____===____Mn2++____+____H2O。
②滴定终点时的现象为____________________________。
③亚硝酰硫酸的纯度=______________。[M(NOSO4H)=127 g·ml-1]
考点三 探究型实验综合题
《新课程标准》对化学学科的核心素养“实验探究与创新意识”提出明确的要求如下:应具有较强的问题意识,能发现和提出有探究价值的化学问题,能依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论;能和同学交流实验探究的成果,提出进一步探究或改进实验的设想;能尊重事实和证据,不迷信权威,具有独立思考、敢于质疑和批判的创新精神。
解答综合实验题的思维流程
【例题3】(2022·湖南永州市高三模拟)过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为_____________、___________(填字母)。
②加热温度不宜超过60 ℃的原因是_________________。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500 mL三口烧瓶中先加入16 g冰醋酸,在搅拌下滴加90 g 68% H2O2溶液,最后加入4.1 mL浓硫酸,搅拌5 h,静置20 h。
(已知:CH3COOH+H2O2eq \(,\s\up7(H+))+H2O)
①用浓缩的68% H2O2溶液代替常见的30% H2O2溶液的目的是_______________。
②充分搅拌的目的是______________________________。
(3)过氧乙酸含量的测定
步骤a:称取5.0 g过氧乙酸试样(液体),配制成100 mL溶液A。
步骤b:在碘量瓶中加入5.0 mL H2SO4溶液、3滴MnSO4 溶液、5.0 mL溶液A,摇匀,用0.01 ml·L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0 g KI(CH3COOOH+2H++2I-===I2+CH3COOH+H2O),摇匀,置于暗处5 min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20 mL,摇匀,用淀粉溶液作指示剂,用0.05 ml·L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2Oeq \\al(2-,3)===2I-+S4Oeq \\al(2-,6))。
重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00 mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100 mL容量瓶,玻璃棒和量筒外,还需要____________。
②设计步骤b的目的是__________________。
③过氧乙酸的质量分数为__________%。
【真题演练】
1.(2022·湖南·高考真题)为探究的性质,进行了如下实验(和溶液浓度均为)。
依据上述实验现象,结论不合理的是A.实验①说明加热促进水解反应
B.实验②说明既发生了水解反应,又发生了还原反应
C.实验③说明发生了水解反应,但没有发生还原反应
D.整个实验说明对的水解反应无影响,但对还原反应有影响
2.(2022·北京·高考真题)利用下图装置进行铁上电镀铜的实验探究。
下列说法不正确的是
A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:
C.随阴极析出,推测②中溶液减少,平衡逆移
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
3.(2022·浙江·高考真题)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
A.AB.BC.CD.D
4.(2022·全国·高考真题)由实验操作和现象,可得出相应正确结论的是
A.AB.BC.CD.D
5.(2022·浙江·高考真题)下列方案设计、现象和结论有不正确的是
A.AB.BC.CD.D
6.(2022·北京·高考真题)某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:
i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
(1)B中试剂是___________。
(2)通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为___________。
(3)对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是___________。
(4)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因___________,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________,溶液绿色缓慢加深,原因是MnO2被___________(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是___________。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因___________。
7.(2022·山东·高考真题)实验室利用和亚硫酰氯()制备无水的装置如图所示(加热及夹持装置略)。已知沸点为,遇水极易反应生成两种酸性气体。回答下列问题:
(1)实验开始先通。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式为__________________。装置c、d共同起到的作用是______________。
(2)现有含少量杂质的,为测定n值进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为,不反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则_______;下列情况会导致n测量值偏小的是_______(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)用上述装置、根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对、混合物进行蒸榴提纯(加热及夹持装置略),安装顺序为①⑨⑧_______(填序号),先馏出的物质为______________。
8.(2021·天津·高考真题)某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)
(1)甲装置中主要仪器的名称为___________。
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至__________________。欲使反应停止,关闭活塞K1即可,此时装置中的现象是__________________。
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是__________________,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是__________________。
(4)丙装置的特点是___________(填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
(5)在图中方框内补全干燥装置和干燥剂。___________。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是___________(填序号),原因是___________。
9.(2021·广东·高考真题)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlrine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取的化学方程式为_____________________。
(2)实验室制取干燥时,净化与收集所需装置的接口连接顺序为_______。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中______________已分解。检验此久置氯水中存在的操作及现象是_______。
(4)某合作学习小组进行以下实验探究。
①实验任务。通过测定溶液电导率,探究温度对溶解度的影响。
②查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时,。
③提出猜想。
猜想a:较高温度的饱和溶液的电导率较大。
猜想b:在水中的溶解度。
④设计实验、验证猜想。取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
⑤数据分析、交流讨论。25℃的饱和溶液中,_______。
实验结果为。小组同学认为,此结果可以证明③中的猜想成立,但不足以证明猜想成立。结合②中信息,猜想不足以成立的理由有______________。
⑥优化实验。小组同学为进一步验证猜想,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表中内容。
⑦实验总结。根据实验1~5的结果,并结合②中信息,小组同学认为猜想也成立。猜想成立的判断依据是_____________________。
10.(2020·北京·高考真题)探究Na2SO3固体的热分解产物。
资料:
①4Na2SO3Na2S+3Na2SO4
②Na2S能与S反应生成Na2Sx,Na2Sx与酸反应生成S和H2S。
③BaS易溶于水。
隔绝空气条件下,加热无水Na2SO3固体得到黄色固体A,过程中未检测到气体生成。黄色固体A加水得到浊液,放置得无色溶液B。
(1)检验分解产物Na2S:取少量溶液B,向其中滴加CuSO4溶液,产生黑色沉淀,证实有S2-。反应的离子方程式是__________________。
(2)检验分解产物Na2SO4:取少量溶液B,滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验该沉淀含S),同时产生有臭鸡蛋气味的气体(H2S),由于沉淀增多对检验造成干扰,另取少量溶液B,加入足量盐酸,离心沉降(固液分离)后,___________(填操作和现象),可证实分解产物中含有SO。
(3)探究(2)中S的来源。
来源1:固体A中有未分解的Na2SO3,在酸性条件下与Na2S反应生成S。
来源2:溶液B中有Na2Sx,加酸反应生成S。
针对来源1进行如图实验:
①实验可证实来源1不成立。实验证据是__________________。
②不能用盐酸代替硫酸的原因是__________________。
③写出来源2产生S的反应的离子方程式:_________________________。
(4)实验证明Na2SO3固体热分解有Na2S,Na2SO4和S产生。运用氧化还原反应规律分析产物中S产生的合理性:__________________。
【课后精练】
第I卷(选择题)
1.(2022·广东广州·模拟预测)下列实验装置或方案能达到实验目的的是
A.用图1装置,制取乙烯
B.用图2装置,比较碳硅元素非金属性大小
C.用图3装置,证明混合溶液中有
D.用图4装置,检验氯化铵受热分解产物
2.(2022·广东深圳·一模)由下列实验及现象推出的相应结论正确的是
A.AB.BC.CD.D
3.(2022·新疆·博乐市高级中学(华中师大一附中博乐分校)三模)向碘水淀粉的混合液中加入溶液,蓝色褪去。为探究褪色原因,实验如下图。已知碘水中存在平衡:。下列分析不正确的是
A.过程①后溶液的酸性明显增强
B.过程③中加入溶液的目的是除去
C.不能判断是过程④中溶液变蓝的原因
D.综合上述实验,过程①中蓝色褪去的原因是氧化了I2
4.(2022·广东广州·模拟预测)室温下,某同学用下图中装置在通风棚中进行如下实验:
下列说法不正确的是A.试管Ⅰ中浅红棕色气体为,由铜还原硝酸生成
B.等质量的Cu完全溶解时,Ⅰ中消耗的更少
C.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,可能是由于溶有
D.蓝色的呈平面四边形结构,中心离子不可能为杂化
5.(2022·上海上海·模拟预测)有关Na2O2性质实验如下:
已知:
①Na2O2与水反应经历了Na2O2+2H2O =2NaOH+H2O2;
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
A.双氧水能使酚酞褪色
B.浓氢氧化钠能使酚酞褪色
C.双氧水和浓氢氧化钠都能使酚酞褪色
D.可利用二氧化锰和水来完善实验方案
6.(2022·浙江绍兴·模拟预测)下列方案设计、现象、解释或结论有错误的是
A.AB.BC.CD.D
7.(2022·山东日照·三模)实验室用下图所示装置,探究室温下与的反应,所用镁条质量和表面积相同,且均已用砂纸打磨,实验2的镁条放在尖嘴玻璃导管内并浸于蒸馏水中,实验3产生的浑浊物主要为碱式碳酸镁。下列说法错误的是
A.实验1现象不明显,可能与表面生成了难溶的有关
B.实验2比实验1现象更明显,可能是由于玻璃导管内空间狭小,热量不易散失
C.由实验1和实验3可得出“碱性增强有利于加快镁与水反应速率”的结论
D.实验3中破坏了在镁条表面的沉积,增大了镁与水的接触面积
8.(2022·江苏南通·模拟预测)化学小组为探究 SO2与 AgNO3溶液的反应,进行如下实验:
实验 1:用如下装置(夹持、加热仪器略)制备 SO2,将足量 SO2通入 AgNO3溶液中, 迅速反应,得到无色溶液 A 和白色沉淀 B。
实验 2:向溶液 A 中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加 BaCl2 溶液, 未出现白色沉淀。
下列关于实验说法不正确的是
A.铜与浓硫酸反应中还原剂与氧化剂物质的量之比为1:1
B.上述装置中试剂a为浓硫酸,作用是干燥SO2气体
C.实验2初步确定沉淀B为Ag2SO3,不含有 Ag2SO4
D.该条件下SO2与AgNO3溶液不易发生氧化还原反应
9.(2022·湖南·模拟预测)某小组探究FeCl3和Na2S竟色反应。
【查阅资料】
①硫单质微溶于乙醇,难溶于水;
②FeS、Fe2S3均为黑色固体,难溶于水:
③Fe3++6F-=[FeF6]3-,[FeF6]3-为无色离子。
【设计实验】
下列推断正确的是A.黑色沉淀X溶解只发生复分解反应
B.实验II不生成S可能是氧化还原速率较大
C.生成黑色沉淀W的反应为2Fe3++3S2-=Fe2S3↓
D.反应物中越小,氧化还原的趋势越小
10.(2022·湖南省隆回县第一中学模拟预测)研究“2Fe3++2I-⇌2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图:
下列说法不正确的是
A.i中生成黄色沉淀的反应是:Ag++I-=AgI↓
B.可依据i中现象推测,实验I中的棕黄色主要是I2引起的
C.对照实验ii、iii,可推测ii中增大c(Fe2+),导致Fe2+还原性大于I-,平衡向左移动
D.还原性:实验i中I->Fe2+,实验ii中I-SCN-
C.④中溶液颜色变浅的原因可能是Fe2+也可以与SCN-络合
D.将③中所得溶液分为两等份,分别加入0.5mLH2O、0.5mL 0.5ml·L-1FeSO4溶液,对比二者颜色变化即可确定④中颜色变浅的原因
12.(2022·辽宁沈阳·二模)根据实验内容、实验现象和可能的原因,下列操作和现象能够说明原因不合理的是
A.向实验一的绿色溶液中加水,溶液变为蓝色,说明②的原因
B.向实验一的绿色溶液中通入氦气,溶液变为蓝色,说明①的原因
C.向实验二的无色溶液中继续滴加NaOH溶液,溶液又变红,说明③的原因
D.实验一的绿色溶液适当加热,溶液仍为绿色,说明②的原因
13.(2022·北京西城·二模)某小组探究Cu与H2O2在不同条件下的反应,实验结果如表:
下列说法不正确的是A.I中生成Cu(OH)2的反应是Cu+H2O2=Cu(OH)2
B.由实验可知,增大c(OH-),H2O2的氧化性增强
C.增大c(NH4+)有利于[Cu(NH3)4]2+的生成
D.[Cu(NH3)4]2+可能是H2O2分解的催化剂
14.(2022·山东青岛·二模)为探究氨及铵盐性质,将晶体装入如图所示T形三通管两端,进行微型实验。下列说法错误的是
A.轻轻挤压任一乳胶头,若蒸馏水中有气泡冒出,则装置气密性良好
B.同时点燃两个酒精灯后,两端湿润的pH试纸均变蓝
C.实验过程中竖直支管上方会出现白烟
D.停止加热后可以交替挤压两边乳胶头,使气体更充分吸收,减少污染
15.(2022·湖北·模拟预测)某同学利用下图装置探究的性质。
下列有关现象的解释中,错误的是
A.①中溶液起始显红色的原因:
B.①中溶液红色褪去的原因:
C.②中溶液起始显黄绿色的原因:
D.②中溶液黄绿色褪去的原因:
16.(2022·全国·模拟预测)某学习小组为探究气体的性质,设计如图所示装置进行实验,下列说法错误的是
A.装置A中酸性溶液褪色,和发生了氧化还原反应
B.装置B中生成淡黄色沉淀,体现了二氧化硫的还原性
C.装置C中品红溶液褪色可以验证的漂白性
D.装置D的作用是吸收多余的,防止污染空气
第II卷(非选择题)
17.(2022·广东·普宁市华侨中学二模)某校化学小组探究酸性KMnO4溶液与H2O2溶液反应速率的影响因素。
(1)甲进行了实验I:常温下,向4mL不同浓度的H2O2溶液中滴入一滴溶液[c(H+)=5.0ml/L],记录如下:
①请写出反应的离子方程式______________。
②对于c(H2O2)增大引起的速率异常现象,根据上述实验结果,甲排除了一种可能,请用化学方程式表示这种可能性______________。
③为了解释c(H2O2)增大到一定浓度后速率减小,乙查得了如下资料:
资料显示:c(H2O2)>0.02ml,H2O2溶液中存在平衡:2H2O2⇌H4O4
请用平衡移动原理解释c(H2O2)=0.0312ml/L速率忽然减小的原因______________。
(2)乙继续进行实验II,并记录如下:
①对于第10滴溶液与H2O2溶液反应速率剧烈变化的原因,乙提出如下假设:_______。
②乙设计实验方案证实了上述假设合理,请补全他的方案:
(3)综合上述实验,对于酸性KMnO4溶液与H2O2溶液反应速率,丙进行了总结。下列因素一定能加快反应速率的是_______。
a.增大KMnO4溶液浓度 b.增大H2O2溶液浓度 c.增大H2SO4浓度
d.加热适当温度 e.加入合适的催化剂
18.(2022·广东深圳·一模)碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
I.配制KI溶液
(1)配制500mL的KI溶液,需要称取KI的质量为___________g。
(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
A.B.C.D.
II.探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为___________。
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=___________,b=___________。
(5)设计实验组别3的目的是___________。
III.探究反应“”为可逆反应。
试剂:KI溶液,溶液,淀粉溶液,溶液,KSCN溶液。实验如下:
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为___________;乙同学认为该现象无法证明该反应为可逆反应,原因为___________。
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:___________。
19.(2022·广东广州·模拟预测)某化学实验小组探究与溶液的反应。
实验一:用如图所示实验装置制备,并将足量通入溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
(1)制备的化学反应方程式为___________。
(2)仪器的名称为___________。
(3)某同学取适量酸性于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有,此结论___________(填“正确”、“不正确”),理由是___________。
实验二:探究血红色溶液产生的原因
实验过程如下表:
(4)实验①中,是___________(填化学式);实脸②中现象是___________。
(5)为了进一步探究血红色物质产生的主要原因,又进行了以下实验:在的溶液中,加入浓度相同的溶液,溶液并混合均匀,改变、的值并维持进行多组实验,测得混合溶液的吸光度与出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持的目的是___________。
②该实验得出的结论是___________。
20.(2022·四川内江·模拟预测)过二硫酸钾(K2S2O8)易潮解,易分解,是一种重要的氧化剂。某学习小组设计实验探究过二硫酸钾的性质。
实验(一)探究过二硫酸钾的强氧化性。
(1)用K2S2O8溶液与KI溶液反应,实验操作与现象如下表所示。
①用碰撞理论分析,实验Ⅰ中K2S2O8和KI反应很慢的主要原因是______________。
②实验Ⅱ中Fe2+起催化作用,总反应分两步进行:
(i)2Fe2+ +S2O=2Fe3++2SO;
(ii)_____________________。
请你补充反应( ii ) ,并设计实验证明实验Ⅱ反应后的溶液中含有Fe3+_______。
(2)查阅文献知,氧化性:S2O> MnO。在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3溶液,再滴加K2S2O8溶液,实验现象是_____________________,该反应的离子方程式为_____________________。
实验(二)探究过二硫酸钾的不稳定性。
已知几种物质的熔、沸点如下表所示:
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(3)加热前,先通入一段时间N2,当观察到D装置中_______(填实验现象)时点燃酒精灯。
(4)B装置的U形管中收集到的物质是_______(填化学式)。
(5)当A装置的硬质玻璃管中固体完全分解时,停止加热。冷却至室温,然后取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8发生分解的化学方程式_______。
21.(2022·湖北·天门市教育科学研究院模拟预测)FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验。回答下列问题:
Ⅰ.铁粉制备FeCl3(实验装置如图所示)
(1)仪器a的名称为_______
(2)制取Cl2的化学方程式为_______。
(3)饱和食盐水的作用是_______
(4)硬质玻璃管直接接入收集器的优点是_______。
Ⅱ.探究FeCl3溶液与Cu的反应
(5)配制FeCl3溶液时加入少量盐酸的原因是_______。
(6)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______。
(7)已知(6)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1 ml·L-1FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______(填化学式)。
小组成员进一步查阅资料发现, Cu2+与SCN-可发生如下两种反应。
反应i: Cu2+ + 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii: 2Cu2+ + 4SCN- = 2CuSCN↓+ (SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______(填“反应i”或“反应ii”)。 小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(8)根据上述分析可知,Cu2+、 Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______。
22.(2022·陕西·西安中学模拟预测)某研究性学习小组对亚硫酸钠的组成及性质进行探究。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有_______(填“氧化性”或“还原性”),反应的离子方程式为_______。
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显_______(填“酸性”、“碱性”或“中性”)。
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是_______。
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。
量取60mL标签上注明为1.0ml·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是_______;缺少B装置,测定的变质的百分率将会_______(填“偏高”、“偏低”或“不变”)。
②该实验装置中存在的明显缺陷是_______。改进缺陷后再进行实验,若实验前后测得C装置增重3.2g,则Na2SO3变质的百分率为_______。类型
解题方法
物质含量计算
根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学
式的计算
①根据题给信息,计算出有关物质的物质的量。
②根据电荷守恒,确定出未知离子的物质的量。
③根据质量守恒,确定出结晶水的物质的量。
④各粒子的物质的量之比即为物质化学式的下标比
多步滴定计算
复杂的滴定可分为两类:
(1)连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量
(2)返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
热重曲线计算
①设晶体为1 ml。
②失重一般是先失水、再失气态非金属氧化物。
③计算每步的m余,eq \f(m余,m1 ml晶体质量)=固体残留率。
④晶体中金属质量不减少,仍在m余中。
⑤失重最后一般为金属氧化物,由质量守恒得mO,由n金属∶nO即可求出失重后物质的化学式
实验
操作与现象
①
在水中滴加2滴溶液,呈棕黄色;煮沸,溶液变红褐色。
②
在溶液中滴加2滴溶液,变红褐色;
再滴加溶液,产生蓝色沉淀。
③
在溶液中滴加2滴溶液,变红褐色;
将上述混合液分成两份,一份滴加溶液,无蓝色沉淀生;
另一份煮沸,产生红褐色沉淀。
装置示意图
序号
电解质溶液
实验现象
①
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
②
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
方案设计
现象和结论
A
先加入少量溶液,再加溶液和足量稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
B
加到少量溶液中,再加硫酸酸化,振荡
若溶液褪色,则样品为亚硝酸钠
C
先加到少量溶液中,再加入稀盐酸酸化,振荡
若溶液变黄色,则样品为亚硝酸钠
D
先加入少量溶液,再加入溶液和稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
实验操作
现象
结论
A
向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液
先变橙色,后变蓝色
氧化性:
B
向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液
无砖红色沉淀
蔗糖未发生水解
C
石蜡油加强热,将产生的气体通入的溶液
溶液红棕色变无色
气体中含有不饱和烃
D
加热试管中的聚氯乙烯薄膜碎片
试管口润湿的蓝色石蕊试纸变红
氯乙烯加聚是可逆反应
目的
方案设计
现象和结论
A
检验硫酸厂周边空气中是否含有二氧化硫
用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化
溶液不变色,说明空气中不含二氧化硫
B
鉴定某涂改液中是否存在含氯化合物
取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象
出现白色沉淀,说明涂改液中存在含氯化合物
C
检验牙膏中是否含有甘油
将适量牙膏样品与蒸馏水混合,搅拌,静置一段时间,取上层清液,加入新制的Cu(OH)2,振荡,观察现象
溶液出现绛蓝色,说明牙膏中含有甘油
D
鉴别食盐与亚硝酸钠
各取少量固体加水溶解,分别滴加含淀粉的KI溶液,振荡,观察溶液颜色变化
溶液变蓝色的为亚硝酸钠;溶液不变蓝的为食盐
序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
实验序号
检验试剂和反应条件
现象
结论
①
酸性KMnO4溶液
紫红色褪去
产物含有乙醛
②
新制Cu(OH)2,加热
生成砖红色沉淀
产物含有乙醛
③
微红色含酚酞的NaOH溶液
微红色褪去
产物可能含有乙酸
实验序号
试样
测试温度/℃
电导率/
1
Ⅰ:25℃的饱和溶液
25
2
Ⅱ:35℃的饱和溶液
35
3
Ⅲ:45℃的饱和溶液
45
实验序号
试样
测试温度/℃
电导率/
4
Ⅰ
_______
5
_______
_______
选项
实验
现象
结论
A
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐属于无碘盐
B
将某硝酸亚铁溶液用盐酸酸化,并滴加少量KSCN溶液
溶液变红
该硝酸亚铁溶液已变质
C
用热碳酸钠溶液清洗铁钉表面上油垢
油垢无明显变化
该油垢的主要成分不是动、植物油脂
D
将新制的氢氧化铜悬浊液与某饮品混合,加热
未出现砖红色沉淀
该饮品不含糖
实验
现象
试管Ⅰ中开始无明显现象,后逐渐有微小气泡生成,反应越来越剧烈,试管口上方出现红棕色气体,溶液呈蓝色。
试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色:之后向溶液中持续通入,溶液又变为蓝色。
选项
实验操作
实验现象
解释或结论
A
摘下几根火柴头浸于水中,一定时间后取适量溶液于试管中,加溶液、稀硝酸和溶液。
出现白色沉淀
火柴头含有氯元素
B
向的溶液中加入几滴溶液,制得新制然后加入适量牙膏
绛蓝色溶液
牙膏中存在甘油
C
将石蜡油与碎瓷片混合加强热,产生的气体通入酸性重铬酸钾钾溶液中
酸性重铬酸钾溶液褪色
石蜡油加强热产生的气体是不饱和烃
D
取溶液于试管中,滴加溶液,待不再出现白色沉淀后,再滴加溶液
白色沉淀转化为黄色沉淀
溶解度大于
实验1
实验2
实验3
镁条表面有微小气泡,且溶液较长时间无明显变化
镁条表面有较多气泡且产生气泡速率逐渐加快,溶液中无明显现象
镁条表面有大量气泡,溶液逐渐变浑浊
序号
I
II
III
操作
在1mL0.1ml·L-1Na2S溶液中加入1mL0.1ml·L-1FeCl3溶液
在·L-1溶液中加入·L-1FeCl3溶液
在2mLlml·L-1NaF溶液中加入·L-1FeCl3溶液,得无色溶液,再加入·L-1Na2S溶液
现象
迅速产生黑色沉淀X,振荡,黑色沉淀溶解,放出臭鸡蛋气味气体,最终得到棕黄色浊液Y
产生棕黑色沉淀Z
产生黑色沉淀W
结论
分离Y得到Fe(OH)3和S
经检验,Z的主要成分是Fe2S3,含少量Fe(OH)3
经检验,W为Fe2S3
实验内容
实验一
实验二
实验现象
反应后溶液呈绿色,而不是蓝色
烧杯中溶液变为无色
可能的原因
①溶液中溶解了生成的NO2
②溶液中c(Cu2+)大
③氯水中的H+与OH-反应
④氯水中的次氯酸漂白了酚酞
装置
实验
试剂a
现象与结果
I
10h后,液体变为浅蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2
II
8mL5ml/L氨水
立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2
III
8mL5ml/L氨水和1gNH4Cl固体
立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜片依然保持光亮
c(H2O2)/ml/L
0.0010
0.0015
0.0125
0.0312
0.044
0.0620
完全褪色时间/s
25
15
12
23
60
370
无色气泡
一样多
操作
现象
实验II
往2mL0.2ml/LH2O2溶液中逐滴滴加0.05ml/LKMnO4[c(H+)=5.0ml/L]溶液
第1-9滴溶液滴下,完全褪色所需时间很长;
第10滴溶液滴下迅速褪色。
整个过程中几乎无温度变化。
操作
现象
实验III
往2mL0.2ml/LH2O2溶液中滴入5滴0.05ml/LKMnO4[c(H+)=5.0ml/L]溶液
完全褪色时间为t秒
实验IV
往2mL0.2ml/LH2O2溶液中_______.
_______.
组别
温度
KI溶液
溶液
蒸馏水
淀粉溶液
c(KI)
V
V
1
298K
5mL
5mL
10mL
3滴
2
313K
mL
5mL
10mL
3滴
3
298K
10mL
5mL
5mL
3滴
实验序号
假设
实验内容
结论
①
取上述血红色溶液,滴入溶液,溶液又变为黄色
假设不成立
②
和增大
在溶液中,滴入溶液,溶液呈血红色,再逐渐滴入溶液,出现_____________现象
假设不成立
③
或增大
在溶液中加入溶液,立即变为血红色
假设成立
实验
操作
现象
Ⅰ
在10mL0.1ml/L含淀粉的KI溶液中滴加4mL0.1ml/LK2S2O8溶液
一段时间后,溶液缓慢变蓝色
Ⅱ
在10mL0.1ml/L含淀粉的KI溶液中先滴几滴0.1ml/LFeSO4溶液,再滴加4mL0.1 ml/LK2S2O8溶液
溶液迅速变蓝色
物质
SO3
SO2
O2
熔点/℃
16.8
-72.7
-218.4
沸点/℃
44.8
10
-182.9
操作
现象
在盛有2 mL 0.1ml·L-1 CuSO4溶液的试管中滴加KSCN溶液
溶液很快由蓝色变为绿色,未观察到白色沉淀;
2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀
相关试卷
这是一份第48讲 表格型实验设计的评价与分析 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第48讲表格型实验设计的评价与分析原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第48讲表格型实验设计的评价与分析解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共60页, 欢迎下载使用。
这是一份第45讲 无机物的制备实验 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第45讲无机物的制备实验原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第45讲无机物的制备实验解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共75页, 欢迎下载使用。
这是一份第40讲 盐类的水解 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第40讲盐类的水解原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第40讲盐类的水解解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共67页, 欢迎下载使用。









