



所属成套资源:高考化学一轮复习【夯实基础】复习精讲精练
第四章 非金属及其化合物 章末综合检测卷 -备战2023年高考化学【一轮·夯实基础】复习精讲精练
展开
这是一份第四章 非金属及其化合物 章末综合检测卷 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第四章非金属及其化合物章末综合检测卷原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第四章非金属及其化合物章末综合检测卷解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
第I卷(选择题)
一、选择题(每小题3分,共48分)
1.(2022·全国·高三专题练习)氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4~5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是( )
A.氯胺的水解产物为NH2OH(羟氨)和HClB.氯胺的电子式为
C.氯胺中氯的化合价为+1D.氯胺的消毒原理与漂白粉相似
2.(2022·安徽蚌埠·高三期末)下列操作能达到相应实验目的的是( )
A.AB.BC.CD.D
3.(2022·江苏·南京市第十三中学模拟预测)下列有关物质的性质与用途具有对应关系的是( )
A.具有氧化性,可用于纸浆漂白B.难溶于水,可用作耐高温材料
C.溶液呈酸性,可用于去除铁锈D.氢氟酸具有弱酸性,可用作玻璃蚀刻剂
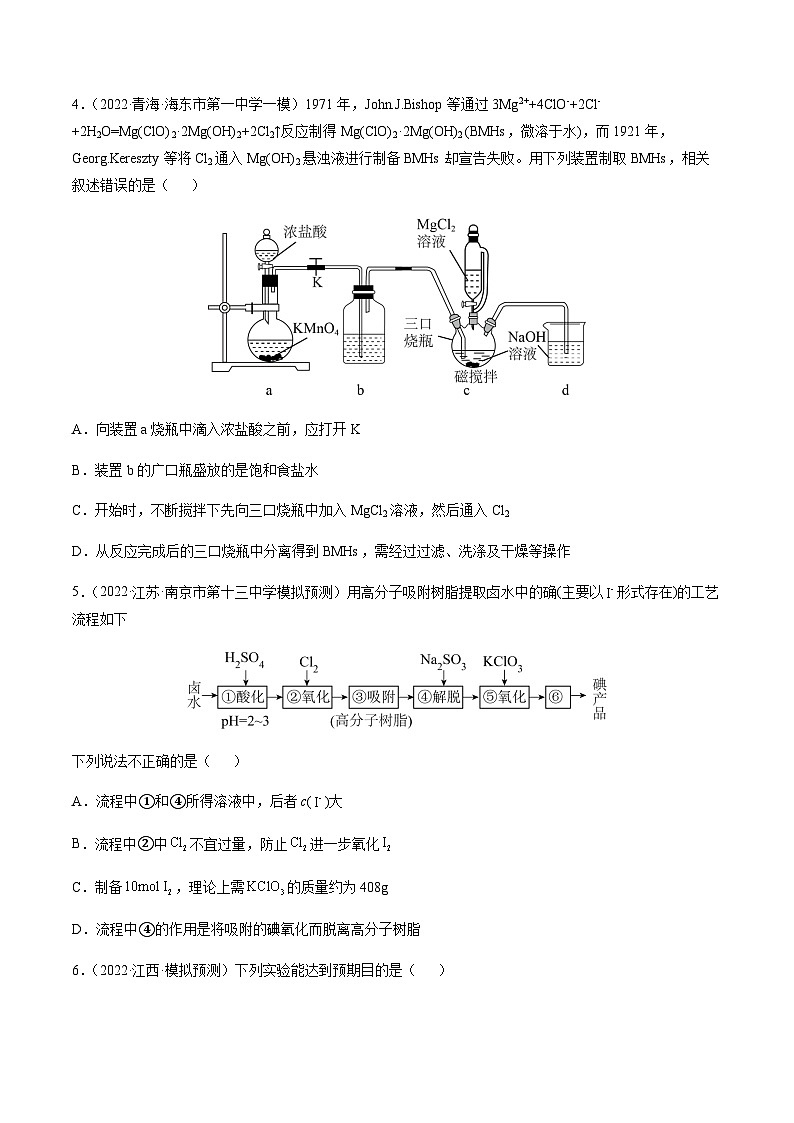
4.(2022·青海·海东市第一中学一模)1971年,等通过3Mg2++4ClO-+2Cl-+2H2O=Mg(ClO)2·2Mg(OH)2+2Cl2↑反应制得Mg(ClO)2·2Mg(OH)2 (BMHs,微溶于水),而1921年,Gerg.Kereszty等将Cl2通入Mg(OH)2悬浊液进行制备BMHs却宣告失败。用下列装置制取BMHs,相关叙述错误的是( )
A.向装置a烧瓶中滴入浓盐酸之前,应打开K
B.装置b的广口瓶盛放的是饱和食盐水
C.开始时,不断搅拌下先向三口烧瓶中加入MgCl2溶液,然后通入Cl2
D.从反应完成后的三口烧瓶中分离得到BMHs,需经过过滤、洗涤及干燥等操作
5.(2022·江苏·南京市第十三中学模拟预测)用高分子吸附树脂提取卤水中的确(主要以形式存在)的工艺流程如下
下列说法不正确的是( )
A.流程中①和④所得溶液中,后者c()大
B.流程中②中不宜过量,防止进一步氧化
C.制备,理论上需的质量约为408g
D.流程中④的作用是将吸附的碘氧化而脱离高分子树脂
6.(2022·江西·模拟预测)下列实验能达到预期目的是( )
A.AB.BC.CD.D
7.(2022·浙江省普陀中学高三开学考试)汽车尾气中的氮氧化合物与大气中的发生如下作用,形成一种雾霾。
有关该雾霾的叙述错误的是( )
A.该雾霾中含硝酸铵固体B.反应②是非氧化还原反应
C.反应①是固氮反应D.可能来自过度施用氮肥
8.(2022·江西·模拟预测)我国有着五千年文明历史,下列有关说法正确的是( )
A.《本草图经》有“白矾多入药用”,其白矾是[KAl(SO4)2·12H2O],具有杀菌、消毒之功效
B.诗句“月落乌啼霜满天,江枫渔火对愁眠”。其中不包含有化学变化过程
C.“凡石灰,经火焚炼为用……火力用后,烧酥石性,置于风中,久自吹成粉”中的“粉”为CaO
D.古代烧制的“明如镜,声如磬”的瓷器,其主要成分为硅酸盐
9.(2022·广东·高三开学考试)下列性质与用途均正确且具有对应关系的是( )
A.AB.BC.CD.D
10.(2022·全国·高三专题练习)某氮肥样品可能含有NH4HCO3、NH4Cl、NH4NO3中的一种或几种。为探究其成分,称取该样品0.500 0 g,溶解配成100 mL溶液,加过量浓NaOH溶液,加热,将产生的氨气通入60.00 mL 0.100 0 ml·L-1的H2SO4溶液中(设产生的NH3全部逸出),剩余的H2SO4溶液能消耗20.00 mL 0.225 0 ml·L-1的NaOH溶液。下列说法正确的是( )
A.吸收NH3消耗的H2SO4为6.000×10-3 ml
B.上述过程共产生NH3 268.8 mL(标准状况下)
C.该样品中NH的质量分数为43.2%
D.该氮肥样品必含NH4Cl
11.(2022·广东·高三开学考试)实验室进行二氧化硫气体制取和性质实验装置如图所示。下列说法正确的是( )
A.如果铜丝过量,浓硫酸可以全部消耗
B.把品红溶液换成高锰酸钾溶液,可以验证的相同性质
C.石蕊试液变红但不褪色,说明水溶液有酸性,但没有漂白性
D.把铜丝换成亚硫酸钠,不加热,也可完成同样的实验
12.(2022·四川·模拟预测)下列实验不能达到目的的是( )
A.AB.BC.CD.D
13.(2022·全国·高三专题练习)在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是( )
A.向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3
B.向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性
C.将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2的水溶液显酸性
D.向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
14.(2022·全国·高三专题练习)二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料。下列说法正确的是
A.SiO2既能与HF反应, 又能与NaOH反应,属于两性氧化物
B.SiO2和Si都是光导纤维材料
C.利用SiO2与NaOH溶液反应可制取“水玻璃”
D.图中所示转化反应都是非氧化还原反应
15.(2022·全国·高三专题练习)含氮化合物及其单质的“类别-价态”二维图如图,下列相关分析或预测错误的是( )
A.NaOH、NaNO2、NH4Cl均属于强电解质
B.N2→NO2→HNO3的转化均能一步实现
C.反应NO2+NO+2 NaOH =2NaNO2+H2O属于氧化还原反应
D.NO2溶于水的离子方程式为3NO2+H2O=2H++2+NO
16.(2022·全国·高三专题练习)化学是一门以实验为基础的学科,某同学为探究FeCl3溶液的性质进行如下实验,操作如图所示,根据实验现象下列分析不正确的是
A.①~④的变化中,仅有1处涉及氧化还原反应
B.③中反应的离子方程式:2Fe3++3C+3H2O=2Fe(OH)3(胶体)+3CO2↑
C.若将FeCl3溶液滴加到Na2S溶液中,产生的现象与图中①、②现象相同
D.若用Na2SO3代替Na2S进行实验溶液也能变成淡绿色
第II卷(非选择题)
二、非选择题(共52分)
17.(2022·上海·华师大二附中高三阶段练习)第五代隐身战机运用了先进的吸波材料。钡铁氧体是一种应用最广的吸波材料之一。回答下列问题:
(1)铝与钡处于相邻主族,铝的原子核外有_______种能量不同的电子。氢氧化铝可以溶于氢氧化钡得到无色溶液,写出离子方程式_________________________。
(2)钡的金属性_______(大于或小于)铝,下列能比较铝与钡的金属性强弱的是_______。
a.高温下铝冶炼钡4BaO+2Al→BaO·Al2O3+3Ba↑
b.铝与水反应需加热,钡与水剧烈反应
c.氧化铝熔点高于氧化钡
(3)某钡铁氧体化学式为BaFe18O27,将其写为氧化物的形式_____________。将0.030ml该铁氧体溶于2.0ml/L的稀硝酸,恰好溶解时需要硝酸_______mL。
(4)碳酸钡可用于制钡铁氧体,一种制纳米碳酸钡的原料为BaCl2、NH4HCO3和氨水,从电离平衡的角度分析氨水的作用_____________。
(5)实验室中,氧化钡是一种高效干燥剂,可以除去乙醚等有机试剂中的少量水,但不能用于除乙酸乙酯中的少量水,原因是___________________。
18.(2022·吉林·高三期末)某同学为了验证硫铁矿(主要成分为FeS2。含有少量的碳)焙烧产物(产生的气体是SO2,CO2),设计如下装置进行实验:
回答下列问题:
(1)装置A、B中的试剂分别是_______、_______。
(2)装置D的作用是_____________。
(3)验证焙烧后气体产物的实验现象分别为_____________、_____________;若F中颜色发生改变,写出产生颜色变化反应的离子方程式:___________________。取F中反应后的溶液于洁净的试管中。滴加少量KSCN溶液,溶液不变红,说明溶液中_______(填“含有”或“不含有”)Fe3+;再继续滴加少量氯水,溶液也不变红。产生这种现象的原因可能是___________________。
(4)G中盛放足量酸性KMnO4溶液的目的是___________________(用离子方程式表示)。
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式: _______________________________。
19.(2022·河南·高三阶段练习)氢氧化铍可用作核技术和制备含铍材料的中间体等。以硅铍石(主要成分Be2SiO4含少量Al2O3)和方解石(主要成分CaCO3,含少量FeCO3、SiO2)为原料,制备Be(OH)2的工艺流程如图所示:
已知:
I.硅铍石不易被硫酸直接分解;铍的性质与铝相似;粗Be(OH)2含有少量Al(OH)3;
II.生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)“熔炼”时加入方解石粉的作用为_____________;生成气体的电子式为_______。
(2)浸渣中除含有CaSiO3、H2SiO3外,还含有_______(填化学式)。
(3)滤渣1中含有NH4Al(SO4)2·12H2O、(NH4)2 Fe(SO4)2·6H2O。NH4Al(SO4)2 ·12H2O能用作净水剂,原因为___________________(用离子方程式表示);(NH4)2 Fe(SO4)2·6H2O可用于测定KMnO4的含量,该反应中氧化剂与还原剂的物质的量之比为_____________。
(4)根据已知II信息可知,“深度除铁”的适宜方案为___________________。
(5)“调pH”所得母液中的主要溶质可返回到_____________工序循环利用。
(6)“洗涤”的目的是除去粗Be(OH)2中所含的Al(OH)3,若用足量NaOH浓溶液代替NaOH稀溶液,会导致的后果为___________________(用离子方程式表示)。
20.(2022·江苏苏州·模拟预测)氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下:
已知:
①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见如图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。
①向A装置中通入空气的作用除搅拌外还有_________________。
②若镍粉过量,判断反应完成的现象是_________________。
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为_____________________________。
②检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是_________________。
(3)所得NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,搅拌,___________。 [NiCl2溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、NiCO3]
21.(2021·贵州遵义·高三阶段练习)锡箔纸常用于食品包装和食品加工。制作锡箔纸的主要金属元素锡(Sn)位于周期表的第ⅣA族,它的常见价态有+2、 +4价,其单质沸点为2260℃,四氯化锡( SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4(夹持装置已略去)。
(1)装置乙的作用是_____________,装置丙中的试剂是_____________。实验过程中应先点燃_______处酒精灯(填“甲”或“丁”)。
(2)装置甲中生成标况下44.8L Cl2时,被氧化的HCl数目为_____________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_______。
(4)你认为该实验装置最大的缺点是:_____________。
(5)用滴定法测定所用金属锡样品的纯度(杂质不参加反应)。
①将一定量锡粉完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液。写出第二步反应的离子方程式:_______________________________。
②取①所得溶液用K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+14HC1=6FeCl3+2KCl+2CrCl3+7H2O。K2Cr2O7溶液应注入到_______式填“酸”或“碱”) 式滴定管中。滴定完后发现滴定尖嘴处有气泡,则滴定结果_______。(填“偏高”、“偏低”或者“不变”)
22.(2022·四川乐山·一模)某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______(填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_____________。
②步骤三中,加入H2O2溶液发生反应的离子方程式为___________________,灼烧后 所得固体的颜色为_____________,灼烧时需要使用下列仪器中的_______(填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______。
④由实验数据计算,每片药片中约含Fe2+ _______mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
A
B
C
D
制备乙酸乙酯
制备NH3
制备Cl2
制备氢氧化铁胶体
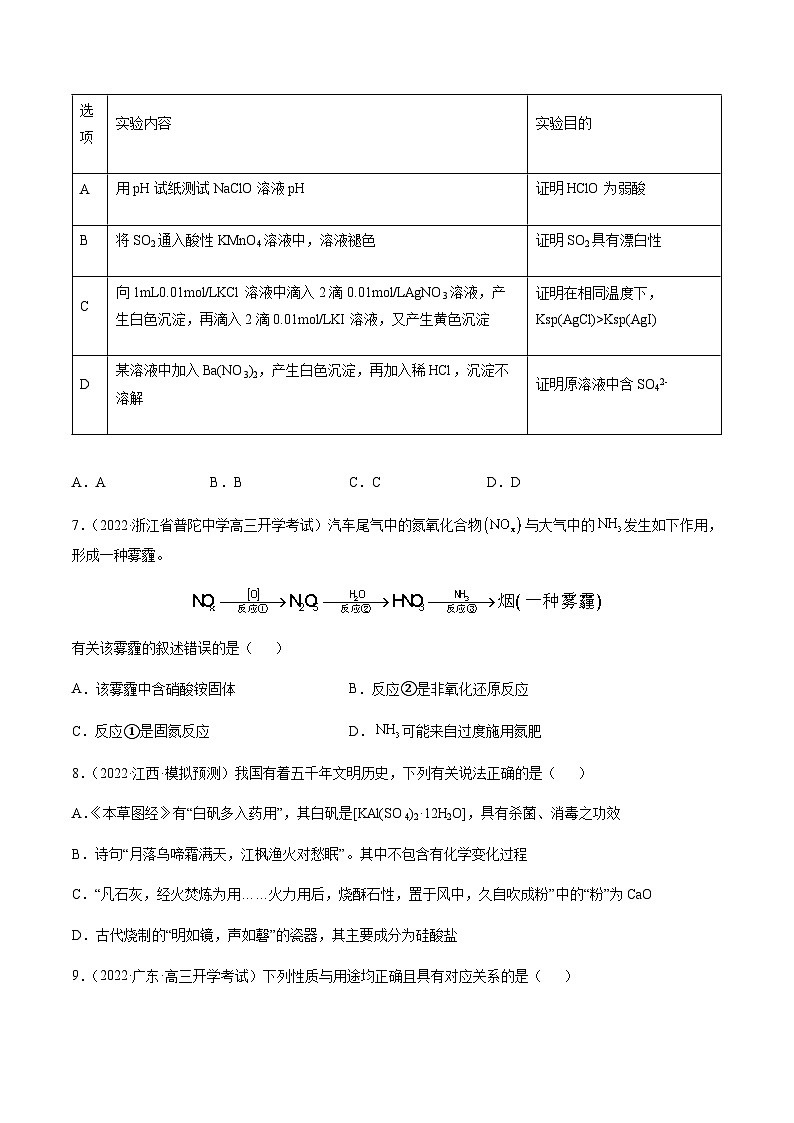
选项
实验内容
实验目的
A
用pH试纸测试NaClO溶液pH
证明HClO为弱酸
B
将SO2通入酸性KMnO4溶液中,溶液褪色
证明SO2具有漂白性
C
向1mL0.01ml/LKCl溶液中滴入2滴0.01ml/LAgNO3溶液,产生白色沉淀,再滴入2滴0.01ml/LKI溶液,又产生黄色沉淀
证明在相同温度下,Ksp(AgCl)>Ksp(AgI)
D
某溶液中加入Ba(NO3)2,产生白色沉淀,再加入稀HCl,沉淀不溶解
证明原溶液中含SO42-
选项
物质性质
物质用途
A
氮气有还原性
可用作食品包装袋中的保护气
B
受热易分解
可用作氨肥
C
液氨分解吸热
可用作制冷剂
D
硝酸铵溶于水吸热
可用于制作医用速冷冰袋
选项
目的
实验
A
检验海带中是否含有碘元素
向海带灰浸取液中滴加淀粉溶液
B
除去溴苯中混有的Br2
加入稀NaOH溶液洗涤、分液
C
证明SO2具有还原性
将SO2通入酸性KMnO4溶液中
D
证明醋酸是弱酸
测定0.1 ml/L醋酸溶液的pH
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Be(OH)2
开始沉淀的pH
7.7
2.5
3.5
4.6
沉淀完全的pH(溶液中金属离子浓度等于10-5 ml·L-1)
8.7
3.2
4.7
5.9
相关试卷
这是一份第五章 物质结构、元素周期律 章末综合检测卷 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第五章物质结构元素周期律章末综合检测卷原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第五章物质结构元素周期律章末综合检测卷解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
这是一份第二章 化学物质及其变化 章末综合检测卷 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第二章化学物质及其变化章末综合检测卷原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第二章化学物质及其变化章末综合检测卷解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
这是一份第一章 化学计量在实验中的应用 章末综合检测卷 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第一章章末综合检测卷原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第一章章末综合检测卷解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。








