



重庆市七校联盟2023-2024学年高三下学期第一次月考化学试题(Word版附解析)
展开本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间75分钟。
注意事项:
1.答题前,务必将自己的姓名、准考证号等填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.考试结束后,将答题卷交回。
5.可能用到的相对原子质量:
第I卷(选择题 共42分)
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1. 中华文明源远流长,文物承载着文明的记忆。下列文物的材质属于天然有机高分子的是
A. 马踏飞燕B. 汉竹简C. 曜变天目瓷碗D. 汉卷云纹玉壁
【答案】B
【解析】
【详解】A.马踏飞燕主要是是东汉青铜器, A项错误;
B.竹简主要成分为纤维素,属于天然有机高分子, B项正确;
C.瓷碗主要原料是取之于自然界的硅酸盐矿物,如粘土、长石、石英等,属于无机非金属材料, C项错误;
D.玉石主要成分为二氧化硅、氧化铝等, D项错误;
答案选B。
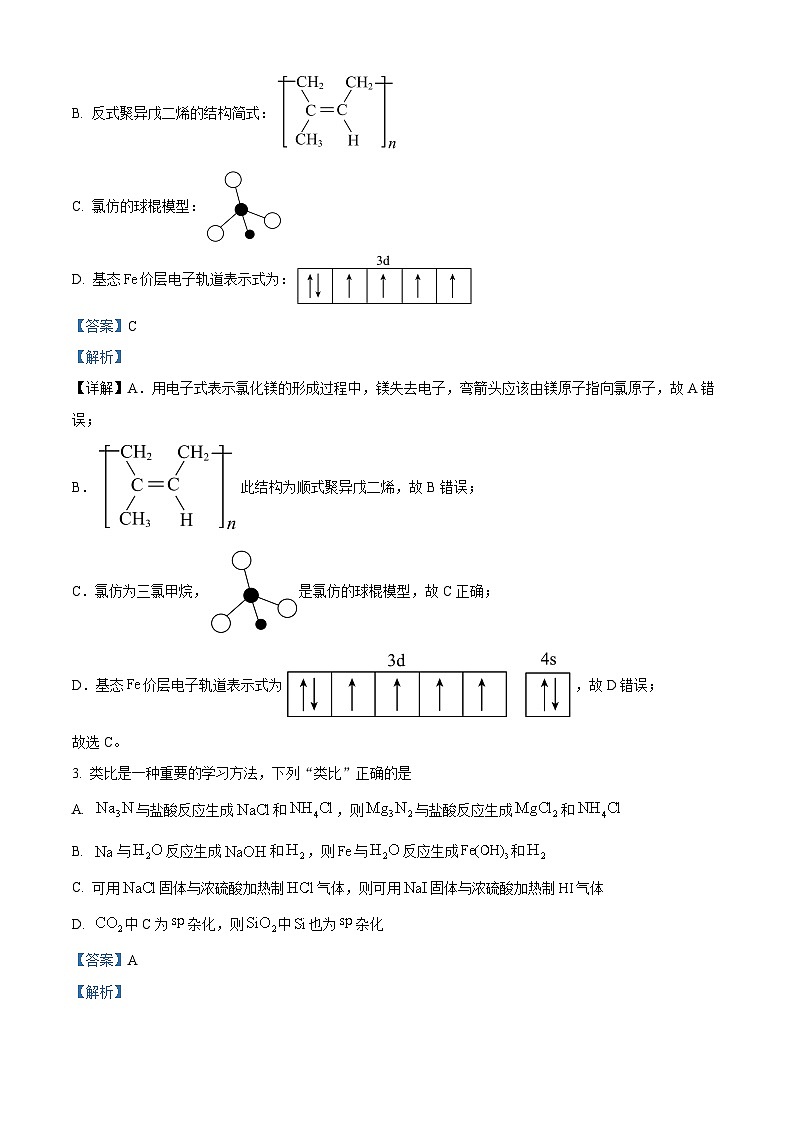
2. 下列化学用语表示正确的是
A. 的形成过程:
B. 反式聚异戊二烯的结构简式:
C. 氯仿的球棍模型:
D. 基态价层电子轨道表示式为:
【答案】C
【解析】
【详解】A.用电子式表示氯化镁的形成过程中,镁失去电子,弯箭头应该由镁原子指向氯原子,故A错误;
B.此结构为顺式聚异戊二烯,故B错误;
C.氯仿为三氯甲烷,是氯仿的球棍模型,故C正确;
D.基态价层电子轨道表示式为,故D错误;
故选C。
3. 类比是一种重要的学习方法,下列“类比”正确的是
A. 与盐酸反应生成和,则与盐酸反应生成和
B. 与反应生成和,则与反应生成和
C. 可用固体与浓硫酸加热制气体,则可用固体与浓硫酸加热制气体
D. 中C为杂化,则中也为杂化
【答案】A
【解析】
【详解】A.和都是金属离子和氮离子构成的离子化合物,和盐酸反应都生成相应的金属氯化物和,故A正确;
B.与反应生成和,但是与水蒸气反应生成四氧化三铁和氢气,故B错误;
C.可用固体与浓硫酸加热制气体,但不能用固体与浓硫酸加热制备气体,因为浓硫酸会氧碘离子为碘单质,故C错误;
D.是直线形结构,C为杂化;中每个硅原子都结合4个氧原子,采用杂化,故D错误。
故选A。
4. 下列离子方程式书写正确的是
A. 硫酸铝溶液与过量氨水反应:
B. 向过量的溶液中滴加少量“84”消毒液:
C. 向次氯酸钠溶液中通入少量二氧化碳:
D. 向碘化亚铁溶液中通入过量氯气:
【答案】C
【解析】
【详解】A.氢氧化铝不能溶于氨水,过量氨水与硫酸铝反应的离子方程式应为:,故A错误;
B.向过量的溶液中滴加少量“84消毒液,溶液中有过量的不会生成,离子方程式应为,故B错误;
C.次氯酸的酸性强于碳酸氢根,所以无论二氧化碳的量多或量少,只能生成碳酸氢根,,故C正确:
D.向碘化亚铁溶液中通入过量氯气,碘化亚铁少量,二价铁离子和碘离子的系数比应为,离子方程式应为:,故D错误;
答案选C。
5. 下列关于离子共存的说法正确的是
A. 某溶液中可能大量存在以下离子:
B. 加入苯酚显紫色的溶液中能大量共存的离子:
C. 常温下,中性溶液中能大量共存的离子:
D. 常温下,由水电离出的的溶液中可能大量共存的离子:
【答案】D
【解析】
【详解】A.在酸性条件下具有强氧化性,会氧化氯离子,生成氯气,故不能大量共存,故A错误;
B.加入苯酚显紫色溶液中含有三价铁离子,铁离子具有氧化性,会氧化硫离子,所以不能大量共存,故B错误;
C.常温下,中性溶液中三价铁离子已经完全沉淀,所以不能大量存在,故C错误;
D.由水电离出的的溶液可能呈酸性或碱性,酸性或碱性溶液中都能大量共存,故D正确。
6. 用代表阿伏加德罗常数的值。下列说法正确的是
A. 羟基与氨基含有的电子数均为
B. 白磷中含键数目为
C. 用惰性电极电解溶液时,阴极产生,(标况),则电路中通过电子数
D. 的硫酸铵溶液中,所含数目小于
【答案】A
【解析】
【详解】A.羟基与氨基含有的电子数均为, A项正确;
B.白磷为正四面体结构,白磷中含,则白磷中含为, B项错误;
C.用惰性电极电解CuCl2溶液时,在阳极生成, C项错误;
D.溶液体积未知,不能计算硫酸铵的物质的量,故不能判断的数目, D项错误;
答案选A。
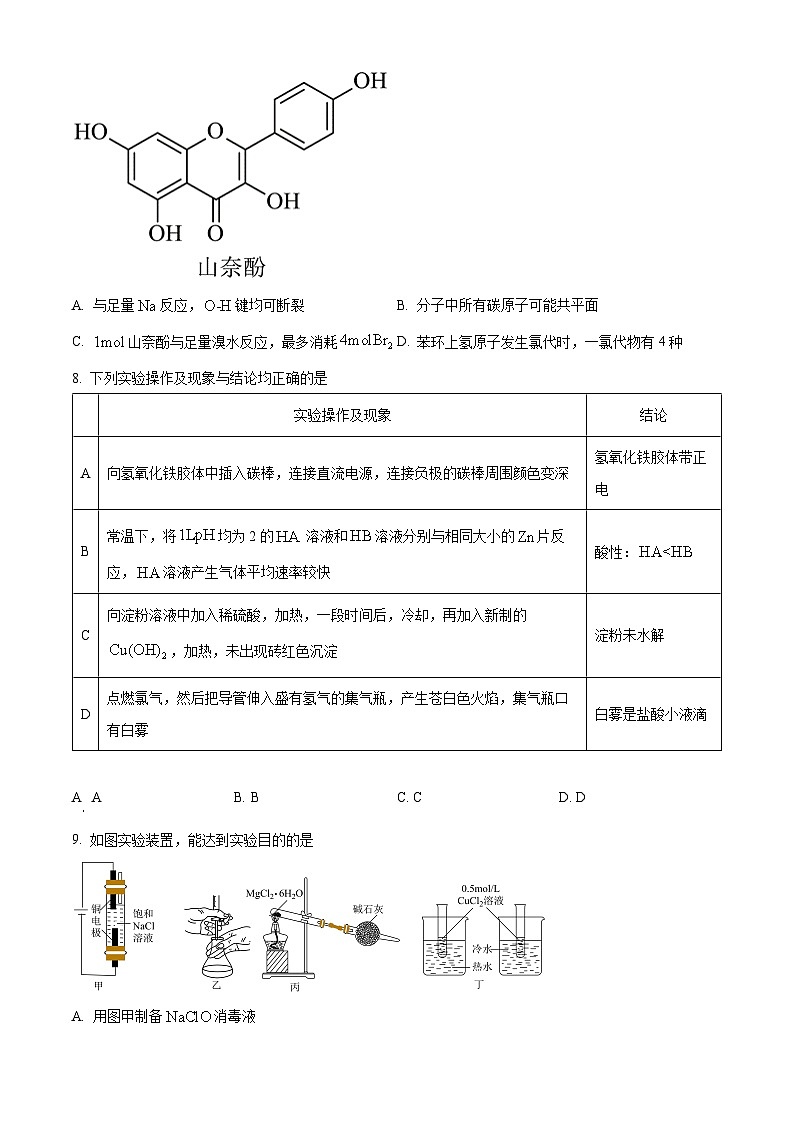
7. 山奈酚是从中药杜仲中提取的一种具有抗菌、止咳祛痰作用的黄酮类化合物。山奈酚的结构简式如图所示。下列有关山奈酚的说法错误的是
A. 与足量反应,键均可断裂B. 分子中所有碳原子可能共平面
C. 山奈酚与足量溴水反应,最多消耗D. 苯环上氢原子发生氯代时,一氯代物有4种
【答案】C
【解析】
【详解】A.与足量反应,键均可断裂,故A正确;
B.山奈酚中苯环结构、碳碳双键和酮羰基结构均为平面结构,通过单键旋转可使所有碳原子共平面,故B正确;
C.结构中有三个酚羟基,三个酚羟基一共有四个邻对位氢原子,可以与溴水发生取代反应,消耗4个,有一个碳碳双键,与溴单质发生加成反应,所以山奈酚最多消耗,故C错误;
D.苯环上的等效氢原子有4种,则一氯代物有4种,故D正确;
故答案选C。
8. 下列实验操作及现象与结论均正确的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.氢氧化铁胶体粒子带正电荷,向阴极移动,但氢氧化铁胶体不带电,故A错误;
B.将均为2的溶液和溶液分别与相同大小的片反应,溶液产生气体平均速率较快,可知随着反应进行,继续电离,则酸性:,故B正确;
C.葡萄糖与氢氧化铜的反应需要在碱性条件下反应,淀粉溶液加入稀硫酸,加热,一段时间后,应该先加入过量氢氧化钠溶液使溶液呈碱性,再加入新制的氢氧化铜悬浊液,加热,通过是否产生砖红色沉淀来检验淀粉是否水解,否则稀硫酸与氢氧化铜反应,会干扰实验结果,故C错误:
D.氯气不是可燃性气体,不能点燃,应该验纯后点燃氢气,然后把导管伸入盛有氯气的集气瓶,故D错误;
9. 如图实验装置,能达到实验目的的是
A. 用图甲制备消毒液
B. 用图乙以标准溶液滴定未知浓度的盐酸
C. 用图丙由制备无水
D. 用图丁探究温度对平衡移动的影响
【答案】D
【解析】
【详解】A.铜电极与电源正极相连作阳极,失去电子,不能制备次氯酸钠,故A错误;
B.图中为酸式滴定管,不能盛装溶液,应改为碱式滴定管,故B错误;
C.加热含结晶水的晶体,促进镁离子水解,且生成的盐酸易挥发,图中装置加热不能制备无水氯化镁,故C错误;
D.该装置中影响因素为温度,可以探究温度对平衡移动的影响,故D正确;
故答案选D。
10. 前四周期元素W、X、Y、Z的原子序数依次增大,且互相不同周期不同族。其中W是宇宙中含量最多的元素;X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同:Y元素基态原子最外层电子数等于其能层数:Z元素基态原子核外未成对电子数同周期最多。下列说法正确的是
A. Y元素最高价氧化物对应的水化物为强碱B. 基态X原子核外电子有7种空间运动状态
C. 基态原子中未成对电子数D. Z形成的两种含氧酸根在溶液中存在着化学平衡
【答案】D
【解析】
【分析】前四周期元素W、X、Y、Z的原子序数依次增大,且互相不同周期,则W是宇宙中含量最多的元素,因此W为第一周期的H,X位于第二周期,Y位于第三周期,Z位于第四周期。X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同,X为N;Y元素基态原子最外层电子数等于其能层数,Y为;Z元素基态原子核外未成对电子数同周期最多,Z为。
【详解】A.Y元素为,其最高价氧化物对应水化物为两性氢氧化物,故A错误;
B.X为N,核外电子有5种空间运动状态,故B错误;
C.W中未成对电子数为1,X中为3,Y中为1,Z中为6,故C错误;
D.Z为,形成的两种含氧酸根在水溶液中存在化学平衡:,故D正确;
故答案选D。
11. 标准状况下,气态反应物和生成物的相对能量与反应历程示意图如下,已知:和的相对能量为0。下列说法错误的是
A. 相同条件下,的平衡转化率:历程Ⅰ=历程Ⅱ
B. 可计算键能为
C. 由图可知
D. 历程Ⅱ反应的快慢取决于过程Ⅰ反应的快慢
【答案】C
【解析】
【详解】A.对比两个历程可知,历程Ⅱ是使用了催化剂,催化剂不影响平衡转化率,A正确;
B.为的能量,而的相对能量为0,可算出键能为,B正确;
C.由图可知,,用能量来计算焓变,应该用生成物的总能量减去反应物的总能量,,C错误;
D.反应的快慢取决于慢反应,也就是活化能大的过程Ⅰ,D正确;
答案选C。
12. 晶体中,围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙3、6、7、8、9、12号氧围成),中有一半的填充在正四面体空隙中,和另一半填充在正八面体空隙中,下列有关说法错误的是
A. 若1、3、6、7号氧围成的正四面体空隙填充有,则8、9、12、14号氧围成的正四面体空隙也填充有
B. 晶体中正四面体空隙数与正八面体空隙数之比为
C. 若1、3、6、7号氧围成的正四面体空隙填充有,设立方体的棱长为1,11号坐标为则该的坐标为
D. 若立方体棱长为,则晶体密度计算式为
【答案】A
【解析】
【详解】A.只有一个位于正四面体空隙,A错误;
B.由晶胞结构可知,1、3、6、7号围成的正四面体空隙有8个,3、6、7、8、9、12号围成正八面体空隙,将晶胞补全可知共用一条棱和四个面心与该棱顶点也围成正八面体,而这样的正八面体为4个晶胞共有,晶胞中正八面体数目为,则晶体中正四面体空隙数与正八面体空隙数之比为,B正确;
C.根据11号点坐标,确定该坐标为,C正确;
D.该立方体中有1个,体积为,晶体的密度为,D正确。
故选A。
13. 以四甲基氯化铵水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵,下列叙述正确的是
A. 光伏并网发电装置中型半导体负极
B. 保持电流恒定,升高温度,制备的反应速率不变
C. 为阳离子交换膜,为阴离子交换膜
D. b极收集标况)气体时,溶液中共有离子透过交换膜
【答案】B
【解析】
【分析】根据图示可知,左池为电解池,右池为原电池。根据左池NaCl溶液的浓度变化可知,Cl-往右移动,d为阴离子交换膜,Na+往左边移动,e为阳离子交换膜。根据离子移动方向可知,a极为阴极,b极为阳极。a与N相连,b与P相连,故光伏并网发电装置中,N型半导体为负极,P型半导体为正极。
【详解】A.根据上述分析可知,光伏并网发电装置中型半导体为正极,A错误;
B.保持电流恒定,即单位时间内a极得到的电子数目是恒定的,电极反应的速率也将恒定,升温并不会提高反应速率,B正确;
C.根据左池的浓度变化,可知向最左端移动,故c膜为阳离子交换膜。根据上述分析可知,e膜也为阳离子交换膜,C错误;
D.b极发生的反应为:,故b极收集到0.1ml气体时,转移0.4mle-,而溶液中通过离子交换膜的离子有、Cl-、Na+,由于三者都只带1个电荷,故移动的物质的量均为0.4ml,故通过离子交换膜的离子的总物质的量为1.2ml,D错误;
故选B。
14. 某温度下,向和的混合溶液中逐滴加入某浓度的溶液,测得溶液中的离子浓度的关系如图所示,已知该温度下的电离平衡常数为,下列说法错误的是
A. 该温度下a点溶液的为7
B. b点溶液中存在
C b点溶液中
D. a、b、c三点溶液中最大是c点
【答案】C
【解析】
【详解】A.,,,A项正确;
B.b点溶液中的电荷守恒为,b点,B项正确;
C.,所以,C项错误;
D.因为的电离常数不变,从左到右逐渐增大,所以逐渐减小,逐渐增大,D项正确;
答案选C。
第Ⅱ卷(非选择题 共58分)
二、填空题(本题共4小题,每空1~2分,共58分。请将答题内容填写在答题卡的相应位置)
15. 近日,科学家利用光催化剂实现高选择性制备氢气。某小组以辉铋矿(主要成分是,含少量和等杂质)为原料制备钒酸铋()的流程如下:
已知:①滤液1中所含阳离子主要有和。
②几种氢氧化物沉淀的如表所示。
回答下列问题:
(1)基态原子的价层电子排布式为_________。浸渣1中,除了外还有一种单质为_________。
(2)调的最低值为_________。滤液3可以循环用于“_________” 工序(填名称)。
(3)“氯化”的化学方程式为___________________________。
(4)已知辉铋矿中所含元素的质量分数为这种矿石经上述转化最终制得,则铋的收率为_________()。
(5)的立方晶胞结构如图所示。己知晶体密度为,设为阿伏加德罗常数的值,则该晶体中与距离最近且相等的有_________个,相邻2个的核间距为_________。
【答案】(1) ①. ②. S
(2) ①. 3.1 ②. 浸取
(3)
(4)
(5) ①. 12 ②.
【解析】
【分析】辉铋矿(主要成分是,含少量、、和等杂质)加盐酸溶解,同时加氯化铁将硫氧化为单质,得到滤液主要成分为、,同时有过量的盐酸和氯化铁,滤渣1为硫单质和;滤液1中加双氧水将亚铁离子氧化为三价铁,再加将三价铁转化为沉淀,过滤后,滤液2中含有氯化铋、氯化钠稀释,促进氯化铋水解生成和,过滤后,滤饼溶于稀盐酸得到,与发生反应得到和二氧化硫,与反应生成,据此分析解答。
【小问1详解】
是P区元素,位于第6周期第VA族,价层电子排布为,辉铋矿(主要成分是,含少量、、和等杂质)加盐酸溶解,同时加氯化铁将硫氧化为单质,故答案为:;S。
【小问2详解】
滤液2中稀释,促进氯化铋水解生成,因此滤渣1是将Fe3+转化为Fe(OH)3,因此调pH时的最低值是3.1,滤液3中含有水解生成的,可用于浸取,故答案为:3.1;浸取;
【小问3详解】
与发生反应得到和二氧化硫,反应方程式为:
,故答案为:;
【小问4详解】
辉铋矿中所含元素的质量分数为,矿石中的含量为:,最终制得,则实际回收的的质量为,铋的收率为,故答案为:。
【小问5详解】
该晶体中分别位于顶点和面心,与距离最近且相等的有12个,该晶胞中含有4个和4个,晶胞质量为,晶胞边长为:相邻2个的核间距为面对角线的一半,即为,故答案为:12;。
16. 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质.已知:碘化亚铜(CuI)是白色固体,难溶于水,易与浓度较大的KI溶液形成,实验装置如图1所示。
图1 图2
(1)仪器D的名称是__________________。
(2)实验完毕后,用图2所示装置分离CuI的突出优点是__________________。
(3)某同学向装置C的烧杯中倾倒NaOH溶液时,不慎将少量溶液溅到皮肤上,处理的方法是__________________。
(4)装置B中发生反应的离子方程式是___________________________。
(5)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是___________________________。
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是___________________________。
(6)测定 CuI样品纯度:取ag CuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用bml∙L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积为VmL[已知:滴定反应为。该样品纯度为_________(用含a、b、V的代数式表示)。如果其他操作均正确,若选用的Na2S2O3标准液部分被氧化变质,测得结果_________(填“偏高”“偏低”或“无影响”)。
【答案】(1)圆底烧瓶
(2)过滤速率快 (3)先用大量水冲洗,再涂上硼酸溶液
(4)
(5) ①. 无色溶液中存在平衡:,加水,平衡向逆反应方向移动,转化成更多的CuI,因其难溶于水而析出 ②.
(6) ①. ②. 偏高
【解析】
【分析】制取CuI时,A装置用Na2SO3固体与75%的浓硫酸发生反应,制取SO2气体;装置B中,SO2还原Cu2+得到的Cu+与I-结合,生成CuI沉淀;装置C用于吸收SO2尾气,防止污染空气。过滤CuI时,采用负压过滤,以加快过滤速率。
【小问1详解】
仪器D的名称是圆底烧瓶。
【小问2详解】
实验完毕后,用图2所示装置分离CuI,借助安全瓶产生的负压力,使布氏漏斗内的水快速流出,突出优点是过滤速率快。
【小问3详解】
NaOH溶液对皮肤具有腐蚀性,若不慎将少量NaOH溶液溅到皮肤上,处理的方法是:先用大量水冲洗,再涂上硼酸溶液。
【小问4详解】
装置B中,SO2将Cu2+还原为Cu+,与I-结合生成CuI沉淀,SO2被Cu2+氧化为硫酸,发生反应的离子方程式是。
【小问5详解】
①少量CuI放入试管中,加入KI浓溶液,白色固体溶解得到无色溶液,此时CuI转化为[CuI2]-,在实验I中“加水,又生成白色沉淀”,则表明[CuI2]-又转化为CuI沉淀,原理是:无色溶液中存在平衡:,加水,平衡向逆反应方向移动,转化成更多的CuI,因其难溶于水而析出。
②根据实验Ⅱ,CuI与NaOH溶液反应,砖红色沉淀为Cu2O,上层清液中滴加淀粉溶液,无明显变化,则表明不生成I2,化学方程式是。
【小问6详解】
依据发生的反应,可建立如下关系式:CuI——Na2S2O3,n(CuI)=n(Na2S2O3)= bml∙L-1×V×10-3L=bV×10-3ml,则该样品纯度为=。如果其他操作均正确,若选用的Na2S2O3标准液部分被氧化变质,则消耗Na2S2O3溶液的体积偏大,测得结果偏高。
【点睛】使用布氏漏斗和过滤瓶的过滤叫抽滤或吸滤,属于减压过滤,不适合胶状沉淀与水的分离。
17. 回答下列问题
(1)工业以煤为燃料时,会产生大量的羰基硫,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
i氢解反应:
ii水解反应:
请回答下列问题:
①的电子式为_________,分子中碳元素的化合价为_________。
②已知:
写出表示燃烧热的热化学方程式:___________________________。
(2)①常温下,水解常数,若与溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则_________。
②已知,小王网购了一盆杜鹃花,客服告诉小王要定期施用肥料。由此可知,杜鹃花适宜种植在_________土壤中(填“酸性”、“中性”或“碱性”)。通过计算说明判断的依据是__________________。
(3)用间接电解法对进行无害化处理,其原理如图所示。
①电极I的电极反应式为__________________。
②每处理,电解池中产生的氧气的质量为_________g。
【答案】17. ①. ②. ③.
18. ①. ②. 酸性 ③. 溶液中存在,存在,,电离程度大于水解程度,溶液呈酸性。
19. ①. ②. 16
【解析】
【小问1详解】
①的电子式为,由于分子中硫元素和氧元素都是-2价,所以碳元素的化合价为。
②CO燃烧热的方程式需要保证CO的系数为1,所以方程式为,假设为反应iii,结合题中反应i和ii,利用盖斯定律可以得到CO燃烧的焓变计算为,所以燃烧热的热化学方程式。
【小问2详解】
①电荷守恒:,由于混合后溶液呈中性,所以氢离子和氢氧根离子浓度相等,所以
物料守恒:,所以
由于溶液呈中性,,解得
②酸性溶液中存在,,存在
,,电离程度大于水解程度,溶液呈酸性。
【小问3详解】
根据电解池的物质转化,电极Ⅱ产生了氧气,所以电极Ⅱ是阳极,电极Ⅰ是阴极。
①电极Ⅰ是阴极,转化成,所以电极反应式为:。
②阳极的电极方程式为,根据得失电子守恒,将一氧化氮转化为氮气,当处理时,转移电子为,生成的氧气为,质量为。
18. 甲氧氯普胺H是一种止吐药和保肝药,其合成路线如下:
回答下列问题:
(1)A的化学名称是_________。
(2)写出由C生成D的化学方程式__________________。
(3)由D生成E的反应类型为_________。C中不含氧官能团的名称是_________。
(4)最多能与_________反应。
(5)F的结构简式为__________________。
(6)化合物I为B的同系物,相对分子质量比B大28,符合下列条件的I的同分异构体有_________种(不考虑对映异构)。
①能与溶液发生显色反应;
②和连在同一个碳原子上。
满足上述条件的同分异构体中,核磁共振氢谱显示,峰面积比为的结构简式为_________。
【答案】18. 对硝基甲苯或4-硝基甲苯
19. 20. ①. 取代反应 ②. 氨基
21. 4 22.
23. ①. 16 ②.
【解析】
【详解】A经多步转化生成B,涉及甲基氧化,苯环上的取代反应,以及硝基的还原;B与甲醇发生取代反应生成C(),C与在乙醇溶液中发生取代反应生成D,D发生酚羟基上的取代反应生成E,E与氯气发生苯环的取代反应生成F,结合G的结构简式可知F为,F与流程中物质发生取代反应生成G,G中酰胺基发生水解反应生成H,据此分析解答;
(1)由A的结构简式可知,A的名称为对硝基甲苯或4-硝基甲苯:
(2)C与在乙醇溶液中发生取代反应生成D,反应方程式为:
(3)D发生酚羟基上的取代反应生成E,C中不含氧官能团为氨基
(4)中含酰胺基和碳氯键能与反应,其中酰胺基消耗,苯环上连接氯原子消耗,则消耗;
(5)由以上分析可知F为;实验操作及现象
结论
A
向氢氧化铁胶体中插入碳棒,连接直流电源,连接负极的碳棒周围颜色变深
氢氧化铁胶体带正电
B
常温下,将均为2的溶液和溶液分别与相同大小的片反应,溶液产生气体平均速率较快
酸性:
C
向淀粉溶液中加入稀硫酸,加热,一段时间后,冷却,再加入新制的,加热,未出现砖红色沉淀
淀粉未水解
D
点燃氯气,然后把导管伸入盛有氢气的集气瓶,产生苍白色火焰,集气瓶口有白雾
白雾是盐酸小液滴
氢氧化物
开始沉淀
7.5
1.6
4.0
沉淀完全
9.7
3.1
5.5
实验
实验操作及现象
I
取少量CuI放入试管中,加入KI浓溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀
Ⅱ
取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀,过滤,向所得上层清液中滴加淀粉溶液,无明显变化:将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液
2024重庆市七校联盟高三下学期第一次月考试题化学图片版含解析: 这是一份2024重庆市七校联盟高三下学期第一次月考试题化学图片版含解析,文件包含重庆市七校联盟2023-2024学年高三下学期第一次月考化学docx、高三化学答案pdf等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。
重庆市七校联盟2023-2024学年高三下学期第一次月考化学试题: 这是一份重庆市七校联盟2023-2024学年高三下学期第一次月考化学试题,共17页。试卷主要包含了考试结束后,将答题卷交回,可能用到的相对原子质量,用代表阿伏伽德罗常数的值等内容,欢迎下载使用。
重庆市第七中学2023-2024学年高三下学期2月月考化学试题(Word版附解析): 这是一份重庆市第七中学2023-2024学年高三下学期2月月考化学试题(Word版附解析),文件包含重庆市第七中学2023-2024学年高三下学期2月月考化学试题原卷版docx、重庆市第七中学2023-2024学年高三下学期2月月考化学试题Word版含解析docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。












