
柳州高级中学2023-2024学年高一上学期期末考试化学试卷(含答案)
展开
这是一份柳州高级中学2023-2024学年高一上学期期末考试化学试卷(含答案),共13页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.化学在生活、生产、科研等方面发挥着重要的作用。下列说法正确的是( )
A.“84”消毒液和洁厕灵(主要成分是HCl)混合使用,清洁效果更好
B.人类利用金属的历史顺序(铜→铁→铝)跟地壳中金属元素的含量有关
C.《本草经集注》记载硝石“以火烧之,紫青烟起”涉及焰色试验
D.病毒可以通过气溶胶传播,说明病毒的直径一定在1nm以下
2.下列化学用语不正确的是( )
A.Mg的原子结构示意图是:
B.的电子式是:
C.分子结构模型是:
D.NaCl的形成过程是:
3.设为阿伏伽德罗常数的值。下列说法正确的是( )
A.11g和的混合物中含有的离子数目为
B.标准状况下,4.48L所含的分子数为
C.一定条件下,32g与足量反应,转移的电子数为
D.溶液中含有的氧原子数为
4.下列说法正确的是( )
①、、属于碱性氧化物,、都能和碱溶液发生反应,属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖和食醋分别属于非电解质、电解质
④二氧化硫具有漂白性,可使紫色石蕊试液褪色
⑤是发酵粉主要成分之一,可治疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑥B.④⑤C.②④D.②⑥
5.金属及其化合物的转化关系是化学学习的重要内容之一、下列各组物质的转化关系,不能均由一步反应实现的是( )
A.B.
C.D.
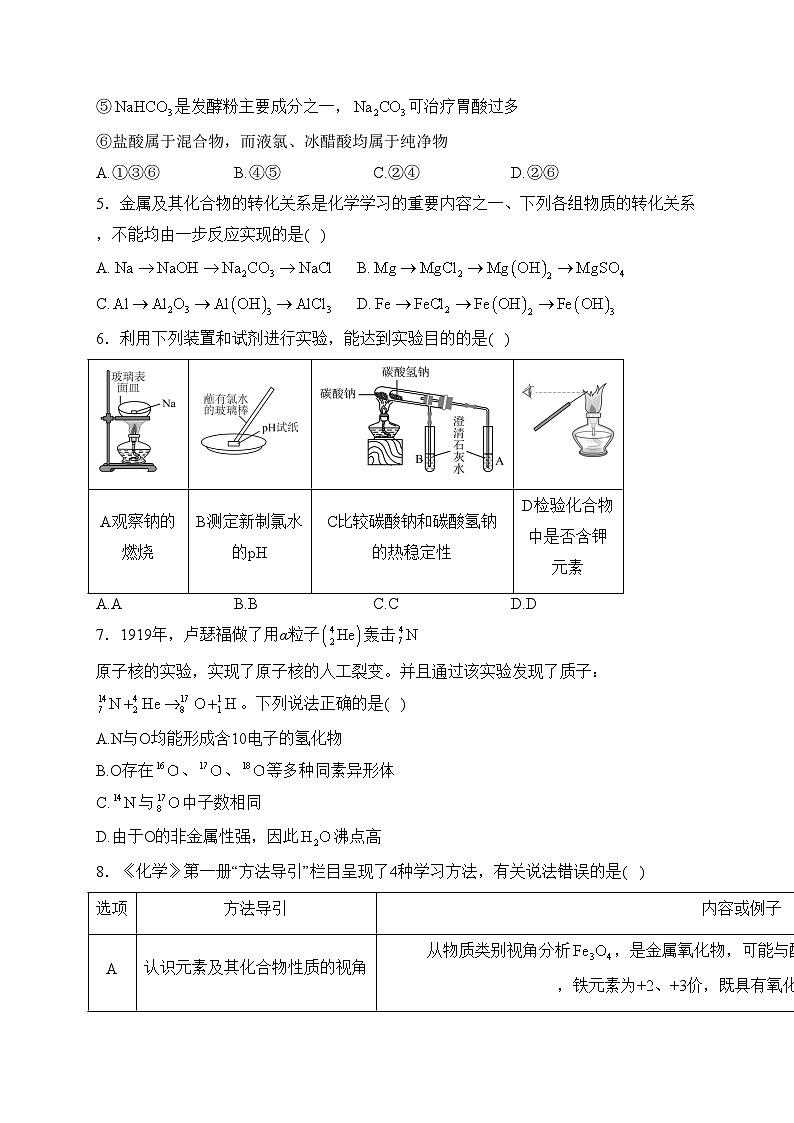
6.利用下列装置和试剂进行实验,能达到实验目的的是( )
A.AB.BC.CD.D
7.1919年,卢瑟福做了用α粒子轰击原子核的实验,实现了原子核的人工裂变。并且通过该实验发现了质子:。下列说法正确的是( )
A.N与O均能形成含10电子的氢化物
B.O存在、、等多种同素异形体
C.与中子数相同
D.由于O的非金属性强,因此沸点高
8.《化学》第一册“方法导引”栏目呈现了4种学习方法,有关说法错误的是( )
A.AB.BC.CD.D
9.短周期主族元素X、Y、Z、W、T原子序数依次增大,分占三个不同的周期,Y是地壳中含量最多的元素,Z原子的最外层只有一个电子,W位于元素周期表ⅢA族,T与Y属于同一主族元素。下列说法正确的是( )
A.原子半径:
B.Z的最高价氧化物对应的水化物的碱性比W的弱
C.Y的简单气态氢化物的热稳定性比T的强
D.Y、Z只能形成一种化合物
10.下列各组溶液中的离子能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正确的是( )
A.AB.BC.CD.D
11.某反应涉及7种粒子:、、、、、、,其中是产物,其对应的化学计量数为5,下列说法正确的是( )
A.氧化剂为
B.失去电子的元素是Pb
C.随着反应进行,溶液的酸性增强
D.氧化剂与还原剂的化学计量数之比为5:2
12.如图是某硫酸试剂瓶上的部分内容。下列说法正确的是( )
A.该硫酸的物质的量浓度为
B.实验室需要的稀硫酸,配制时应量取该硫酸62.5mL
C.硫酸的摩尔质量为98
D.定容时仰视刻度线,会造成所配溶液浓度偏高
13.为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,下列说法错误的是( )
A.黑色化合物A反应生成C和D最多可消耗392mL(标准状况)
B.无色气体D能漂白品红溶液,总共产生224mL(标准状况)无色气体D
C.将无色气体D全部通入黄色溶液E中,溶液变成浅绿色,且无色气体D有剩余
D.化合物X的电子式为
二、多选题
14.一种液化石油气在活性炭作用下脱硫机理如图所示,下列说法正确的是( )
A.总反应为
B.在25℃,101kPa下,反应中每转移,消耗
C.反应过程中有极性键和非极性键的断裂
D.的分子结构模型为
三、填空题
15.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。
(1)下图为氯及其化合物的“价类”二维图。图中A的类别为________;B的名称为_________。
(2)已知高氯酸是氯元素的最高价含氧酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式___________。
(3)某同学研究HCl性质,进行如下预测:
①从物质类别上看,HCl属于酸,能与大理石反应,离子方程式为___________;
②从化合价角度看,HCl具有___________(“氧化性”或“还原性”或“氧化性和还原性”),能与___________发生反应。
A.NaClOB.FeC.
(4)新制氯水有漂白性,因为其中含有___________。某同学用强光照射氯水,同时使用数据采集器采集数据如图。该同学采集的数据是___________(填标号)。
A.氯水的pHB.氯离子的浓度C.溶液的电导率D.氧气的体积分数
16.155年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)
(1)在这10种元素中,非金属性最强的元素在周期表中的位置是___________。
(2)由a、d、f三种元素形成的化合物含有的化学键有___________(填写化学键类型),属于___________化合物。
(3)元素b、c形成的简单气态氢化物中较稳定的是___________(写具体的化学式,下同);d、h、i、j的简单离子半径由大到小的顺序排列为___________。
(4)用电子式表示元素g与e的化合物形成的过程___________。
(5)在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5ml/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式:___________。
②a点的数值为:___________mL。
四、实验题
17.实验室为探究铁与浓硫酸的反应,并验证产物的性质,设计如图所示装置进行实验。请回答下列问题:
(1)装置A中反应物不用铁片,而用可抽动的铁丝,这样设计的好处是___________;装置C中发生反应的化学方程式是___________。
(2)实验开始时,装置D不加热,待出现___________现象后再用酒精灯加热。用酒精灯加热的目的是证明___________;实验结束时需从导管a通入大量空气,其目的是________。
(3)实验时将导管a插入试管中,可使装置B中的溶液不发生倒吸。其原因是________。
(4)整个实验涉及到的的性质有___________(填选项);
A.漂白性B.氧化性C.还原性D.酸性氧化物的通性
18.某小组同学探究久置固体变质的情况,并测定其中铁元素的质量分数。将固体用蒸馏水溶解,配成20mL待测液,进行实验。
资料:KSCN中S元素的化合价为-2价:酸性条件下,的还原产物为。
(1)实验一:
①i中溶液略微变红,说明待测液中存在___________。
②ii中溶液颜色逐渐加深的原因是___________。
③由实验一推测固体变质的情况是___________(填字母序号)。
a.未变质b.部分变质c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是___________,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验,请补全①中的操作和②中的现象。
(3)实验三:将固体用蒸馏水溶解,配成20mL待测液,进行实验,测定久置固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是___________(填字母序号)。
a.b.Cuc.Fed.KI
②若消耗溶液3.6mL,则久置固体中铁元素的质量分数是___________。
参考答案
1.答案:C
解析:A.“84”消毒液和洁厕灵(主要成分是HCl)混合使用时,会发生氧化还原反应生成有毒气体氩气,清洁效果减弱,故A错误;
B.人类利用金属的历史顺序(铜→铁→铝)跟金属活泼性有关,铜性质较稳定是人们使用最早的金属,故B错误;
C.钾的焰色试验是紫色,用火烧硝石,是钾的焰色试验,故C正确;
D.新型冠状病毒可能通过气溶胶传播,说明病毒的粒子直径可能在纳米级范围内,多数病毒的直径大于1nm,故D错误;
故选C。
2.答案:B
解析:
3.答案:A
解析:A.和的摩尔质量均为,1个中含有2个钾离子和硫离子,1个中含有2个钾离子和1个过氧根离子,和的物质的量为,则混合物中含有的离子数目为,故A正确;
B.标准状况下,四氯化碳为液体,的物质的量不是,其所含的分子数不是,故B错误;
D.未知溶液的体积,无法计算氧原子的数目,故D错误;
故选:A。
4.答案:D
解析:
5.答案:C
解析:不能由一步反应转化成。
6.答案:C
解析:A.钠燃烧时产生黄色火焰,且生成的过氧化钠与水、二氧化碳反应生成氧气,氧气助燃,所以不能用坩埚钳夹取,应该用镊子夹取,故A错误;
B.氯水中含有次氯酸,次氯酸具有漂白性,能够使pH试纸褪色,所以不能用pH试纸测定氯水的pH,故B错误;
C.碳酸氢钠受热分解生成二氧化碳,二氧化碳能够使澄清石灰水变浑浊,碳酸钠受热不分解,所以可以用图中装置比较碳酸钠和碳酸氢钠的热稳定性,故C正确;
D.钾元素的焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,故D错误;
故选C。
7.答案:A
解析:A.N与O均能形成含10电子的氢化物,分别是氨气和水,故A正确;
B.O存在、、等多种同位素,故B错误;
C.与中子数分别为7和10,不相同,故C错误;
D.由于水分子间存在氢键,因此沸点高,故D错误;
故选A。
8.答案:D
解析:A.从物质类别视角分析、含铁、氧两种元素,是金属氧化物,因此可与酸发生反应;从化合价视角分析,铁元素为+2、+3价,既具有氧化性,也具有还原性,A不符合题意;
B.阿伦尼乌斯提出的电离模型很好的解释了酸、碱、盐溶液的某些性质,属于从模型的角度认识物质的性质,B不符合题意;
C.实验室制备得到的氯气中含有HCl、水蒸气,可依次通过饱和食盐水和浓硫酸除去,才可以得到干燥纯净的氯气,C不符合题意;
D.锂和钠均为元素周期表ⅠA族元素,钠单质与氧气在加热条件下反应生成过氧化钠,但锂单质与氧气在加热条件下反应只能生成氧化锂,而不生成过氧化锂,该预测不准确,D符合题意;
故答案选D。
9.答案:C
解析:A.根据同一周期从左往右原子半径依次减小,同一主族从上往下原子半径依次增大,故原子半径为:即,A错误;
B.已知Na的金属性强于Al,故Z的最高价氧化物对应的水化物即NaOH的碱性比W的即强,B错误;
C.已知O的非金属性比S的强,故Y的简单气态氢化物即的热稳定性比T即的强,C正确;
D.由分析可知,Y为O,Z为Na,则Y、Z形成一种化合物有和等,D错误;
故答案为:C.
10.答案:B
解析:
11.答案:D
解析:A.在反应中,是氧化剂,则是还原产物,A不正确;
B.反应中,从元素的价态变化看,Pb元素由+4价降低为+2价,则Pb元素得到电子,B不正确;
C.随着反应进行,不断被消耗,则溶液的酸性不断减弱,C不正确;
D.反应中,为氧化剂,为还原剂,则氧化剂与还原剂的化学计量数之比为5:2,D正确;
故选D。
12.答案:B
解析:B.由于溶液在稀释前后溶质的物质的量不变,所以根据稀释后溶液的浓度及体积可知溶质的物质的量,则需要浓硫酸的体积,故B正确。
13.答案:B
解析:B.S燃烧生成二氧化硫,二氧化硫具有漂白性,能漂白品红溶液,根据S元素守恒,总共产生0.02ml,标准状况下的体积为448mL,故B错误。
14.答案:AC
解析:A.根据机理如图可知,总反应:,A正确;
B.25℃,101kPa不是标准状况,不能用气体摩尔体积进行计算,B错误;
C.,断裂极性键;,断裂非极性键,C正确;
D.S原子半径大于H原子半径,分子结构模型不符合原子半径大小规律,D错误;
答案选AC。
15.答案:(1)单质;次氯酸
(2)
(3)①;②氧化性和还原性;ABC
(4)HClO或次氯酸;A
解析:
16.答案:(1)第二周期第ⅦA族
(2)离子键和极性共价键;离子
(3);
(4)
(5)①或;②160
解析:(1)元素周期表中,同族元素,从上到下,非金属性减小;同周期元素从左到右非金属性增大,则非金属性最强的元素为F,位于第二周期第ⅦA族;
(2)a为H,d为O,f为Na,形成的化合物为NaOH,为离子型化合物,含有离子键和共价键;
(3)b为C,c为N,非金属性增加,气态氢化物稳定性增强,元素b、c形成的简单气态氢化物中较稳定的是;判断粒子半径先比较电子层数,电子层数越多,半径越大,当电子层相等时比较核电荷数,核电荷数越大,半径越小,所以d、h、i、j的简单离子半径由大到小的顺序排列为。
17.答案:(1)可有效控制反应发生和停止;
(2)品红溶液由红色褪为无色;的漂白产物不稳定(或的漂白是不稳定的、可恢复的);使装置中残留的气体完全被装置E中的NaOH溶液吸收,以防止污染环境
(3)装置A中试管内气压减小时,空气可从导管a进入装置A,导管a起平衡气压的作用
(4)ABCD
解析:(1)装置A中反应物不用铁片,而用可抽动的铁丝,可有效控制反应发生和停止;装置C中二氧化硫和硫化氢反应生成S沉淀和水,发生反应的化学方程式是;
(2)实验开始时,装置D不加热,待出现品红溶液由红色褪为无色后再用酒精灯加热。用酒精灯加热的目的是证明的漂白产物不稳定;二氧化硫有毒,实验结束时需从导管a通入大量空气,使装置中残留的气体完全被装置E中的NaOH溶液吸收,以防止污染环境;
(3)实验时将导管a插入试管中,装置A中试管内气压减小时,空气可从导管a进入装置A,导管a起平衡气压的作用,可使装置B中的溶液不发生倒吸;
(4)高锰酸钾溶液褪色,证明二氧化硫具有还原性;溶液变浑浊,证明二氧化硫具有氧化性;品红溶液褪色,证明二氧化硫具有漂白性;用氢氧化钠溶液吸收二氧化硫,证明二氧化硫是酸性氧化物,具有酸性氧化物的通性,故选ABCD。
18.答案:(1)①;②溶液中的被氯水氧化,造成的浓度增大;③b
(2)具有还原性,与氯气发生氧化还原反应而损耗;①滴加NaOH(或KOH、氨水等)溶液;②无明显现象
(3)①b;②33.6%
解析:(1)①i中溶液略微变红,说明生成硫氰化铁,则待测液中存在;
③由实验一推测溶液中含有和,固体部分变质,故答案为:b;
(2)滴加氯水红色褪去的可能的原因是具有还原性,与氯气发生氧化还原反应,实验②中滴加氯化铁溶液,由于溶液中没有硫氰化钾,则无明显现象。
A观察钠的燃烧
B测定新制氯水的pH
C比较碳酸钠和碳酸氢钠的热稳定性
D检验化合物中是否含钾元素
选项
方法导引
内容或例子
A
认识元素及其化合物性质的视角
从物质类别视角分析,是金属氧化物,可能与酸发生反应;从化合价视角分析,铁元素为+2、+3价,既具有氧化性,也具有还原性
B
模型
阿伦尼乌斯提出的电离模型很好的解释了酸、碱、盐溶液的某些性质
C
实验室制取气体装置设计
实验室制备的氯气依次通过饱和食盐水和浓硫酸的除杂装置,可以得到干燥纯净的氯气
D
预测
锂和钠均为元素周期表ⅠA族元素,可预测出:在加热条件下,锂单质与氧气反应也可以生成过氧化锂
选项
离子组
X试剂
离子方程式
A
少量氨水
B
过量铜粉
少量氯气
D
足量氯气
序号
操作
现象
①
___________
产生红褐色沉淀
②
滴加溶液
___________
相关试卷
这是一份广西柳州市铁二中学2023-2024学年高一上学期期末考试化学科试卷(无答案),共6页。试卷主要包含了5 C-12 O-16,2L中含有原子数为从等内容,欢迎下载使用。
这是一份广西柳州市柳州高级中学2023-2024学年高一上学期期末考试化学试题,文件包含广西柳州市柳州高级中学2023-2024学年度上学期2023级高一期末考试化学试题pdf、广西柳州市柳州高级中学2023-2024学年度上学期2023级高一期末考试化学答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
这是一份广西柳州市高中2023-2024学年高一上学期期末考试化学试题(含答案),共11页。试卷主要包含了5 K-39 Fe-56等内容,欢迎下载使用。









