

山西省阳泉市2023-2024学年高一上学期期末教学质量监测化学试卷(含答案)
展开一、单选题
1.化学与生活紧密相关,下列有关说法不正确的是( )
A.雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
B.作补血剂时可与维生素C同时服用
C.生铁的含碳量比钢的含碳量低
D.漂白粉长期露置在空气中会失效
2.生产生活中经常用到电解质。下列物质不属于电解质的是( )
A.NaOHB.C.D.Mg
3.下列元素中,非金属性最强的是( )
A.氯(Cl)B.氟(F)C.碘(I)D.溴(Br)
4.下列关于物质分类的叙述中,不正确的是( )
A.纯碱属于碱B.HClO属于酸C.属于氧化物D.苛性钾属于碱
5.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿B.家中用的铁质菜刀生锈
C.大理石雕像被酸雨腐蚀毁坏D.充有氢气的气球遇明火爆炸
6.25℃时,下列各组离子在的无色溶液中一定能大量共存的是( )
A.、、、B.、、、
C.、、、D.、、、
7.设为阿伏伽德罗常数的值,下列叙述正确的是( )
的中,含有个中子
B.常温常压下,所含分子数为
C.标准状况下,中含有的原子数为
与完全反应,转移的电子数为
8.下列有关物质性质的比较正确的是( )
A.碱性:B.离子半径:
C.热稳定性:D.还原性:
9.水是常用的试剂。下列反应中水作氧化剂的是( )
A.氯气溶于水B.钠与水反应C.氧化钙与水反应D.二氧化碳溶于水
10.钠在工业上有重要用途。下列有关钠的叙述不正确的是( )
A.有银白色金属光泽B.在空气中很快生成
C.燃烧发出明亮的黄色火焰D.将Na投入溶液中可置换出Fe
11.85号元素砹(At)原子核外最外层有7个电子。下列有关说法不正确的是( )
A.At中子数为127的核素符号是
B.At位于第六周期第ⅦA族
C.酸性强弱:
D.与很难直接化合,HAt不能稳定存在
12.下列有关氯气说法正确的是( )
A.氯水放置一段时间,pH值减小
B.干燥的氯气不能使有色鲜花褪色
C.氯气有毒,所以生产生活中都严禁使用
D.少量氯气与铁在一定条件下反应可生成氯化亚铁
13.下列除杂的方法(括号里为少量杂质)中,所用试剂或操作不正确的是( )
A.:加入足量NaOH溶液,过滤
B.溶液:通入足量的
C.溶液:通入足量的氯气
D.:将气体通过盛有饱和溶液的洗气瓶
14.表示下列反应的离子方程式正确的是( )
A.铁跟稀硫酸反应:
B.溶液和NaOH溶液反应:
C.氢氧化钡溶液和稀硫酸反应:
D.向澄清石灰水中通入少量:
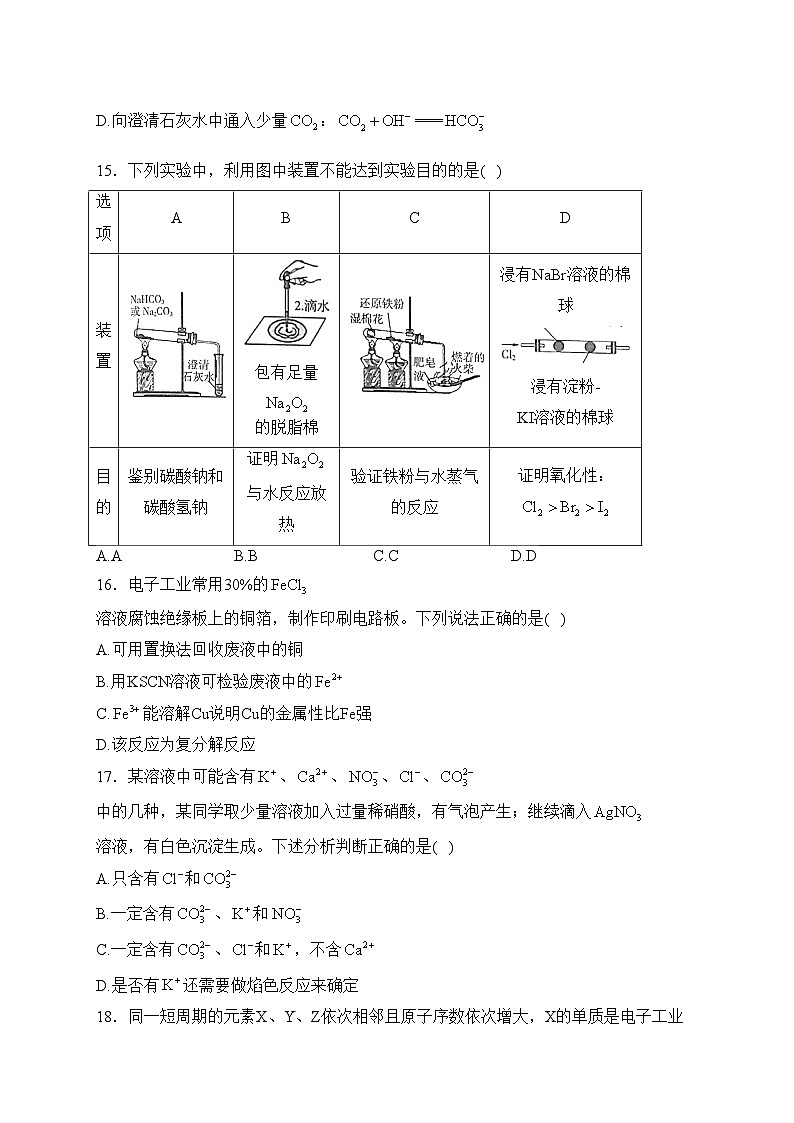
15.下列实验中,利用图中装置不能达到实验目的的是( )
A.AB.BC.CD.D
16.电子工业常用30%的溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是( )
A.可用置换法回收废液中的铜
B.用KSCN溶液可检验废液中的
C.能溶解Cu说明Cu的金属性比Fe强
D.该反应为复分解反应
17.某溶液中可能含有、、、、中的几种,某同学取少量溶液加入过量稀硝酸,有气泡产生;继续滴入溶液,有白色沉淀生成。下述分析判断正确的是( )
A.只含有和
B.一定含有、和
C.一定含有、和,不含
D.是否有还需要做焰色反应来确定
18.同一短周期的元素X、Y、Z依次相邻且原子序数依次增大,X的单质是电子工业不可或缺的半导体材料。下列说法正确的是( )
A.元素Y的气态氢化物的还原性比X的强
B.元素Z的气态氢化物电子式为
C.原子半径的大小顺序:
D.X、Y、Z均易形成单原子阴离子
19.向某浓度的溶液中,滴入稀,溶液电导率随时间变化的曲线如图所示。下列分析正确的是( )
A.溶液中存在的主要微粒有:、、
B.a、b、c中,最大的一定是a
C.a→b过程中发生的主要反应是
D.b→c过程中电导率增加是因为电离出和
20.纳米级可用于以太阳能为热源分解水制,过程如下图所示。下列说法正确的是( )
A.过程Ⅰ的反应为:
B.过程Ⅰ中Fe元素化合价升高,被氧化
C.过程Ⅱ中为还原剂
D.整个过程的总反应为
二、填空题
21.化学与生产、生活息息相关。请回答下列问题:
(1)小苏打是常用的食品添加剂,烘焙面包时可用它做膨松剂,还可以调节酸度,写出调领闹节酸度时的离子反应方程式__________。
(2)汽车尾气的主要成分是CO和NO,加入适当催化剂,可使两者反应生成和另种无毒的气体,写出反应的化学方程式__________,做还原剂的是__________。
(3)工业上常用稀盐酸清洗锅炉内壁的水垢(主要成份是碳酸钙和氢氧化钠),请写出反应的离子方程式__________(写出一个即可)。
(4)工业废水中含有的重铬酸根离子有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,反应的离子方程式如下:
该离子方程式中的X应为__________(填微粒符号),当反应转移了1ml电子时,生成的物质的量为__________(保留两位有效数字)。
22.下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置。
请回答下列问题:
(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是__________。
(2)由元素②和元素④形成原子个数比为1:2的化合物的电子式为________。
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为__________。
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是__________(填化学式,用“>”连接)。
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为__________。
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是__________。
23.Ⅰ.化学小组的同学用10ml/L的浓硫酸配制100mL物质的量浓度为的稀硫酸,以备实验使用。
(1)需要量取__________mL上述浓硫酸进行配制。
(2)为配制上述稀硫酸,除了量筒、烧杯、胶头滴管外,还需用到的玻璃仪器是__________。
(3)下列实验操作可能导致配制的硫酸溶液浓度偏高的是__________(填序号)。
a.定容时俯视观察
b.往容量瓶转移时,有少量液体溅出
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
Ⅱ.化学小组同学通过实验探究某补铁药品中含亚铁盐,实验过程如下:
(1)取一定量药品溶于水,静置,过滤,得澄清溶液。
(2)甲同学取少量溶液,先加入2滴KSCN溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红。氯水与亚铁盐反应的离子方程式为__________。
(3)乙同学也取少量溶液,滴加NaOH溶液,有沉淀生成;将其露置于空气中可观察到的现象是__________;产生该现象原因是__________(用化学方程式解释)。
(4)丙同学取少量甲同学实验后的溶液,加入过量铁粉,溶液红色又消失。此实验能证明的是__________。
24.随着科学技术的进步,科学家研究出了种类繁多的合金来满足各行各业的需求。称取某镁铝合金6.3g放入过量氢氧化钠溶液中,制得(标准状况下),试回答:
(1)目前用量最大的合金是__________;常见的一些合金硬度比其成分金属的__________。
(2)该合金中镁铝的物质的量之比是多少__________(写出计算过程)。
三、实验题
25.实验室可用如图装置制备无水。已知易升华,易吸收水分而潮解。
请回答下列问题:
(1)装置A中盛放浓盐酸的仪器名称是__________;连接好仪器后首先应进行的操作是__________。
(2)A装置中发生反应的离子方程式为__________;当加入一定量的浓盐酸与足量反应完全后,实际生成的体积__________(填“大于”“小于”或“等于”)理论值。
(3)装置B的作用一是检验后续装置是否堵塞,二是__________。
(4)G中发生反应的离子方程式为__________。
(5)F中所装试剂为__________,目的是__________。
参考答案
1.答案:C
解析:A.雾是一种气溶胶,光束透过大雾可观察到丁达尔效应,故A正确;
B.维生素C具有还原性,作补血剂时与维生素C同时服用,可提高吸收效果,故B正确;
C.生铁的含碳量比钢的含碳量高,故C错误;
D.漂白粉长期露置在空气中,次氯酸钙和二氧化碳反应生成次氯酸,次氯酸分解生成盐酸和氧气,所以漂白粉会失效,故D正确;
选C。
2.答案:D
解析:A.NaOH的水溶液能导电,NaOH属于电解质,故不选A;
B.的水溶液能导电,属于电解质,故不选B;
C.的水溶液能导电,属于电解质,故不选C;
D.Mg是金属单质,既不是电解质又不是非电解质,故选D;
选D。
3.答案:B
解析:F、Cl、Br、I同为第ⅦA族的元素,且周期序数逐渐增大,而同主族从上到下,非金属性逐渐减弱,故非金属性最强的是F,故选:B。
4.答案:A
解析:A.纯碱是碳酸钠的俗称,碳酸钠不能电离出氢氧根离子,不属于碱,属于盐,故A错误;
B.次氯酸在溶液中电离出的阳离子全部是氢离子,属于酸,故B正确;
C.氧化铁是由氧元素和铁元素组成的纯净物,属于氧化物,故C正确;
D.苛性钾是氢氧化钾的俗称,氢氧化钾电离出的阴离子全部是氢氧根离子,属于碱,故D正确;
故选A。
5.答案:C
解析:
6.答案:B
解析:A.、在酸性条件下不能大量共存,A错误;
B.、、、在酸性条件下能大量共存,B正确;
C.有颜色,C错误;
D.、、在酸性条件下不能大量共存,D错误;
故选B。
7.答案:A
解析:
8.答案:D
解析:
9.答案:B
解析:A.氯气溶于水生成盐酸和次氯酸,水中元素化合价不变,水既不是氧化剂又不是还原剂,故不选A;
B.钠与水反应生成氢氧化钠和氢气,水中H元素化合价降低,水是氧化剂,故选B;
C.氧化钙与水反应生成氢氧化钙,元素化合价均不变,属于非氧化还原反应,故不选C;
D.二氧化碳溶于水生成碳酸,元素化合价均不变,属于非氧化还原反应,故不选D;
选B。
10.答案:D
解析:A.Na具有银白色的金属光泽,A项正确;
B.新切开的钠的光亮的表面很快变暗,是因为Na在空气中很快与氧气反应生成,B项正确;
C.Na与剧烈反应,燃烧时发出明亮的黄色火焰,生成淡黄色固体,C项正确;
D.Na投入溶液中,Na先与水反应生成NaOH和,然后NaOH和反应生成和,不可能置换出Fe,D项错误;
答案选D。
11.答案:C
解析:A.At中子数为127的核素符号是,故A正确;
B.At位于第六周期第ⅦA族,故B正确;
C.同主族从上到下,最高价氧化物对应水化物的酸性逐渐减弱,酸性强弱:,故C错误。
12.答案:A
解析:A.氯水放置一段时间,HClO分解出HCl,pH值减小,故A正确;
B.干燥的氯气遇鲜花上的水会反应生成HClO,HClO具有漂白性,能使有色鲜花褪色,故B错误;
C.氯气有毒,生产中用氯气制备漂白液等,并不是禁止使用,故C错误;
D.铁在氯气中点燃生成氯化铁,不会生成氯化亚铁,故D错误;
故选A。
13.答案:D
解析:A.氧化铝与NaOH溶液反应,氧化铁不反应,则加入NaOH溶液再过滤可除杂,故A正确;
B.碳酸钠溶液与二氧化碳反应生成碳酸氢钠,则通入过量的可除杂,故B正确;
C.氯化亚铁与氯气反应生成氯化铁,则通入足量的氯气可除杂,故C正确;
D.二氧化碳、氯化氢均与碳酸钠溶液反应,将原物质除去,不能除杂,应选饱和碳酸氢钠溶液、洗气,故D错误;
故选:D。
14.答案:B
解析:
15.答案:D
解析:A.只有碳酸氢钠加热分解生成二氧化碳,二氧化碳可使石灰水变浑浊,而碳酸钠加热不分解,可鉴别,故A正确;
B.过氧化钠与水反应放热,且生成氧气可助燃,脱脂棉燃烧可证明反应为放热反应,故B正确;
C.Fe与水蒸气高温下反应生成氢气,氢气具有可燃性,点燃肥皂泡可验证铁粉与水蒸气的反应,故C正确;
D.氯气可分别与NaBr、KI反应,由实验不能比较溴、碘的氧化性,故D错误;
故选:D。
16.答案:A
解析:A.向反应后溶液中加入铁粉,铁与氯化铜溶液发生置换反应生成氯化亚铁和铜,所以可用置换法回收废液中的铜,故A正确;
B.溶液中亚铁离子不能与硫氰酸根离子反应,所以不能用硫氰化钾溶液检验废液中的亚铁离子,故B错误;
C.溶液中铁离子能溶解铜,说明铁离子的氧化性强于铜离子,但不能比较铁和铜的金属性强弱,故C错误;
D.制作印刷电路板发生的反应中有元素发生化合价变化,属于氧化还原反应,不属于复分解反应,故D错误;
故选A。
17.答案:C
解析:溶液中加入过量稀硝酸,有气泡产生,说明溶液中含有;继续滴入溶液,有白色沉淀生成,说明溶液中含有;由于稀硝酸过量,所以不能确定是否含有;由于与不能大量共存,所以溶液中一定不含。
18.答案:C
解析:C.同周期从左至右半径依次减小,原子半径的大小顺序,C正确;
D.X最外层四个电子不易得或失电子不易形成单原子阴离子,D错误;
故选C。
19.答案:B
解析:B.a、b、c中,随着逐滴加入稀硫酸至过量,逐渐减小,最大的一定是a,故B正确;
故选:B。
20.答案:D
解析:结合图示可知,过程Ⅰ的反应是在太阳能的作用下生成FeO和,反应为,A项错误;
过程Ⅰ的反应中铁元素化合价降低,被还原,B项错误;
过程Ⅱ为FeO与水反应生成和,氢气为还原产物,C项错误;
根太阳能据以上分析可知总反应为,D项正确。
21.答案:(1)
(2);CO(或一氧化碳)
(3)[或]
(4);0.33ml
解析:(1)小苏打为,可与反应生成和,方程式为;
(2)CO和NO,加入适当催化剂,两者反应生成和,根据得失电子守恒、原子守恒配平该方程式为:,其中失电子的CO为还原剂;
(3)碳酸钙、氢氧化镁均能与稀盐酸发生复分解反应,方程式分别为,。
22.答案:(1)
(2)
(3)
(4)
(5)
(6)溶液由无色逐渐变棕黄色
解析:
23.答案:Ⅰ.(1)7.0
(2)玻璃棒、100mL容量瓶
(3)ac
Ⅱ.(2)
(3)白色沉淀迅速变成灰绿色,最后变成红褐色;
(4)三价铁离子有氧化性能与铁粉反应生成亚铁离子
解析:Ⅱ.(2)溶液,先加入2滴KSCN溶液,溶液无明显变化;再加入几滴新制氯水,溶液变红,说明生成,氯水与亚铁盐反应的离子方程式为;
(3)和NaOH生成,在空气中被氧化,白色沉淀迅速变成灰绿色,最后变成红褐色,产生该现象原因是;
(4)量甲同学实验后的溶液含有,三价铁离子有氧化性能与铁粉反应生成亚铁离子,溶液红色又消失。
24.答案:(1)钢;大(或“高”、“强”)
(2)3:2
解析:(2)
25.答案:(1)分液漏斗;检查装置的气密性
(2);小于
(3)除去中的HCl气体
(4)
(5)浓硫酸;防止G中的水蒸气进入导致吸水潮解
解析:(1)根据装置图,装置A中盛放浓盐酸的仪器名称是分液漏斗;该装置制备氯气,连接好仪器后首先应进行的操作是检查装置的气密性;
(2)A装置中二氧化锰和浓盐酸反应生成氯化锰、氯气、水,发生反应的离子方程式为;二氧化锰和稀盐酸不反应,当加入一定量的浓盐酸与足量反应完全后,盐酸不能完全反应,实际生成的体积小于理论值;
(3)A中生成的氯气含有杂质氯化氢,氯化氢与铁反应干扰实验,所以装置B中盛放饱和食盐水,作用一是检验后续装置是否堵塞,二是除氯气中的HCl;
(4)G中氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水,发生反应的离子方程式为;
(5)易吸收水分而潮解,F的作用是防止G中的水蒸气进入E导致吸水潮解,F中所装试剂为浓硫酸。
选项
A
B
C
D
装置
包有足量的脱脂棉
浸有NaBr溶液的棉球
浸有淀粉-KI溶液的棉球
目的
鉴别碳酸钠和碳酸氢钠
证明与水反应放热
验证铁粉与水蒸气的反应
证明氧化性:
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
⑤
3
⑥
⑦
⑧
4
⑨
贵州贵阳市2023-2024学年高一上学期期末监测化学试卷(含答案): 这是一份贵州贵阳市2023-2024学年高一上学期期末监测化学试卷(含答案),共10页。试卷主要包含了24等内容,欢迎下载使用。
福建泉州2023-2024学年高一上学期普通高中教学质量监测化学试卷: 这是一份福建泉州2023-2024学年高一上学期普通高中教学质量监测化学试卷,文件包含2023-2024学年度上学期泉州市普通高中教学质量监测高一化学试卷pdf、2023-2024学年度高一上学期泉州市普通高中教学质量监测化学试卷参考答案pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
10,山西省阳泉市2023-2024学年高一上学期期末教学质量监测化学试题: 这是一份10,山西省阳泉市2023-2024学年高一上学期期末教学质量监测化学试题,共6页。












