




2024山东中考复习 人教版化学 题型突破 题型四 工艺流程题 课件
展开Fe+CuSO4 FeSO4+Cu
类型1 生产制备流程【典题1】(2023·广安中考)中国古代典籍中记录了很多化学知识,展示了我国古代人民的智慧。《梦溪笔谈》中记载了用“苦泉水”制取铜的方法:“挹其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”主要流程如图所示:(1)“熬”的过程类似于下列粗盐提纯实验中的______操作(填字母)。 A.溶解 B.过滤 C.蒸发(2)“烹”的过程中,胆矾(CuSO4·5H2O)首先转变成水和无水硫酸铜,该反应的基本反应类型是 _______反应。 (3)写出“铁釜”中发生反应的化学方程式:____________________________。 (4)铁釜外侧容易生锈,是因为铁与空气中的________________________发生反应。
氧气、水(或O2、H2O)
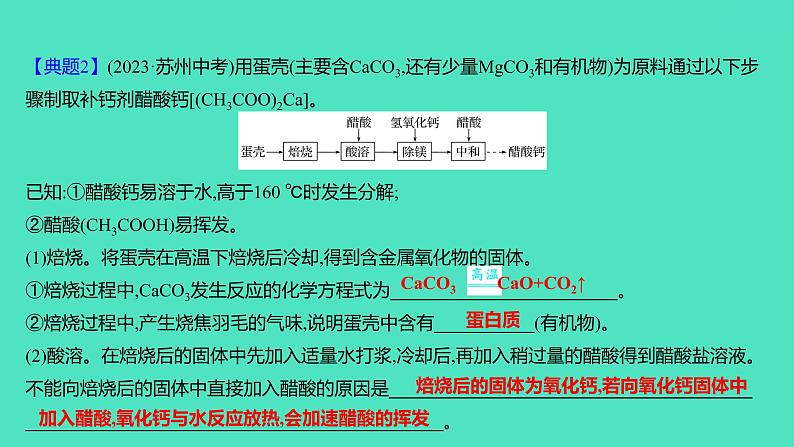
【典题2】(2023·苏州中考)用蛋壳(主要含CaCO3,还有少量MgCO3和有机物)为原料通过以下步骤制取补钙剂醋酸钙[(CH3COO)2Ca]。已知:①醋酸钙易溶于水,高于160 ℃时发生分解;②醋酸(CH3COOH)易挥发。(1)焙烧。将蛋壳在高温下焙烧后冷却,得到含金属氧化物的固体。①焙烧过程中,CaCO3发生反应的化学方程式为_________________________。 ②焙烧过程中,产生烧焦羽毛的气味,说明蛋壳中含有___________(有机物)。 (2)酸溶。在焙烧后的固体中先加入适量水打浆,冷却后,再加入稍过量的醋酸得到醋酸盐溶液。不能向焙烧后的固体中直接加入醋酸的原因是______________________________________________________________________________________。
焙烧后的固体为氧化钙,若向氧化钙固体中
加入醋酸,氧化钙与水反应放热,会加速醋酸的挥发
CaCO3 CaO+CO2↑
(3)除镁。在酸溶后的溶液中加入Ca(OH)2至碱性,将(CH3COO)2Mg 转化为Mg(OH)2沉淀除去。该反应属于_______________(填基本反应类型)。 (4)中和。在除镁后的溶液中加入醋酸调节溶液pH为7。其目的有①将溶液中的少量Ca(OH)2转化为(CH3COO)2Ca;②_________________________________。 (5)将中和后的溶液蒸发浓缩至有大量晶体析出,过滤得到醋酸钙晶体。蒸发时不能直接将溶液蒸干的原因是_______________________________。
防止溶液吸收空气中的二氧化碳
醋酸钙高于160 ℃时发生分解
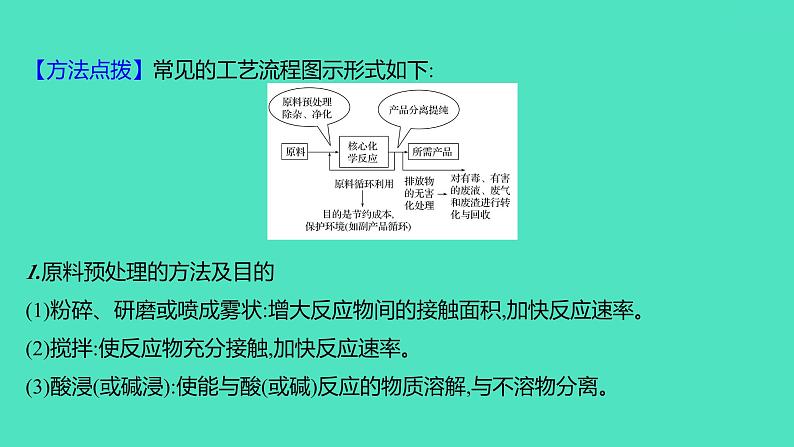
【方法点拨】常见的工艺流程图示形式如下:1.原料预处理的方法及目的(1)粉碎、研磨或喷成雾状:增大反应物间的接触面积,加快反应速率。(2)搅拌:使反应物充分接触,加快反应速率。(3)酸浸(或碱浸):使能与酸(或碱)反应的物质溶解,与不溶物分离。
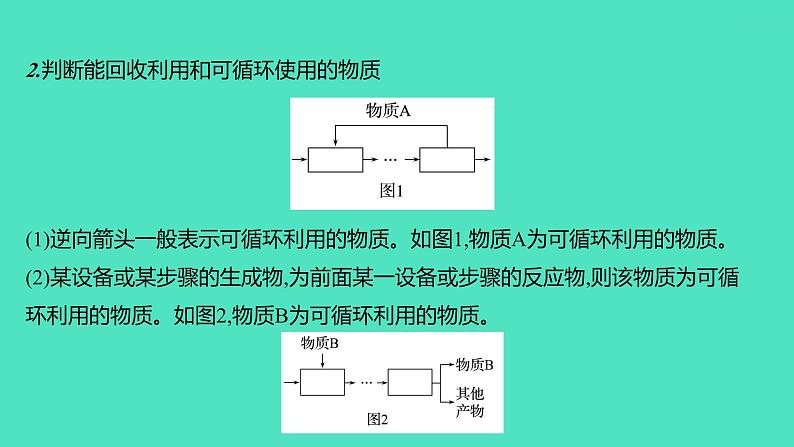
2.判断能回收利用和可循环使用的物质(1)逆向箭头一般表示可循环利用的物质。如图1,物质A为可循环利用的物质。(2)某设备或某步骤的生成物,为前面某一设备或步骤的反应物,则该物质为可循环利用的物质。如图2,物质B为可循环利用的物质。
Fe+H2SO4 FeSO4+H2↑(或Ni+H2SO4 NiSO4+H2↑)
类型2 回收利用流程【典题】(2023·黄冈中考)兴趣小组的同学利用某废镍材料(含有金属Ni及少量Fe、Cu)回收镍,设计流程如图所示(部分产物略去)。请根据上述流程回答下列问题:(1)过滤时,玻璃棒的作用是_________。 (2)写出“酸浸”时发生反应的化学方程式:_______________________________________________________(任写一个)。
(3)过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为2FeSO4+H2SO4+H2O2 Fe2(SO4)3+2X,则X的化学式是_________。 (4)Ni、Fe、Cu的金属活动性由强到弱的顺序为______________。
(5)已知Fe3+和Ni2+开始沉淀和完全沉淀时的pH如表。“除铁”过程中加入NaOH溶液的目的是通过调节溶液的pH使Fe3+完全沉淀而Ni2+不沉淀,则pH的范围是____(填字母)。 A.2.7≤pH<3.2 B.3.2≤pH<
2.对工艺流程的评价(1)科学性:杂质是否完全除去、是否引入新的杂质等。(2)安全性和便捷性:尽量选用较温和的反应条件。(3)对环境的影响:是否符合绿色化学理念,是否产生有毒气体或者其他引起环境问题的物质。
类型3 分离提纯流程【典题1】(2023·威海中考)芯片是用高纯硅制成的。如图是以石英砂为原料制备高纯硅的工艺流程(石英砂主要成分是SiO2,含有少量的Fe2O3和Al2O3)。下列说法正确的是( )A.溶液a中的溶质是FeCl3和AlCl3B.①中发生还原反应的物质是碳C.②中反应需要在无氧环境下进行D.该流程中可以循环利用的物质是CO和HCl
【典题2】(2023·重庆中考A卷)锂辉矿(Li2CO3)是制备新能源汽车电池的重要原料。如图是一种模拟提纯碳酸锂的工艺,根据要求回答问题。
【查阅资料】Ⅰ.锂辉矿主要成分为Li2CO3,含泥沙等杂质。Ⅱ.Li2CO3(化学性质与Na2CO3类似)为无色晶体,微溶于水,在冷水中的溶解度比热水中大。(1)X是一种酸,其溶质化学式为___________,常用_______________(填试剂名称)检验气体Y。 (2)②中发生中和反应的化学方程式为___________________________________。 (3)有以下三种温度的饱和Na2CO3溶液,③中你选择的是______(填字母)。 A.0 ℃ B.25 ℃ C.80 ℃(4)将滤液2蒸发,当有_________________时(填现象),停止加热,可得到其他化工产品。
2NaOH+H2SO4 Na2SO4+2H2O
【典题3】(2021·镇江中考)以碳酸钡原料(含少量SiO2)制备高纯碳酸钡的流程如图。(1)试剂X应选用______(填字母)。 a.稀硫酸 b.盐酸(2)操作1、操作2用到的玻璃仪器有_________、烧杯、玻璃棒等。 (3)滤液Y中溶质有KOH、K2CO3和_________。 (4)酸溶时,试剂X不能过量太多,一是节约试剂X,二是__________________________________________。
防止转化过程中消耗过
【方法点拨】1.物质的分离和提纯的方法:(1)结晶——固体物质从溶液中析出的过程(冷却热饱和溶液、蒸发浓缩)。(2)过滤——固、液分离。(3)蒸馏——液、液分离。
2.控制反应条件的目的:(1)调节pH:除去杂质离子。(2)控制温度:防止某物质温度过高发生分解。
重温·山东中考 经典专练明方向1.(2023·临沂中考)造纸术是中国古代四大发明之一,氢氧化钾是造纸的重要原料。我国古代制造氢氧化钾的主要流程如图所示,其原理是将干燥的木料烧成灰(含K2CO3),再向灰汁中加入石灰浆,充分反应后,进一步提纯得到氢氧化钾。(1)操作①的名称是_________。 (2)“制浆池”中发生反应的基本类型是_____________,从能量变化的角度分析该反应为_______(填“放热”或“吸热”)反应。 (3)“反应池”中发生反应的化学方程式是_____________________________________。
K2CO3+Ca(OH)2 CaCO3↓+2KOH
2.(2023·潍坊中考)稀土被称为“工业维生素”,能显著提升建造航母及舰载机的材料性能,含有稀土元素钇的氧化钇(Y2O3)被广泛应用于航空航天涂层材料。以富钇稀土矿(主要成分为Y2O3,含有少量的Fe2O3、CuO、SiO2等杂质)生产氧化钇的工艺流程如下,回答下列问题:
(1)在粉碎机中研磨粉碎的目的是____________________________________。 (2)操作Ⅰ的名称是_________,“酸溶”过程中,Y2O3发生反应的化学方程式为_______________________________。 (3)向反应釜2中通入气体X使溶液呈碱性,调节溶液的pH除去滤液Ⅰ中杂质,沉淀Ⅱ的主要成分是______________________(填化学式)。 (4)沉淀池中“沉钇”过程有H2O等物质产生,“沉钇”的化学方程式为_______________________________________________________。 (5)流程中可循环使用的物质为_________(填化学式)。
增大接触面积,有利于反应充分进行
Y2O3+6HCl 2YCl3+3H2O
Fe(OH)3、Cu(OH)2
6NH4HCO3+2YCl3 Y2(CO3)3↓+3CO2↑+6NH4Cl+3H2O
3.(2021·济宁中考)铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见如图:(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是_____________; (2)操作③得到的Al(OH)3受热分解生成Al2O3,该反应的化学方程式为________________________________,铝土矿经过操作①~④的目的是____________________; (3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为________________________。
Al2O3+3H2O
得到纯净的Al2O3
2Al2O3 4Al+3O2↑
2.(2023·烟台一模)高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产,以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产高纯碳酸钙的流程如图:
(1)从流程图中推知:SiO2具有的化学性质是___________________________。 (2)氧化铁与盐酸反应的化学方程式为_________________________________。 (3)滤渣3中除有Ca(OH)2外,还有______________________(填化学式,下同)。 (4)向得到的NH4Cl溶液中加入氢氧化钙溶液并加热,可以得到的气体是_______ (填化学式)。 (5)“转化”过程发生反应的化学方程式是______________________________________________。
二氧化硅不会与盐酸反应
Fe2O3+6HCl 2FeCl3+3H2O
Fe(OH)3、Mg(OH)2
CaCl2+H2O+CO2+2NH3 2NH4Cl+CaCO3↓
2024山东中考复习 人教版化学 题型突破 题型五 科学探究题 课件: 这是一份2024山东中考复习 人教版化学 题型突破 题型五 科学探究题 课件,共60页。PPT课件主要包含了题型研析·塑思维,科学探究的基本环节,CO2和SO2,方法点拨,CaOH2,CrAlCu,KCl,下角没有数字2,金属的种类,二氧化碳过量等内容,欢迎下载使用。
2024山东中考复习 人教版化学 题型突破 题型三 物质推断题 课件: 这是一份2024山东中考复习 人教版化学 题型突破 题型三 物质推断题 课件,共25页。PPT课件主要包含了题型研析·塑思维,FeCl3,Na2SO4,题组演练·提素能,HCl,Na2CO3,复分解,CuCl2,置换反应,CaOH2等内容,欢迎下载使用。
2024山东中考复习 人教版化学 题型突破 题型九 科普类阅读题 课件: 这是一份2024山东中考复习 人教版化学 题型突破 题型九 科普类阅读题 课件,共15页。PPT课件主要包含了题型研析·塑思维,玻璃纤维,题组演练·提素能,肥皂水,延展性和金,属光泽等内容,欢迎下载使用。












