





所属成套资源:备战2025届新高考化学一轮总复习课件
- 备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第55讲离子的检验物质的鉴别与推断课件 课件 2 次下载
- 备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第53讲化学实验仪器和基本操作课件 课件 2 次下载
- 备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第56讲常见气体的制备净化和收集课件 课件 2 次下载
- 备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第57讲简单实验方案的设计与评价课件 课件 2 次下载
- 备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究热点专攻24仪器的组装和气体体积的测定课件 课件 2 次下载
备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第54讲物质的分离和提纯课件
展开
这是一份备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第54讲物质的分离和提纯课件,共45页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,降温结晶,支管口,碎瓷片,互不相溶,不反应,蒸发浓缩等内容,欢迎下载使用。
1.掌握常用物质的分离和提纯的物理方法、化学方法,明确其原理。2.能综合分析物质的不同性质,并选择合适的分离和提纯方法,对物质进行分离和提纯。
考点一 分离和提纯物质常用物理方法及装置
考点二 分离和提纯物质常用化学方法及原理
考点一分离和提纯物质常用物理方法及装置
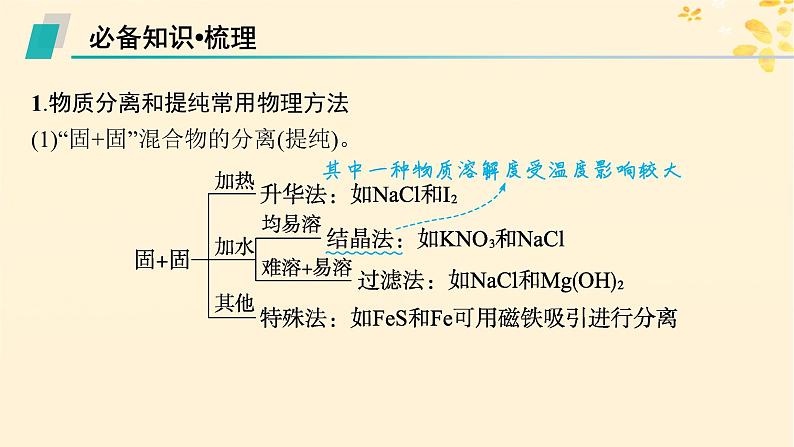
1.物质分离和提纯常用物理方法(1)“固+固”混合物的分离(提纯)。
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
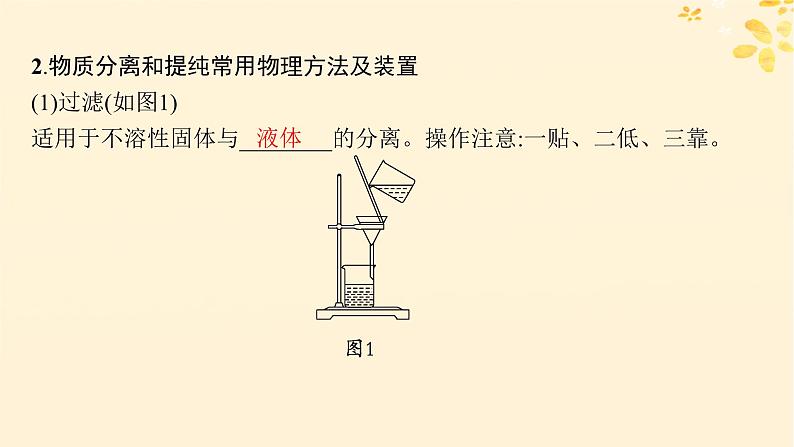
2.物质分离和提纯常用物理方法及装置(1)过滤(如图1)适用于不溶性固体与________的分离。操作注意:一贴、二低、三靠。
(2)蒸发(如图2)蒸发结晶适用于溶解度随温度变化不大的固态物质;而对溶解度受温度变化影响较大的固态物质,采用________的方法。 [注意]在蒸发结晶中:①玻璃棒的作用是____________________________;②当有大量晶体析出时,________________________,而不能直接蒸干。
搅拌,防止液体局部过热而飞溅
停止加热,利用余热蒸干
(3)蒸馏(如图3)适用于分离互溶但________不同的液体混合物。 [注意]①温度计的水银球放在蒸馏烧瓶的________处;②蒸馏烧瓶内要加________(或________);③冷凝管水流方向应为“下口进水,上口出水”。
(4)萃取和分液(如图4)适用于分离两种________不同且易分层的液体。 [注意]①溶质在萃取剂中的溶解度________;②原溶剂和萃取剂________;③溶质和萃取剂________;④分液时下层液体从________流出,上层液体从________倒出。
(5)升华(如图5)利用物质易升华的性质进行分离、提纯,属于物理变化。(6)洗气(如图6)除去气体中的杂质气体。[注意]气体流向是________进气,________出气。
【应用示例】(1)从MgSO4溶液中得到MgSO4固体的实验操作包括________、冷却结晶、________、洗涤、干燥等一系列操作。 (2)过滤后,若滤液仍浑浊,需_______________________。 滤液仍浑浊的原因可能是_______________________________(填两条)。 (3)分液时,分液漏斗中的液体很难滴下,可能的原因是______________。
滤纸破损、滤液超过滤纸边缘
没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐)
考向1 物质分离和提纯的常用物理方法及装置例1(2021·湖南卷,13改编)1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
解析 浓硫酸和NaBr反应产生HBr,1-丁醇以及浓硫酸和NaBr产生的HBr均易挥发,用装置Ⅰ回流可减少物质的挥发,提高产率,A正确;冷凝水应下口进上口出,装置Ⅱ中b为进水口,a为出水口,B正确;用装置Ⅲ萃取分液时,将下层液体从下口放出,上层液体从上口倒出,C错误;由题意可知经装置Ⅲ得到粗产品,由于粗产品中各物质沸点不同,再次进行蒸馏可得到更纯的产品,D正确。
[对点训练1] (2023·广东深圳检测)下列操作正确且能达到实验目的的是( )
A.用甲装置分离I2和NaCl固体B.用乙装置分离乙醇和水C.用丙装置从NaCl溶液中得到NaCl固体D.用丁装置分离Br2和四氯化碳
解析 I2易升华,可使用甲装置分离I2和NaCl固体,A正确;温度计的液泡应位于蒸馏烧瓶的支管口处,B错误;应该使用蒸发皿进行蒸发操作,C错误;Br2会溶解在CCl4中,采用分液操作不能分离,D错误。
考向2 实验(或工艺)流程中物质的分离和提纯操作例2(2022·山东卷)已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是( )
A.苯胺既可与盐酸也可与NaOH溶液反应B.由①、③分别获取相应粗品时可采用相同的操作方法C.苯胺、甲苯、苯甲酸粗品依次由①、②、③获得D.①、②、③均为两相混合体系
解析 由题给流程可知,向甲苯、苯胺、苯甲酸的混合溶液中加入盐酸,盐酸将微溶于水的苯胺转化为易溶于水的苯胺盐酸盐,分液得到水相Ⅰ和有机相Ⅰ;向水相Ⅰ中加入氢氧化钠溶液将苯胺盐酸盐转化为苯胺,分液得到苯胺粗品①;向有机相Ⅰ中加入水洗涤除去混有的盐酸,分液得到废液和有机相Ⅱ,向有机相Ⅱ中加入碳酸钠溶液将微溶于水的苯甲酸转化为易溶于水的苯甲酸钠,分液得到甲苯粗品②和水相Ⅱ;向水相Ⅱ中加入盐酸,将苯甲酸钠转化为苯甲酸,经结晶或重结晶、过滤、洗涤得到苯甲酸粗品③。苯胺分子中含有的氨基能与盐酸反应,但不能与氢氧化钠溶液反应,A错误;得到苯胺粗品①的分离方法为分液,得到苯甲酸粗品③的分离方法为结晶或重结晶、过滤、洗涤,获取两者的操作方法不同,B错误;苯胺粗品、甲苯粗品、苯甲酸粗品依次由①、②、③获得,C正确;①、②为液相,③为固相,都不是两相混合体系,D错误。
[对点训练2] (2020·山东卷)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )A.萃取振荡时,分液漏斗下口应倾斜向下B.分液时,应先将下层液体由分液漏斗下口放出C.分液后水相为无色,说明已达到分离目的D.蒸馏时选用直形冷凝管
解析 萃取振荡时,分液漏斗下口应倾斜向上,A错误;分液时,下层液体由分液漏斗下口放出,下层液体放完后,密度小的上层液体从分液漏斗上口倒出,B正确;Fe3+在浓盐酸中生成黄色配离子,该离子在乙醚中生成缔合物,乙醚与水不互溶,故分液后水相为无色,则水相中不再含有Fe3+,说明已经达到分离目的,C正确;蒸馏时选用直形冷凝管,能使馏分全部转移到锥形瓶中,而不会残留在冷凝管中,D正确。
考点二分离和提纯物质常用化学方法及原理
物质分离和提纯的常用化学方法(1)加热法当混合物中有热稳定性差的物质时,可直接加热,使热稳定性差的物质受热分解而分离出。例如,NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。(2)沉淀法在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。使用该方法一定要注意不能引入新的杂质。例如,加适量的BaCl2溶液可除去NaCl中混有的Na2SO4。
(3)氧化还原法若混合物中混有氧化性杂质,可以加入适当的还原剂使其还原为被提纯物质。例如,将过量的________加入混有FeCl3的FeCl2溶液中,以除去FeCl3杂质。 (4)调节pH法通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法,一般是加入相应的难溶或微溶物来调节。例如,CuCl2溶液中含有FeCl3杂质,可向溶液中加入________[或Cu(OH)2、CuCO3]除去。
【应用示例】试填写下列除杂的方法(括号内为杂质)。(1)Na2CO3固体(NaHCO3): _______________________。 (2)Fe2O3(Al2O3):方法是加过量____________,过滤、洗涤、干燥。 (3)CuO(C): _______________________。 (4)FeCl3溶液(FeCl2):________________________。
考向1 常见气体的除杂方法及装置选择例1(2023·广东广州三模)下列有关气体除杂的试剂选择正确的是( )A.除去CO2中的HCl:饱和食盐水B.除去C2H2中的H2S:硫酸铜溶液C.除去C3H8中的C2H4:酸性高锰酸钾溶液D.除去CO2中的SO2:饱和碳酸钠溶液
解析 盐酸能与碳酸氢钠溶液反应生成二氧化碳,二氧化碳不溶于饱和碳酸氢钠溶液,则除去二氧化碳中的氯化氢杂质应选用饱和碳酸氢钠溶液,A错误;硫化氢能与硫酸铜溶液反应生成硫化铜沉淀和硫酸,而乙炔与硫酸铜溶液不反应,则除去乙炔中的硫化氢杂质应选择硫酸铜溶液,B正确;乙烯与酸性高锰酸钾溶液发生氧化反应生成二氧化碳气体,则除去丙烷中的乙烯杂质不能选用酸性高锰酸钾溶液,否则会引入新杂质二氧化碳,应选择溴水,C错误;二氧化碳和二氧化硫都能与碳酸钠溶液反应,所以除去二氧化碳中的二氧化硫杂质不能选用饱和碳酸钠溶液,应选用饱和碳酸氢钠溶液,D错误。
[对点训练1] (2020·全国Ⅰ卷,9改编)下列气体去除杂质的方法中,不能实现目的的是( )
[对点训练2] (2023·广东广州检测)提纯下列物质(括号内为少量杂质),能达到目的的是( )
解析 乙酸乙酯在NaOH溶液中能够完全水解,故除去乙酸乙酯中的乙酸应该用饱和碳酸钠溶液,然后分液即可,A错误;乙醇和水沸点相差较大,但二者能够形成恒沸物,故除去乙醇中的水需加入CaO后进行蒸馏,B错误;已知Na2SO3+Br2+H2O═Na2SO4+2HBr,故除去溴苯中混有的Br2,可用Na2SO3溶液然后分液即可,C正确;由于酸性高锰酸钾溶液能将乙烯氧化成CO2,故除去乙烷中的乙烯不能将气体通入酸性高锰酸钾溶液,否则将引入新的杂质,D错误。
进阶1 练易错·避陷阱1.(2023·广东中山期末)下列所用除杂试剂不正确的是( )A.用水除去NO中的NO2B.用生石灰除去乙醇中的水C.用饱和NaHCO3溶液除去CO2中混有的SO2D.用氢气除去乙烷中混有的乙烯
解析 NO2能与水反应生成HNO3和NO,NO不与水反应,A正确;生石灰能与水反应生成氢氧化钙,乙醇不与生石灰反应,B正确;二氧化碳不溶于饱和碳酸氢钠溶液,二氧化硫能与碳酸氢钠反应生成亚硫酸钠、水和二氧化碳,C正确;氢气可与乙烯发生加成反应生成乙烷,但是难以保证氢气和乙烯能完全反应,乙烷中仍会有氢气和乙烯,D错误。
2.针对下列实验目的,所采取的分离方法与对应原理都正确的是( )
解析 胶体粒子可以通过滤纸,但不能通过半透膜,A项错误;乙醇与水互溶,不能用乙醇萃取碘水中的碘,B项错误;用MgCl2溶液制备无水MgCl2固体,要先升温蒸发,然后降温结晶获得氯化镁结晶水合物,然后在干燥的氯化氢气流中加热得到MgCl2,C项错误;丁醇和乙醚的沸点相差大,可以用蒸馏的方法分离,D项正确。
进阶2 练热点·提素能3.下列实验中,所采取的方法及其原理均正确的是( )
解析 NO、NO2的混合气体通过盛有NaOH溶液的洗气瓶会发生反应: NO+NO2+2NaOH═2NaNO2+H2O,欲除去NO中的NO2,应将气体通过盛有水的洗气瓶,A项错误;除去乙醇中的少量水,应加入生石灰,然后蒸馏,B项正确;KNO3的溶解度随温度变化而变化较大,NaCl的溶解度随温度变化而变化较小,除去KNO3中的NaCl时,可冷却热饱和溶液,KNO3结晶析出,C项错误;铝不能与氨水反应,铝能与强碱溶液发生反应,D项错误。
4.某KCl样品中含有少量K2CO3、K2SO4及不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌,过滤,再将滤液按如图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是( )
进阶3 研真题·明考向5.(2021·湖北卷)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)( )
解析 依题意,制备产品需要搅拌、加热回流,A项正确;副产物氯化氢极易溶于氢氧化钠溶液,不能直接将尾气通入氢氧化钠溶液中,这样易发生倒吸现象,B项错误;分液收集二氯甲烷层需用到分液漏斗,振荡时需将分液漏斗倒转过来放气,避免分液漏斗内气压过大,发生危险,C项正确;蒸馏时需要用温度计指示温度,冷凝水从下口进、上口出,可提高冷凝效率,D项正确。
6.(2022·湖南卷,15节选)某实验小组以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。设计了如下实验方案:可选用试剂:NaCl晶体、BaS溶液、浓硫酸、稀硫酸、CuSO4溶液、蒸馏水步骤1.BaCl2·2H2O的制备按如图所示装置进行实验,得到BaCl2溶液,经一系列步骤获得BaCl2·2H2O产品。
步骤2.产品中BaCl2·2H2O的含量测定①称取产品0.500 0 g,用100 mL水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的0.100 ml·L-1 H2SO4溶液;③沉淀完全后,60 ℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.466 0 g。回答下列问题:(1)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是_________________________________。 (2)沉淀过程中需加入过量的H2SO4溶液,原因是_____________________。
静置,取少量上层清液置于一洁净的试管中,继续滴加热的硫酸溶液,无白色沉淀生成,则已沉淀完全
相关课件
这是一份2025届高考化学一轮总复习第3章化学实验基础第11讲物质的分离和提纯课件,共52页。PPT课件主要包含了纯净物,互不相溶,支管口,碎瓷片,灼热的铜网,NaOH溶液,粗盐除杂的路线等内容,欢迎下载使用。
这是一份2025版高考化学一轮总复习第10章化学实验基础和综合探究第37讲物质的分离和提纯课件,共60页。PPT课件主要包含了降温结晶,搅拌防止液体局部过,热而飞溅,支管口,碎瓷片,互不相溶,不反应,半透膜,精制胶体,CuO等内容,欢迎下载使用。
这是一份备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第59讲物质含量测定和性质探究综合实验课件,共60页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,关键能力•提升,分液漏斗,5×10-5,棕色细口瓶,溶液变蓝,溶液蓝色褪去等内容,欢迎下载使用。









