






所属成套资源:备战2025届新高考化学一轮总复习课件
备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第59讲物质含量测定和性质探究综合实验课件
展开
这是一份备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第59讲物质含量测定和性质探究综合实验课件,共60页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,关键能力•提升,分液漏斗,5×10-5,棕色细口瓶,溶液变蓝,溶液蓝色褪去等内容,欢迎下载使用。
1.掌握物质的化学组成或含量测定的实验方法。2.能根据实验需求,设计物质性质的实验探究方案。3.能根据物质间的反应机理的可能性,设计综合类实验的探究方案。
考点一 物质含量或组成的测定
考点二 物质性质或反应机理的实验探究
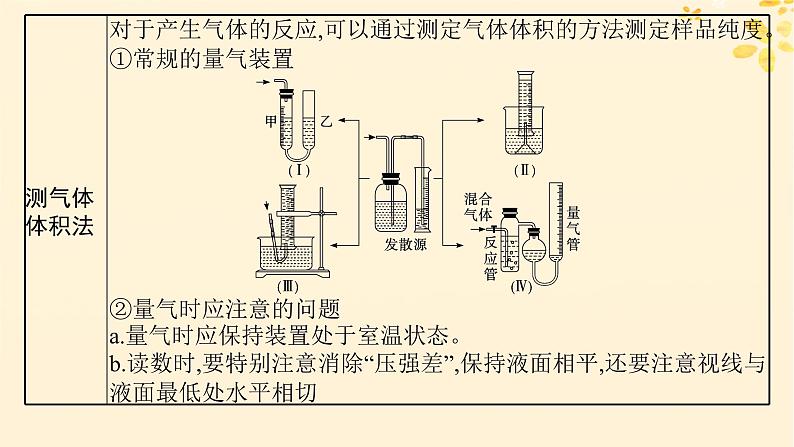
1.实验数据或物理量的测定方法
2.物质组成计算的常用方法
考向1 物质中某一成分含量的测定例1(2022·河北卷,14节选)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
回答下列问题:(1)三颈烧瓶适宜的规格为______ (填字母)。 A.250 mL B.500 mL C.1 000 mL(2)解释加入H3PO4,能够生成SO2的原因: __________________________。
(3)滴定管在使用前需要________、洗涤、润洗;滴定终点时溶液的颜色为________;滴定反应的离子方程式为_______________________________。(4)若先加磷酸再通氮气,会使测定结果________(填“偏高”“偏低”或“无影响”)。(5)该样品中亚硫酸盐含量为________mg·kg-1(以SO2计,结果保留三位有效数字)。
[对点训练1] (1)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物的质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为________。 a.90~145 ℃b.145~195 ℃c.195~273 ℃d.>273 ℃
(2)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。步骤Ⅰ:准确称取0.457 0 g产品置于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。步骤Ⅱ:移取20.00 mL上述溶液置于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 ml·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。步骤Ⅱ中移取溶液时所使用的玻璃仪器为______________________;产品中Zn3(PO4)2·4H2O的质量分数为________。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。 a.步骤Ⅰ中定容时俯视刻度线b.步骤Ⅰ中转移溶液时未洗涤烧杯c.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗d.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
酸式滴定管(或移液管)
考向2 物质组成的测定例2碳酸钐Sm2(CO3)3(摩尔质量为480 g·ml-1)为难溶于水的白色粉末,可用于治疗高磷酸盐血症。
回答下列问题:Ⅰ.实验室利用NH3和CO2(由盐酸和石灰石反应制取)通入SmCl3溶液中制备水合碳酸钐[Sm2(CO3)3·xH2O]:(1)装置的连接顺序是a→______,______←b(填接口字母)。 (2)实验有不足之处,改进办法是____________________________。 (3)生成水合碳酸钐的化学方程式为____________________________。 (4)若氨气过量,溶液碱性太强会生成副产物Sm(OH)CO3,化学方程式为_______________________________________________________。
需要在a和c中间接一个盛有饱和碳酸氢钠溶液的洗气瓶,用来除去二氧化碳中混有的氯化氢
6NH3+3CO2+(x+3)H2O+2SmCl3═Sm2(CO3)3·xH2O↓+6NH4Cl
3NH3+CO2+2H2O+SmCl3═Sm(OH)CO3↓+3NH4Cl
Ⅱ.碳酸钐质量分数的测定:准确称取10.0 g产品试样,溶于10.0 mL稀盐酸中,加入10.0 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 ml·L-1 EDTA-2Na(Na2H2Y)标准溶液滴定至呈蓝紫色(Sm3++H2Y2-═SmY-+2H+),消耗EDTA-2Na溶液40.00 mL。(5)产品中碳酸钐的质量分数是________。
Ⅲ.测定Sm2(CO3)3·xH2O中结晶水的含量:(6)将装置A称重,记为m1 g。将提纯后的样品装入装置A中,再次将装置A称重,记为m2 g,将装有试剂的装置C称重,记为m3 g。按如图连接好装置进行实验。
①打开K1、K2和K3,缓缓通入N2;②数分钟后关闭________(填写止水夹代号,下同),打开________,点燃酒精喷灯,加热A中样品; ③一段时间后,熄灭酒精喷灯,打开K1,通入N2数分钟后,冷却到室温,关闭K1和K2,称量装置A,重复上述操作步骤,直至装置A恒重,记为m4 g(此时装置A中为Sm2O3)。称重装置C,记为m5 g。
(7)计算Sm2(CO3)3·xH2O中结晶水的数目x=____________________(用含m1、m2、m4的代数式表示)。
解析 大理石和盐酸反应生成二氧化碳气体,反应装置可以选择启普发生器装置甲;浓氨水滴加到生石灰上可以生成氨气,发生装置选择乙;NH3和CO2通入SmCl3溶液中制备水合碳酸钐[Sm2(CO3)3·xH2O]。(1)装置甲生成二氧化碳、装置乙生成氨气,将NH3和CO2通入SmCl3溶液制备水合碳酸钐[Sm2(CO3)3·xH2O],由于氨气极易溶于水,需要防止倒吸装置,故氨气从d口进入,故装置的连接顺序是a→c,d←b。(2)反应产生的二氧化碳中混有HCl气体,HCl能与氨气反应,会导致产物不纯,故需要在a和c中间接一个盛有饱和碳酸氢钠溶液的洗气瓶,用来除去二氧化碳中混有的氯化氢。(3)根据分析可知,生成水合碳酸钐的化学方程式为6NH3+3CO2+(x+3)H2O+2SmCl3═Sm2(CO3)3·xH2O↓+6NH4Cl。
(4)氨水显碱性,若氨气过量,溶液碱性太强会生成副产物Sm(OH)CO3,化学方程式为3NH3+CO2+2H2O+SmCl3═Sm(OH)CO3↓+3NH4Cl。(5)根据Sm3++H2Y2-═SmY-+2H+可求出碳酸钐的质量分数为
(6)Sm2(CO3)3·xH2O受热失去结晶水且分解生成Sm2O3和二氧化碳,通过装置B吸收水后,生成的二氧化碳被装置C吸收,D防止空气中二氧化碳、水的干扰;实验中开始通入氮气是排出装置中的空气防止干扰实验,熄灭酒精喷灯后通入氮气是将滞留在装置中的二氧化碳排入C中吸收;实验操作为②数分钟后关闭K1、K3,打开K4,点燃酒精喷灯,加热A中样品。
(7)由题干可知,(m2-m1) g为Sm2(CO3)3·xH2O的质量,(m4-m1) g为Sm2O3的质量,由于n[Sm2(CO3)3·xH2O]=n(Sm2O3),
[对点训练2] (2021·全国甲卷)胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填字母)。 A.烧杯B.容量瓶C.蒸发皿D.移液管(2)将CuO加入适量的稀硫酸中,加热,其主要反应的化学方程式为___________________________,与直接用废铜和浓硫酸反应相比,该方法的优点是_____________________________________________________。
不会产生二氧化硫且产生等量胆矾消耗硫酸少(硫酸利用率高)
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10 min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______、乙醇洗涤、________,得到胆矾。其中,控制溶液pH为3.5~4的目的是________________________________,煮沸10 min的作用是________________________________。 (4)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为_____________(写表达式)。 (5)下列操作中,会导致结晶水数目测定值偏大的是________(填序号)。 ①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
除尽铁,抑制硫酸铜水解
破坏氢氧化铁胶体,易于过滤
(4)由题意可知,结晶水的质量为m2-m3,硫酸铜的质量为m3-m1,设胆矾的化学式为CuSO4·xH2O,根据分子个数比等于物质的量之比,
(5)胆矾未充分干燥,会使测定的水的质量偏高,则会导致结晶水数目测定值偏大,①符合题意;坩埚未置于干燥器中冷却,会使测定的水的质量偏低,则会导致结晶水数目测定值偏小,②不符合题意;加热时有少量胆矾迸溅出来,会使测定的水的质量偏大,则会导致结晶水数目测定值偏大,③符合题意。
考点二物质性质或反应机理的实验探究
1.研究物质性质的基本程序
2.物质性质实验方案的设计思路物质的性质→实验中的仪器、试剂和反应条件→实验步骤和操作方法→结论
3.反应机理类探究性实验的解题流程
考向1 物质性质的实验探究例1(2023·广东汕头三模)氯化铁常用于污水处理、印染工业、电子工业等领域。氯化铁遇水极易发生水解。某化学兴趣小组设计实验制备氯化铁并探究其性质。回答下列问题:
Ⅰ.氯化铁的制备:(1)如图为湿法制备的装置,仪器A的名称为_________,烧杯中发生反应的化学方程式为___________________________。
2FeCl2+Cl2══ 2FeCl3
(2)如图为干法制备的装置。反应前后都要鼓入氮气,目的是_________。
反应前排尽空气,反应后将氯气赶走
Ⅱ.氯化铁的性质探究:(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁[Fex(OH)3x-yCly]。已知聚合氯化铁极易溶于水,写出氯化铁水解反应的总离子方程式____________________________________。
(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(忽略溶液体积的变化),获得如下数据:
①实验1和实验2的探究目的是____________________________________。实验2和实验3说明FeCl3的水解是_________ (填“吸热”或“放热”)反应。
探究Fe3+或FeCl3浓度对水解平衡的影响
②查阅资料,加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学求助老师利用计算机手持技术得到实验4和实验5的结果分别如图1和图2所示。
ⅰ.根据实验现象,提出假设:a.氯离子对铁离子的水解活性有促进作用:b. __________________________________________。 ⅱ.设计其他简单实验证明假设a:__________________ (写出实验操作、现象和结论)。
硫酸根离子对铁离子的水解活性有抑制作用
向硫酸铁溶液中加入一定量的氯化钠固体,若pH减小,说明假设a正确
解析 (1)如图为湿法制备的装置,仪器A的名称为分液漏斗,铁与盐酸反应后生成氯化亚铁,放入烧杯中与氯气反应生成氯化铁,烧杯中发生反应的化学方程式为2FeCl2+Cl2═2FeCl3。(2)反应前后都要鼓入氮气,目的是反应前排尽空气,防止铁与氧气反应,反应后将氯气赶走,防止污染环境。
(4)①实验1和实验2中水的体积不同,目的是探究Fe3+或FeCl3浓度对水解平衡的影响。实验3温度升高,溶液的pH减小,促进铁离子的水解,说明FeCl3的水解是吸热反应。②加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。由实验4加入NaCl后溶液的pH变小,实验5加入硫酸钠后溶液的pH增大。ⅰ.根据实验现象,提出假设:a.氯离子对铁离子的水解活性有促进作用;b.硫酸根离子对铁离子的水解活性有抑制作用。ⅱ.设计其他简单实验证明假设a:向硫酸铁溶液中加入一定量的氯化钠固体,若pH减小,说明假设a正确。
[对点训练] 某研究性学习小组通过下列实验验证AgI沉淀的生成会使I2的氧化能力增强,可将Fe2+氧化。
回答下列问题:(1)由AgNO3固体配制0.1 ml·L-1的AgNO3溶液50 mL,下列仪器中不需要使用的有_________________________(填名称),配制好的溶液应转移到____________(填试剂瓶的名称)中保存。
(2)步骤1的实验现象是______________________________; 步骤2无明显现象;步骤3最终的实验现象是溶液中生成黄色沉淀,________________。由此可知,步骤3反应的离子方程式为________________________________________。 (3)为了验证AgI的生成使I2的氧化能力增强而将Fe2+氧化,学习小组在上述实验基础上进行补充实验:分别取少量的________________和步骤3试管中的上层清液置于试管a和试管b中,向两支试管中加入过量的__________,观察到的现象为______________________________________。
I2+2Fe2++2Ag+══ 2AgI↓+2Fe3+
试管a中蓝色褪去、先出现白色沉淀、迅速变成灰绿色最后变成红褐色,试管b中有白色沉淀(转变为褐色沉淀)和红褐色沉淀
解析 (3)由于步骤2的溶液中有亚铁离子而没有铁离子,要验证AgI的生成使I2的氧化能力增强而将Fe2+氧化,只要证明步骤3的溶液中存在氧化产物铁离子即可,由实验知,步骤2溶液中有碘与淀粉混合液和亚铁离子,步骤3中加入了过量的硝酸银溶液,则上层清液中银离子与铁离子共存。
考向2 反应机理的实验探究例2(2023·广东茂名三模)“鱼浮灵”是一种常用的化学增氧剂,其主要成分过氧碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,50 ℃开始分解,在异丙醇中溶解度较低。Ⅰ.实验室制备过氧碳酸钠某学习小组用Na2CO3与稳定剂的混合溶液和H2O2化合制备过氧碳酸钠,装置如图所示。
已知 2Na2CO3(aq)+3H2O2(aq)═2Na2CO3·3H2O2(aq) ΔHKBr>KI
Cl、Br、I位于第ⅦA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强
(4)总结:物质氧化性和还原性变化的一般规律是__________________。
氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强,氧化产物(还原产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小;还原反应中,反应物浓度越大或生成物浓度越小,氧化剂氧化性越强
(4)通过本题可以发现,物质氧化性和还原性还与物质的浓度有关,浓度越大氧化性或者还原性越强。
进阶3 研真题·明考向3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlrine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取Cl2的化学方程式为______________。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为_____________________。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______已分解。检验此久置氯水中Cl-存在的操作及现象是_____________________。
取久置氯水少许于小试管中,加入HNO3酸化的AgNO3溶液,产生白色沉淀
(4)某合作学习小组进行以下实验探究。①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)=______ ml·L-1。实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有___________________________________ 。
测试温度不同,温度也影响电导率
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。表2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是____________________________。
A3>B2>B1,在相同温度下测定时,不同试样导电能力有差异
相关课件
这是一份2025版高考化学一轮总复习第10章化学实验基础和综合探究第37讲物质的分离和提纯课件,共60页。PPT课件主要包含了降温结晶,搅拌防止液体局部过,热而飞溅,支管口,碎瓷片,互不相溶,不反应,半透膜,精制胶体,CuO等内容,欢迎下载使用。
这是一份2025版高考化学一轮总复习第10章化学实验基础和综合探究第38讲物质的制备与性质综合实验探究课件,共60页。PPT课件主要包含了先灭灯再停氢,冷凝回流,NH3,略低于,陶土网,碎瓷片或沸石,CO2,NO2,块状固体,插入液面以下等内容,欢迎下载使用。
这是一份备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第58讲以物质制备为主的综合实验课件,共58页。PPT课件主要包含了课标指引,考点一无机物的制备,目录索引,素养发展进阶,必备知识•梳理,关键能力•提升,缺少尾气处理装置,蒸馏烧瓶,相关信息列表如下,球形冷凝管等内容,欢迎下载使用。










