






备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第40讲水的电离和溶液的pH课件
展开1.认识水的电离,了解水的离子积常数。2.能进行溶液pH的简单计算,能正确测定溶液的pH,能调控溶液的酸碱性。3.能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
考点二 溶液的酸碱性与pH
1.水的电离(1)水是极弱的电解质,水的电离方程式为____________________________,或简写为________________________。 (2)25 ℃时,纯水中c(H+)=c(OH-)=________________;任何水溶液中,由水电离出的c(H+)与c(OH-)都________。
1×10-7 ml·L-1
c(H+)·c(OH-)
情境思考水的离子积常数KW=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
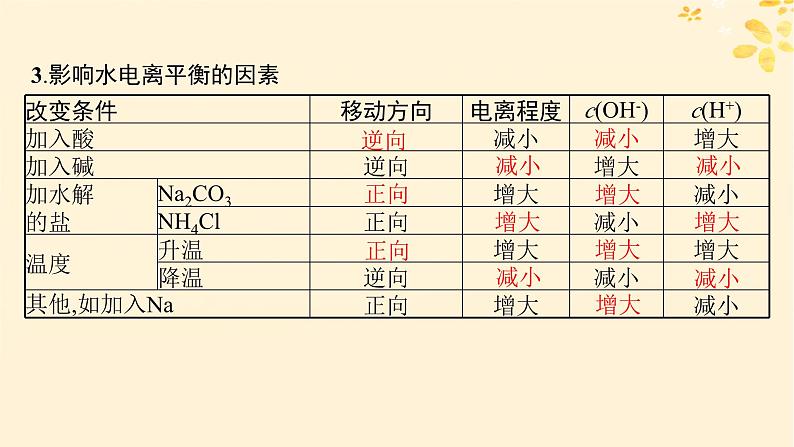
3.影响水电离平衡的因素
考向1 水的电离及电离平衡曲线例1一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( ) A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
解析 升温促进水的电离,升温后溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出KW=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,KW不变,可引起由b向a的变化,C项正确;温度不变,则KW不变,稀释后c(OH-)减小,c(H+)增大,但仍在该曲线上,而c到d点,OH-浓度减小,H+浓度不变,且KW变化,故稀释溶液不可能到达d点,D项错误。
[对点训练1] 水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)·c(OH-)=常数,下列说法错误的是( ) A.图中温度T1>T2B.图中五点KW间的关系:B>C>A=D=EC.曲线a、b均代表纯水的电离情况D.若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
考向2 由水电离出的c水(H+)或c水(OH-)的计算方法例2 25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 ml·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)C.1∶20∶1010∶109D.1∶10∶104∶109
[对点训练2] 常温时,纯水中由水电离出的c(H+)=a ml·L-1,pH=1的盐酸中由水电离出的c(H+)=b ml·L-1,0.1 ml·L-1的盐酸与0.1 ml·L-1的氨水等体积混合后,由水电离出的c(H+)=c ml·L-1,则a、b、c的关系正确的是( )A.a>b=cB.c>a>bC.c>b>aD.b>c>a
解析 盐酸抑制水的电离,所以b
1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)酸性溶液:c(H+)_______c(OH-),常温下,pH_______7。 (2)中性溶液:c(H+)_______c(OH-),常温下,pH_______7。 (3)碱性溶液:c(H+)_______c(OH-),常温下,pH_______7。
2.pH及其测量方法(1)计算公式:pH=________。 (2)25 ℃时,pH与溶液中的c(H+)的关系:
(3)①pH试纸法:用镊子夹取一小块试纸放在洁净的________或________上,用玻璃棒蘸取待测液点在试纸的中央,变色后与____________对照,即可确定溶液的pH。 ②pH计(也叫________)测量法:可较精确测定溶液的pH。
【应用示例】(1)常温下,0.05 ml·L-1的硫酸溶液的pH=_____________。(2)常温下,0.001 ml·L-1的氢氧化钾溶液的pH=_________________。
考向1 判断混合溶液的酸碱性例1常温时,下列混合溶液的pH一定小于7的是( )A.pH=3的盐酸和pH=11的氨水等体积混合B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合C.pH=3的醋酸溶液和pH=11的氢氧化钡溶液等体积混合D.pH=3的硫酸溶液和pH=11的氨水等体积混合
解析 pH=3的盐酸中c(H+)=1×10-3 ml·L-1,pH=11的氨水中c(OH-)=1×10-3 ml·L-1,NH3·H2O是弱电解质,两溶液等体积混合后,氨水剩余,所得溶液呈碱性,pH>7,A错误;pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合,恰好完全反应,所得溶液呈中性,pH=7,B错误;pH=3的醋酸溶液和pH=11的氢氧化钡溶液等体积混合,醋酸剩余,所得溶液呈酸性,pH<7,C正确;pH=3的硫酸溶液和pH=11的氨水等体积混合,氨水剩余,所得溶液呈碱性,pH>7,D错误。
[对点训练1] 常温下,两种溶液混合后酸碱性的判断(在括号中填“酸性”“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合。( )(2)相同浓度的CH3COOH和NaOH溶液等体积混合。( )(3)相同浓度的NH3·H2O和HCl溶液等体积混合。( )(4)pH=2的H2SO4和pH=12的NaOH溶液等体积混合。( )(5)pH=3的HCl和pH=10的NaOH溶液等体积混合。( )(6)pH=3的HCl和pH=12的NaOH溶液等体积混合。( )(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合。( )(8)pH=2的H2SO4和pH=12的NH3·H2O等体积混合。( )
考向2 溶液pH的计算例2计算25 ℃时下列溶液的pH。(1)0.005 ml·L-1的H2SO4溶液的pH=________。 (2)0.001 ml·L-1的NaOH溶液的pH=________。 (3)0.1 ml·L-1的NH3·H2O溶液(NH3·H2O的电离度α约为1%)的pH=______。(4)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合,混合溶液的pH=________。 (5)0.015 ml·L-1的硫酸与0.01 ml·L-1的NaOH溶液等体积混合,混合溶液的pH=________。
思维建模1.计算溶液pH 的思维模型
2.混合溶液pH 计算的具体方法
考向3 稀释酸、碱溶液时pH变化规律例3(2023·广东广州检测)某温度下,相同pH的盐酸和醋酸分别加水稀释,溶液pH随溶液体积变化的曲线关系如图所示。下列叙述不正确的是( )A.Ⅰ为盐酸稀释时pH变化曲线B.a点KW的数值比c点的大C.a点酸的总浓度比b点的大D.b点溶液的导电性比c点的强
解析 因盐酸在溶液中完全电离,不存在电离平衡,醋酸在溶液中部分电离,存在电离平衡,相同温度下,相同pH的盐酸和醋酸分别加水稀释相同倍数时,盐酸pH变化大,则Ⅰ为盐酸稀释时的pH变化曲线,A正确;水的离子积常数是温度函数,温度不变,离子积常数不变,则a点KW的数值等于c点的,B错误;相同pH的盐酸和醋酸,后者是弱酸发生部分电离,所以比前者浓度大,稀释相同倍数后,后者仍大于前者,C正确;溶液中离子浓度越大,导电性越强,由图可知,b点溶液酸的浓度大于c点溶液,溶液中离子浓度大于c点溶液,导电性强于c点溶液,D正确。
[对点训练3] 常温下,下列关于溶液稀释的说法正确的是( )A.pH=3的醋酸溶液稀释100倍,pH=5B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 ml·L-1C.将1 L 0.1 ml·L-1的Ba(OH)2溶液稀释为2 L,pH=13D.pH=8的NaOH溶液稀释100倍,其pH=6
归纳总结溶液稀释时pH的变化图像(1)相同体积、相同浓度的盐酸和醋酸
(2)相同体积、相同pH 的盐酸和醋酸
进阶1 练易错·避陷阱1.(2023·广东深圳检测)常温下,下列说法不正确的是( )A.pH=11的氨水、NaOH溶液中,水电离产生的c(H+)相同B.pH=3的HCl溶液与pH=11的氨水等体积混合,混合后溶液的pH小于7C.pH=3的盐酸、醋酸中,c(Cl-)=c(CH3COO-)D.往10 mL pH=3的醋酸中加入pH=11的氨水至中性,消耗氨水体积约10 mL
解析 pH=11的氨水、NaOH溶液中,氢离子浓度相同,对水电离的抑制程度相同,水电离产生的c(H+)相同,A正确;pH=3的盐酸中c(H+)=1×10-3 ml·L-1, pH=11的氨水中c(OH-)=1×10-3 ml·L-1,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,B错误;pH=3的盐酸、醋酸中氢离子浓度相等,根据水的离子积可知两溶液中氢氧根离子浓度也相等,根据电荷守恒,则c(Cl-) =c(CH3COO-),C正确;由于醋酸和一水合氨的电离程度几乎相同,因此pH=3的醋酸和pH=11的氨水浓度几乎相同,则往10 mL pH=3的醋酸中加入pH=11的氨水至中性,消耗氨水体积约10 mL,D正确。
3.常温下,向20 mL 0.1 ml·L-1氨水溶液中滴加盐酸,溶液中由水电离出的c水(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
进阶3 研真题·明考向
课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第34讲 水的电离和溶液的pH: 这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第34讲 水的电离和溶液的pH,共60页。PPT课件主要包含了考点一水的电离,夯实必备知识,水的电离,水的离子积常数,×10-14,电解质,OH-,对点自测,③④⑤⑦,①②⑥等内容,欢迎下载使用。
高考化学一轮复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件: 这是一份高考化学一轮复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。
2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件: 这是一份2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。












