






还剩28页未读,
继续阅读
所属成套资源:备战2025届新高考化学一轮总复习课件
成套系列资料,整套一键下载
备战2025届新高考化学一轮总复习第6章化学反应与能量第30讲反应热的测定及计算课件
展开
这是一份备战2025届新高考化学一轮总复习第6章化学反应与能量第30讲反应热的测定及计算课件,共36页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,3kJ,关键能力•提升,ΔH1+ΔH2,aΔH2,-ΔH2,a+c-2b等内容,欢迎下载使用。
1.了解中和反应反应热测定的原理及操作。2.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。
考点一 中和反应反应热及测定
考点二 盖斯定律及应用
1.中和反应反应热在25 ℃和101 kPa下,在稀溶液中,强酸的稀溶液和强碱的稀溶液发生中和反应生成________________时,放出________的热量。
1 ml H2O(l)
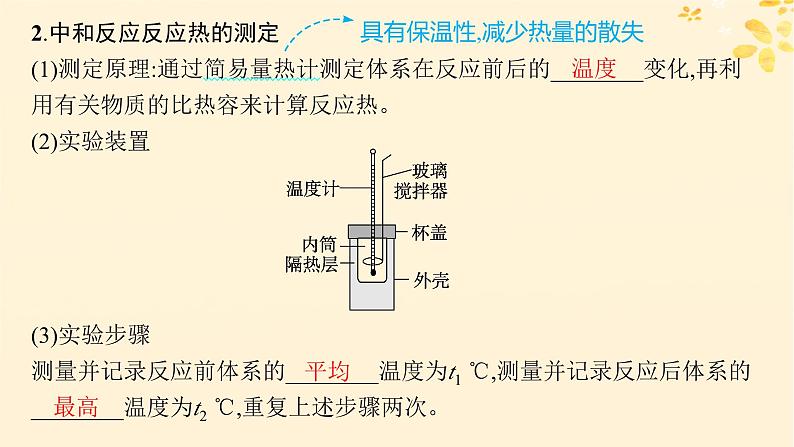
2.中和反应反应热的测定 (1)测定原理:通过简易量热计测定体系在反应前后的________变化,再利用有关物质的比热容来计算反应热。 (2)实验装置
具有保温性,减少热量的散失
(3)实验步骤测量并记录反应前体系的________温度为t1 ℃,测量并记录反应后体系的________温度为t2 ℃,重复上述步骤两次。
【应用示例】在中和反应反应热的测定实验中,使用弱酸或弱碱会使测得的中和反应反应热绝对值________(填“偏高”“不变”或“偏低”),其原因是___________________________________________________________。
弱酸或弱碱在水溶液中部分电离,在反应过程中,分子会继续电离,而电离是吸热的过程
例某化学实验小组用简易量热计(装置如图)测量中和反应的反应热,实验采用50 mL 0.5 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液反应。下列说法错误的是( ) 简易量热计示意图A.采用稍过量的NaOH溶液是为了保证盐酸完全被中和B.仪器a的作用是搅拌,减小测量误差C.NaOH溶液应迅速一次性倒入装有盐酸的内筒中D.反应前测完盐酸温度的温度计应立即插入NaOH溶液中测量温度
解析 若分多次倒入则热量损失大,C正确;反应前测完盐酸温度的温度计应洗净、擦干后再插入NaOH溶液中测量温度,D错误。
[对点训练] 中和反应是放热反应,下列关于中和反应反应热测定的说法错误的是( )A.等温条件下,试管中进行的中和反应,反应体系向空气中释放的热量就是反应的热效应B.测定中和反应反应热时,需要快速将两种溶液混合C.测定中和反应反应热时,最重要的是要保证实验装置的隔热效果D.不同的酸碱反应生成1 ml液态水释放的热量可能不相同
解析 等温条件下,试管中进行的中和反应,反应体系向环境中释放的热量就是反应的热效应,环境是指与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等,A错误;快速混合,防止热量散失,B正确;若用的是弱酸或弱碱,其电离需吸收一部分热量,D正确。
1.盖斯定律的内容一个化学反应,不管是一步完成的还是分几步完成的,其反应热是________的,这就是盖斯定律。 2.盖斯定律的理解盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的________和________有关,而与反应进行的________无关。 则有:ΔH=________=________________。
ΔH3+ΔH4+ΔH5
3.盖斯定律的应用根据盖斯定律,可以利用已知反应的反应热来计算未知反应的反应热。
【应用示例】碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知ΔH2=-299 kJ·ml-1,则ΔH1为_____________。
-1 703 kJ·ml-1
解析 由盖斯定律可知,ΔH1=2ΔH2+ΔH3-ΔH4=2×(-299 kJ·ml-1)+(-1 018 kJ·ml-1)-(+87 kJ·ml-1)=-1 703 kJ·ml-1。
考向1 盖斯定律的理解及应用例1(1)(2023·全国甲卷,28节选)已知下列反应的热化学方程式:①3O2(g)═2O3(g) ΔH1=+285 kJ·ml-1②2CH4(g)+O2(g)═2CH3OH(l) ΔH2=-329 kJ·ml-1反应③CH4(g)+O3(g)═CH3OH(l)+O2(g)的ΔH3=________ kJ·ml-1。
(2)(2023·全国乙卷,28节选)已知下列热化学方程式:FeSO4·7H2O(s)═FeSO4(s)+7H2O(g) ΔH1=a kJ·ml-1FeSO4·4H2O(s)═FeSO4(s)+4H2O(g) ΔH2=b kJ·ml-1FeSO4·H2O(s)═FeSO4(s)+H2O(g) ΔH3=c kJ·ml-1则FeSO4·7H2O(s)+FeSO4·H2O(s)═2(FeSO4·4H2O)(s)的ΔH=________ kJ·ml-1。
解析 将题给热化学方程式依次编号为①②③,根据盖斯定律,由①+③-②×2可得目标反应,故该反应的焓变ΔH=(a+c-2b) kJ·ml-1。
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=________(用含ΔH1、ΔH2的代数式表示)。
归纳总结利用盖斯定律计算反应热的两种方法 (1)虚拟路径法:根据题意虚拟物质的转化过程,然后根据盖斯定律列式求解,即可求出目标反应的反应热。
(2)方程加和法:分析题给热化学方程式,并进行适当加减得到目标热化学方程式,反应热也一并作相应的加减运算,思维流程如下:
[对点训练1] (1)(2022·湖北卷,19节选)
解析 (1)根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)═ Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·ml-1)+(-16.73 kJ·ml-1)+2×(-415.0 kJ·ml-1)=-911.9 kJ·ml-1。(2)根据盖斯定律,将反应①+反应②得到目标反应,则ΔH3=ΔH1+ΔH2=[+100.3+(-11.0)] kJ·ml-1=+89.3 kJ·ml-1。
下列推理不正确的是( )A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键之间存在相互作用,有利于物质稳定C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
解析 2ΔH1≈ΔH2<ΔH3,因此不能说碳碳双键加氢放出的热量与分子内碳碳双键数目成正比,A错误;ΔH2<ΔH3,说明单双键交替的物质能量低,更稳定,从而说明单双键交替的两个碳碳双键之间存在相互作用,有利于物质稳定, B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C正确; ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性,D正确。
[对点训练2] (2024·广东广州模拟)下列各组热化学方程式中,ΔH的比较正确的是( )
A.ΔH1<ΔH2B.ΔH3<ΔH4C.ΔH5<ΔH6D.ΔH7>ΔH8
思维建模反应热大小比较的依据
进阶1 练易错·避陷阱1.分别向1 L 0.5 ml·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH2<ΔH3C.ΔH1>ΔH2=ΔH3D.ΔH1=ΔH2<ΔH3
2.已知:H2O(g)═H2O(l) ΔH1C6H12O6(g)═C6H12O6(s) ΔH2C6H12O6(s)+6O2(g)═6H2O(g)+6CO2(g) ΔH3C6H12O6(g)+6O2(g)═6H2O(l)+6CO2(g) ΔH4下列说法正确的是( )A.ΔH1<0,ΔH2<0,ΔH3<ΔH4B.6ΔH1+ΔH2+ΔH3-ΔH4=0C.-6ΔH1+ΔH2+ΔH3-ΔH4=0D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
解析 由气态物质转化成液态物质或固态物质均放出热量,ΔH1<0,ΔH2<0,气态C6H12O6燃烧生成液态水比固态C6H12O6燃烧生成气态水放出热量多,所以ΔH3>ΔH4,A项错误;根据盖斯定律得ΔH4=6ΔH1+ΔH2+ΔH3,B项正确,C、D项错误。
进阶2 练热点·提素能3.(2023·广东江门检测)已知:①3C(s)+Al2O3(s)+N2(g)═2AlN(s)+3CO(g) ΔH1=+1 026 kJ·ml-1②2C(s)+O2(g)═2CO(g) ΔH2=-221 kJ·ml-1③2Al(s)+N2(g)═2AlN(s) ΔH3=-318 kJ·ml-1则反应2Al2O3(s)═4Al(s)+3O2(g)的ΔH等于( )A.+753 kJ·ml-1B.-753 kJ·ml-1C.+3 351 kJ·ml-1D.-3 351 kJ·ml-1
解析 由盖斯定律可知,将2×①-3×②-2×③得2Al2O3(s)═4Al(s)+3O2(g),则该反应的反应热ΔH=+1 026 kJ·ml-1×2-(-221 kJ·ml-1)×3-(-318 kJ·ml-1) ×2=+3 351 kJ·ml-1,综上所述,答案为C。
4.(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
则ΔH3=________ kJ·ml-1。
解析 根据反应Ⅰ-Ⅱ=Ⅲ,则ΔH3=ΔH1-ΔH2=-49.5 kJ·ml-1-(-90.4 kJ·ml-1)=+40.9 kJ·ml-1。
(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g)═CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)═CO(g)+H2O(g) ΔH1=+41 kJ·ml-1②CO(g)+2H2(g)═CH3OH(g) ΔH2=-90 kJ·ml-1总反应的ΔH=________ kJ·ml-1。
解析 二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g)═CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)═CO(g)+H2O(g) ΔH1=+41 kJ·ml-1,②CO(g)+2H2(g)═CH3OH(g) ΔH2=-90 kJ·ml-1。根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)═CH3OH(g)+H2O(g) ΔH=(+41 kJ·ml-1)+(-90 kJ·ml-1)=-49 kJ·ml-1。
进阶3 研真题·明考向5.(1)(2023·湖南卷,16节选)已知下列反应的热化学方程式:
解析 根据盖斯定律,反应④可由①-②-③得到,故ΔH4=ΔH1-ΔH2-ΔH3=(-4 386.9+4 263.1+241.8) kJ·ml-1=+118 kJ·ml-1。
1.了解中和反应反应热测定的原理及操作。2.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。
考点一 中和反应反应热及测定
考点二 盖斯定律及应用
1.中和反应反应热在25 ℃和101 kPa下,在稀溶液中,强酸的稀溶液和强碱的稀溶液发生中和反应生成________________时,放出________的热量。
1 ml H2O(l)
2.中和反应反应热的测定 (1)测定原理:通过简易量热计测定体系在反应前后的________变化,再利用有关物质的比热容来计算反应热。 (2)实验装置
具有保温性,减少热量的散失
(3)实验步骤测量并记录反应前体系的________温度为t1 ℃,测量并记录反应后体系的________温度为t2 ℃,重复上述步骤两次。
【应用示例】在中和反应反应热的测定实验中,使用弱酸或弱碱会使测得的中和反应反应热绝对值________(填“偏高”“不变”或“偏低”),其原因是___________________________________________________________。
弱酸或弱碱在水溶液中部分电离,在反应过程中,分子会继续电离,而电离是吸热的过程
例某化学实验小组用简易量热计(装置如图)测量中和反应的反应热,实验采用50 mL 0.5 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液反应。下列说法错误的是( ) 简易量热计示意图A.采用稍过量的NaOH溶液是为了保证盐酸完全被中和B.仪器a的作用是搅拌,减小测量误差C.NaOH溶液应迅速一次性倒入装有盐酸的内筒中D.反应前测完盐酸温度的温度计应立即插入NaOH溶液中测量温度
解析 若分多次倒入则热量损失大,C正确;反应前测完盐酸温度的温度计应洗净、擦干后再插入NaOH溶液中测量温度,D错误。
[对点训练] 中和反应是放热反应,下列关于中和反应反应热测定的说法错误的是( )A.等温条件下,试管中进行的中和反应,反应体系向空气中释放的热量就是反应的热效应B.测定中和反应反应热时,需要快速将两种溶液混合C.测定中和反应反应热时,最重要的是要保证实验装置的隔热效果D.不同的酸碱反应生成1 ml液态水释放的热量可能不相同
解析 等温条件下,试管中进行的中和反应,反应体系向环境中释放的热量就是反应的热效应,环境是指与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等,A错误;快速混合,防止热量散失,B正确;若用的是弱酸或弱碱,其电离需吸收一部分热量,D正确。
1.盖斯定律的内容一个化学反应,不管是一步完成的还是分几步完成的,其反应热是________的,这就是盖斯定律。 2.盖斯定律的理解盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的________和________有关,而与反应进行的________无关。 则有:ΔH=________=________________。
ΔH3+ΔH4+ΔH5
3.盖斯定律的应用根据盖斯定律,可以利用已知反应的反应热来计算未知反应的反应热。
【应用示例】碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知ΔH2=-299 kJ·ml-1,则ΔH1为_____________。
-1 703 kJ·ml-1
解析 由盖斯定律可知,ΔH1=2ΔH2+ΔH3-ΔH4=2×(-299 kJ·ml-1)+(-1 018 kJ·ml-1)-(+87 kJ·ml-1)=-1 703 kJ·ml-1。
考向1 盖斯定律的理解及应用例1(1)(2023·全国甲卷,28节选)已知下列反应的热化学方程式:①3O2(g)═2O3(g) ΔH1=+285 kJ·ml-1②2CH4(g)+O2(g)═2CH3OH(l) ΔH2=-329 kJ·ml-1反应③CH4(g)+O3(g)═CH3OH(l)+O2(g)的ΔH3=________ kJ·ml-1。
(2)(2023·全国乙卷,28节选)已知下列热化学方程式:FeSO4·7H2O(s)═FeSO4(s)+7H2O(g) ΔH1=a kJ·ml-1FeSO4·4H2O(s)═FeSO4(s)+4H2O(g) ΔH2=b kJ·ml-1FeSO4·H2O(s)═FeSO4(s)+H2O(g) ΔH3=c kJ·ml-1则FeSO4·7H2O(s)+FeSO4·H2O(s)═2(FeSO4·4H2O)(s)的ΔH=________ kJ·ml-1。
解析 将题给热化学方程式依次编号为①②③,根据盖斯定律,由①+③-②×2可得目标反应,故该反应的焓变ΔH=(a+c-2b) kJ·ml-1。
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=________(用含ΔH1、ΔH2的代数式表示)。
归纳总结利用盖斯定律计算反应热的两种方法 (1)虚拟路径法:根据题意虚拟物质的转化过程,然后根据盖斯定律列式求解,即可求出目标反应的反应热。
(2)方程加和法:分析题给热化学方程式,并进行适当加减得到目标热化学方程式,反应热也一并作相应的加减运算,思维流程如下:
[对点训练1] (1)(2022·湖北卷,19节选)
解析 (1)根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)═ Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·ml-1)+(-16.73 kJ·ml-1)+2×(-415.0 kJ·ml-1)=-911.9 kJ·ml-1。(2)根据盖斯定律,将反应①+反应②得到目标反应,则ΔH3=ΔH1+ΔH2=[+100.3+(-11.0)] kJ·ml-1=+89.3 kJ·ml-1。
下列推理不正确的是( )A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键之间存在相互作用,有利于物质稳定C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
解析 2ΔH1≈ΔH2<ΔH3,因此不能说碳碳双键加氢放出的热量与分子内碳碳双键数目成正比,A错误;ΔH2<ΔH3,说明单双键交替的物质能量低,更稳定,从而说明单双键交替的两个碳碳双键之间存在相互作用,有利于物质稳定, B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C正确; ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性,D正确。
[对点训练2] (2024·广东广州模拟)下列各组热化学方程式中,ΔH的比较正确的是( )
A.ΔH1<ΔH2B.ΔH3<ΔH4C.ΔH5<ΔH6D.ΔH7>ΔH8
思维建模反应热大小比较的依据
进阶1 练易错·避陷阱1.分别向1 L 0.5 ml·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH2<ΔH3C.ΔH1>ΔH2=ΔH3D.ΔH1=ΔH2<ΔH3
2.已知:H2O(g)═H2O(l) ΔH1C6H12O6(g)═C6H12O6(s) ΔH2C6H12O6(s)+6O2(g)═6H2O(g)+6CO2(g) ΔH3C6H12O6(g)+6O2(g)═6H2O(l)+6CO2(g) ΔH4下列说法正确的是( )A.ΔH1<0,ΔH2<0,ΔH3<ΔH4B.6ΔH1+ΔH2+ΔH3-ΔH4=0C.-6ΔH1+ΔH2+ΔH3-ΔH4=0D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
解析 由气态物质转化成液态物质或固态物质均放出热量,ΔH1<0,ΔH2<0,气态C6H12O6燃烧生成液态水比固态C6H12O6燃烧生成气态水放出热量多,所以ΔH3>ΔH4,A项错误;根据盖斯定律得ΔH4=6ΔH1+ΔH2+ΔH3,B项正确,C、D项错误。
进阶2 练热点·提素能3.(2023·广东江门检测)已知:①3C(s)+Al2O3(s)+N2(g)═2AlN(s)+3CO(g) ΔH1=+1 026 kJ·ml-1②2C(s)+O2(g)═2CO(g) ΔH2=-221 kJ·ml-1③2Al(s)+N2(g)═2AlN(s) ΔH3=-318 kJ·ml-1则反应2Al2O3(s)═4Al(s)+3O2(g)的ΔH等于( )A.+753 kJ·ml-1B.-753 kJ·ml-1C.+3 351 kJ·ml-1D.-3 351 kJ·ml-1
解析 由盖斯定律可知,将2×①-3×②-2×③得2Al2O3(s)═4Al(s)+3O2(g),则该反应的反应热ΔH=+1 026 kJ·ml-1×2-(-221 kJ·ml-1)×3-(-318 kJ·ml-1) ×2=+3 351 kJ·ml-1,综上所述,答案为C。
4.(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
则ΔH3=________ kJ·ml-1。
解析 根据反应Ⅰ-Ⅱ=Ⅲ,则ΔH3=ΔH1-ΔH2=-49.5 kJ·ml-1-(-90.4 kJ·ml-1)=+40.9 kJ·ml-1。
(2)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g)═CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)═CO(g)+H2O(g) ΔH1=+41 kJ·ml-1②CO(g)+2H2(g)═CH3OH(g) ΔH2=-90 kJ·ml-1总反应的ΔH=________ kJ·ml-1。
解析 二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g)═CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)═CO(g)+H2O(g) ΔH1=+41 kJ·ml-1,②CO(g)+2H2(g)═CH3OH(g) ΔH2=-90 kJ·ml-1。根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)═CH3OH(g)+H2O(g) ΔH=(+41 kJ·ml-1)+(-90 kJ·ml-1)=-49 kJ·ml-1。
进阶3 研真题·明考向5.(1)(2023·湖南卷,16节选)已知下列反应的热化学方程式:
解析 根据盖斯定律,反应④可由①-②-③得到,故ΔH4=ΔH1-ΔH2-ΔH3=(-4 386.9+4 263.1+241.8) kJ·ml-1=+118 kJ·ml-1。












