





备战2025届新高考化学一轮总复习第3章金属及其化合物第9讲碳酸钠与碳酸氢钠碱金属课件
展开1.结合真实情境中的应用实例或通过实验探究,了解碳酸钠和碳酸氢钠的主要性质。2.了解碱金属元素及其化合物性质的递变规律。
考点一 碳酸钠与碳酸氢钠
考点二 碱金属和焰色试验
情境思考查阅资料,碳酸氢钠可单独用作蒸馒头的膨松剂,但效果并不太好。若在和面时添加碳酸氢钠和食醋,蒸出的馒头会更理想。(1)单独用碳酸氢钠作蒸馒头的膨松剂,其原理是________________________________(用化学方程式表示)。 (2)在和面时添加碳酸氢钠和食醋,蒸出的馒头会更理想,其原因是______________________________________________________________ (结合离子方程式分析)。
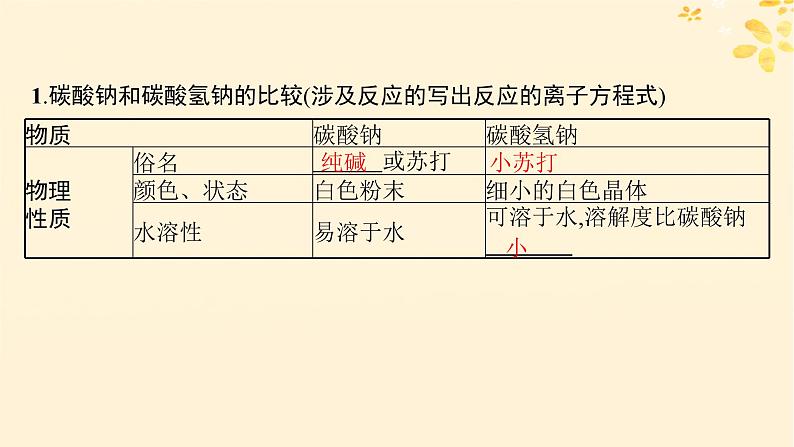
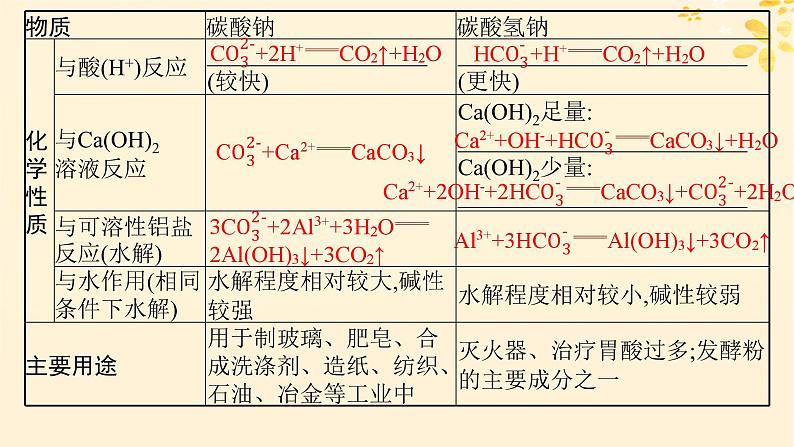
1.碳酸钠和碳酸氢钠的比较(涉及反应的写出反应的离子方程式)
2.Na2CO3和NaHCO3的相互转化
【应用示例】选择合适的试剂(或方法)除去括号内的杂质,并写出相应的化学方程式。(1)Na2CO3固体(NaHCO3): _______________,__________________________________。 (2)Na2CO3溶液(NaHCO3): _______________,__________________________________。(3)NaHCO3溶液(Na2CO3): _______________,__________________________________。
NaHCO3+NaOH══ Na2CO3+H2O
Na2CO3+CO2+H2O══ 2NaHCO3
3.碳酸钠、碳酸氢钠与酸反应的图像及分析
4.侯氏制碱法(1)工艺流程
(2)反应原理生成NaHCO3的反应:________________________________________。 生成Na2CO3的反应:________________________________________。 (3)物质循环循环使用的物质为________、_______________。
NH3+NaCl+CO2+H2O══ NaHCO3↓+NH4Cl
CO2 饱和食盐水
考向1 Na2CO3和NaHCO3的性质及相互转化例1两种固体分别是碳酸钠和碳酸氢钠,下列鉴别方法不合理的是( )
A.取两种固体溶于水,分别加入Ca(OH)2溶液,产生白色沉淀的是碳酸钠B.取两种固体分别滴入少量水,用温度计测量温度变化,升温的是碳酸钠C.取两种固体溶于水,分别加入少量稀盐酸,立即产生气体的是碳酸氢钠D.取两种固体分别装入A、B两试管,按如图装置进行实验,若b中的澄清石灰水出现浑浊而a中无明显现象,说明B试管中的固体是碳酸氢钠
解析 取两种固体溶于水,分别加入Ca(OH)2溶液都产生白色沉淀,A不合理;碳酸氢钠溶于水吸热,碳酸钠溶于水放热,取两种固体分别滴入少量水,用温度计测量温度变化,升温的是碳酸钠,B合理;取两种固体溶于水,分别加入少量稀盐酸,立即产生气体的是碳酸氢钠,C合理;取两种固体分别装入A、B两试管,按题给装置进行实验,若b中的澄清石灰水出现浑浊而a中无明显现象,说明试管B中的物质发生分解,该物质为碳酸氢钠,D合理。
[对点训练1] 下列有关Na2CO3和NaHCO3性质的比较正确的是( )A.热稳定性:Na2CO3
A.乙溶液中含有的溶质是Na2CO3、NaHCO3B.当0
A.标注NaCl的直线也能代表产生的CO2的物质的量的变化情况B.原混合物中Na2CO3和NaHCO3的物质的量之比为1∶2C.盐酸的浓度是0.05 ml·L-1D.原混合物中有10.6 g Na2CO3
考向3 实验探究侯氏制碱法的原理例3实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,下列说法错误的是( )
A.通过活塞K可控制CO2的流速B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸C.装置c中含氨的饱和食盐水提高了CO2的吸收效率D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
解析 关闭活塞K时,气体可将装置a球形容器内的液体压入漏斗内,从而使碳酸钙脱离液面,反应停止,通过调节活塞K可控制CO2的流速,A正确;装置b的作用是除去二氧化碳中混有的氯化氢,故装置b内应盛装饱和NaHCO3溶液,B错误;装置c中含氨的饱和食盐水呈碱性,CO2的溶解度增大,C正确;反应后将装置c中的锥形瓶浸入冷水,降温结晶,过滤得NaHCO3晶体,D正确。
[对点训练3] (2023·广东佛山一模)实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是( )
解析 由于CaCO3与稀硫酸反应生成的CaSO4是微溶物,覆盖在CaCO3表面阻止反应继续进行,故实验室制备CO2用CaCO3和稀盐酸,不用稀硫酸,A错误;向冷的氨化饱和食盐水中通入CO2,发生反应NaCl+H2O+NH3+CO2═ NaHCO3↓+NH4Cl,故可获得NaHCO3固体,B正确;加热固体不能用蒸发皿,应该用坩埚,C错误;加热固体时试管口需略向下倾斜,D错误。
1.碱金属的相似性和递变性
2.碱金属的特性(1)碱金属的密度随核电荷数的增大而增大,但钾的密度小于钠的密度。(2)碱金属一般保存在石蜡油或________中,但锂的密度小于煤油,故只能将锂保存在石蜡油中。 (3)点燃条件下,Na与O2反应生成________,但Li与O2生成________。
3.焰色试验(1)定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。焰色试验属于________变化,是元素的性质。 (2)实验操作:
(3)熟记重要金属元素的焰色
考向1 碱金属的性质递变及应用例1下列关于碱金属的叙述正确的是( )A.碱金属单质的密度随原子序数的增大而增大B.碱金属随着原子序数增大,与水反应的剧烈程度增大C.碱金属的原子半径越大,越易失电子,其还原性越弱D.碱金属单质的化学性质活泼,易从盐溶液中置换其他金属
解析 碱金属单质的密度随原子序数的增大而增大,但Na的密度大于K的密度,A错误;碱金属随着原子序数增大,越易失电子,与水反应越来越剧烈,B正确;碱金属的原子半径越大,越易失电子,其还原性越强,C错误;碱金属的化学性质活泼,进入盐溶液先与水反应,而不是与盐发生置换反应,D错误。
[对点训练1] (2023·广东茂名期末)实验小组为探究金属元素金属性的递变规律进行实验,主要实验包括:①分别加热Na、K单质观察现象;②镁条、Na单质分别与水反应;③分别配制浓度均为1.00 ml·L-1的NaOH溶液和AlCl3溶液,滴定观察现象。上述操作中,不需要用到的仪器为( )
解析 ①加热Na、K单质所需仪器为坩埚、坩埚钳、酒精灯等;②镁条、Na单质分别与水反应所需仪器为烧杯;③分别配制浓度均为1.00 ml·L-1的NaOH溶液和AlCl3溶液,滴定观察现象所需仪器为容量瓶、玻璃棒、胶头滴管、碱式滴定管、酸式滴定管、锥形瓶等。选项中A为坩埚,B为烧杯,C为分液漏斗,D为容量瓶,上述操作中,不需要用到的仪器为分液漏斗,故选C。
考向2 焰色试验原理及其应用例2利用焰色试验,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是( )A.非金属单质燃烧时火焰均为无色B.Na2SO4与NaOH灼烧时火焰颜色相同C.焰色试验均应透过蓝色钴玻璃观察D.只有金属单质灼烧时火焰才有颜色
解析 某些非金属单质燃烧时火焰也有颜色,如H2燃烧产生淡蓝色火焰,单质硫在空气中燃烧产生淡蓝色火焰,在纯氧中燃烧产生蓝紫色火焰,A错误;焰色试验是金属元素的性质,与元素的存在形式(化合态或游离态)无关,同种金属元素的焰色试验相同,Na2SO4、NaOH均含钠元素,灼烧时火焰颜色均为黄色,B正确;观察钾元素的焰色试验时需要透过蓝色钴玻璃,观察钠元素的焰色试验不需要,C错误;焰色试验是金属元素的性质,可以是金属单质或金属化合物,D错误。
[对点训练2] 下列有关焰色试验操作的描述正确的是( )A.取一根洁净的细铁丝,放在酒精灯上灼烧至与原来的焰色相同,再蘸取少量NaCl溶液,进行焰色试验B.焰色试验过程中生成了新物质,所以发生了颜色的变化C.铂丝在做完氯化钠溶液的焰色试验后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
解析 实验室常用洁净的铁丝进行焰色试验,A正确;焰色试验过程没有新物质生成,B错误;焰色试验实验结束后铂丝要用稀盐酸洗涤,不能用稀硫酸洗涤,C错误;黄光能掩盖紫光,含Na+的溶液中可能含有K+,D错误。
进阶1 练易错·避陷阱1.下列关于碳酸钠和碳酸氢钠的说法正确的是( )A.用澄清石灰水不能鉴别Na2CO3溶液和NaHCO3溶液B.相同温度时,碳酸氢钠的溶解度大于碳酸钠C.碳酸氢钠的热稳定性比碳酸钠强D.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3产生的CO2多
解析 碳酸氢钠、碳酸氢钾均受热分解生成碳酸盐、二氧化碳和水,A项正确;Na在空气中燃烧生成Na2O2,Li在空气中燃烧生成Li2O,B项错误;常温下镁不能和水剧烈反应,C项错误;酸性氧化物不都是非金属氧化物,例如Mn2O7为酸性氧化物、金属氧化物,D项错误。
2.向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1 ml·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是( )
进阶2 练热点·提素能3.(2023·广东汕尾统考)以不同类别物质间的转化为线索,认识钠及其化合物。下列分析错误的是( )
A.反应③说明CO2具有酸性氧化物的性质B.反应④说明NaHCO3的热稳定性强于Na2CO3C.反应⑤、⑥可用于潜水艇中氧气的供给D.常温下,Na和H2O反应生成NaOH和H2,说明Na是活泼金属
解析 反应③为2NaOH+CO2═Na2CO3+H2O,CO2与碱反应生成盐和水,说明CO2具有酸性氧化物的性质,A项正确;NaHCO3受热分解为Na2CO3,表明NaHCO3的热稳定性弱于Na2CO3,B项错误;Na2O2分别与CO2、H2O反应都能生成O2,因此反应⑤、⑥可用于潜水艇中氧气的供给,C项正确;常温时,Na和H2O反应生成NaOH和H2,说明Na是活泼金属,D项正确。
4.某小组设计如下装置和实验,探究碳酸钠及碳酸氢钠的部分性质,其中图③、图④装置同时放入90 ℃的水中,气球都膨胀,装有饱和碳酸氢钠溶液的容器上的气球膨胀得更快。下列说法正确的是( )
A.加盐酸前,图①和图②中溶液都显红色,后者稍深B.加盐酸过程中,图①气球开始有变化,图②气球开始无变化C.在图③和图④中,加热过程中都产生CO2气体D.在图③和图④发生反应的现象说明碳酸钠比碳酸氢钠稳定
解析 碳酸钠及碳酸氢钠溶液都显碱性,相同浓度时碳酸钠溶液的碱性更强,则前者颜色稍深,A错误。碳酸钠和少量盐酸反应生成的是碳酸氢钠,没有气体生成,继续滴加盐酸,生成氯化钠、二氧化碳和水,有气泡产生;碳酸氢钠与盐酸反应直接产生二氧化碳气体,则加盐酸过程中,图①气球开始无变化,图②气球开始有变化,B错误。碳酸钠受热不易分解,加热过程中图③不产生CO2气体,C错误。图③、图④装置同时放入90 ℃的水中,气球都膨胀,装有饱和碳酸氢钠溶液的容器上的气球膨胀得更快,说明碳酸氢钠不稳定,受热分解,则碳酸钠比碳酸氢钠稳定,D正确。
进阶3 研真题·明考向5.正误判断:正确的打“√”,错误的打“×”。(1)(2022·海南卷,1B)小苏打的主要成分是Na2CO3。( )(2)(2022·重庆卷,3B)Na和Li分别在O2中燃烧得到Na2O和Li2O。( )(3)(2022·全国乙卷,7D)焰火中红色来源于钠盐灼烧。( )(4)(2022·广东卷,6A)由于Na2CO3可与酸反应,故面包师用小苏打作发泡剂烘焙面包。( )(5)(2021·浙江6月选考卷,12C)Ca(HCO3)2的溶解度比CaCO3的大,则NaHCO3的溶解度比Na2CO3的大。( )
6.(2021·河北卷)化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
回答下列问题:(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是___________ (按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或_______________________________。
(2)B中使用雾化装置的优点是__________________________。
将玻璃塞上的凹槽对准漏斗颈部的小孔
使氨盐水雾化,可增大与二氧化碳的接触面积,从而提高产率
(3)生成NaHCO3的总反应的化学方程式为__________________________。(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,固体增重0.14 g,则固体NaHCO3的质量为________ g。 ②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为___________、___________、过滤、洗涤、干燥。
NH3·H2O+NaCl+CO2═NH4Cl+NaHCO3↓
(5)无水NaHCO3可作为基准物质标定盐酸的浓度。称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果________(填字母)。 A.偏大 B.偏小 C.不变
解析 (1)要制备NaHCO3,需先选用装置A制备二氧化碳,然后通入饱和碳酸氢钠溶液中除去二氧化碳中的HCl,再与饱和氨盐水充分接触来制备NaHCO3,其中过量的二氧化碳可被氢氧化钠溶液吸收,也能充分利用二氧化碳制备得到少量NaHCO3,故按气流方向正确的连接顺序应为aefbcgh;为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或将玻璃塞上的凹槽对准漏斗颈部的小孔。
新高考化学一轮复习课件第4章 第13讲 碳酸钠和碳酸氢钠 碱金属(含解析): 这是一份新高考化学一轮复习课件第4章 第13讲 碳酸钠和碳酸氢钠 碱金属(含解析),共60页。PPT课件主要包含了碳酸钠和碳酸氢钠,必备知识,应用举例,关键能力,碱金属焰色试验,真题演练明确考向,课时精练等内容,欢迎下载使用。
高考化学一轮复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件: 这是一份高考化学一轮复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件,共46页。PPT课件主要包含了Na2CO3,NaHCO3,纯碱或苏打,小苏打,2NaHCO3,3相互转化,2图像分析,强还原等内容,欢迎下载使用。
2025届高考化学一轮总复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件: 这是一份2025届高考化学一轮总复习第4章金属及其化合物第13讲碳酸钠和碳酸氢钠碱金属课件,共46页。PPT课件主要包含了Na2CO3,NaHCO3,纯碱或苏打,小苏打,2NaHCO3,3相互转化,2图像分析,强还原等内容,欢迎下载使用。












