

- 备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第27讲分子的性质配合物和超分子(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第28讲晶体结构与性质(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第30讲反应热的测定及计算(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第32讲电解池金属的腐蚀与防护(附解析) 试卷 0 次下载
备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第29讲反应热热化学方程式(附解析)
展开1.(2023·湖北卷,1)2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入高质量发展新阶段。下列不能作为火箭推进剂的是( )
A.液氮—液氢B.液氧—液氢
C.液态NO2—肼D.液氧—煤油
2.(2023·广东广州联考)中华传统文化蕴含着丰富的化学知识,下列诗句中主要涉及吸热反应的是( )
A.白居易《赋得古原草送别》:“野火烧不尽,春风吹又生。”
B.苏轼《石炭》:“投泥泼水愈光明,烁玉流金见精悍。”
C.于谦《咏煤炭》:“爝火燃回春浩浩,烘炉照破夜沉沉。”
D.李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”
3.(2024·湖南长沙高三模拟)工业合成三氧化硫的反应为2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ·ml-1,反应过程可用如图模拟(代表O2分子,代表SO2分子,代表催化剂)。下列说法正确的是( )
A.过程Ⅰ和过程Ⅳ决定了整个反应进行的程度
B.过程Ⅱ为放热反应,过程Ⅲ为吸热反应
C.1 ml SO2和1 ml O2反应,放出的热量小于99 kJ
D.催化剂可降低整个反应的活化能,因此使ΔH发生变化
4.(2023·广东广州检测)关于下图的说法不正确的是( )
A.1 ml I2(s)与1 ml H2(g)化合生成2 ml HI(g)时,需要吸收5 kJ的能量
B.2 ml HI(g)分解生成1 ml I2(g)与1 ml H2(g)时,需要吸收12 kJ的能量
C.1 ml I2(s)变为1 ml I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
5.汽车发动机工作时会引发N2和O2反应,其能量变化如图所示:
下列说法不正确的是( )
A.上述反应中N、O元素的化合价均有变化
B.N2(g)和O2(g)反应生成2 ml NO(g)时吸收183 kJ能量
C.1 ml气态氮原子转化成N2(g)时,能放出945 kJ能量
D.从图中数据可知N2比O2更稳定
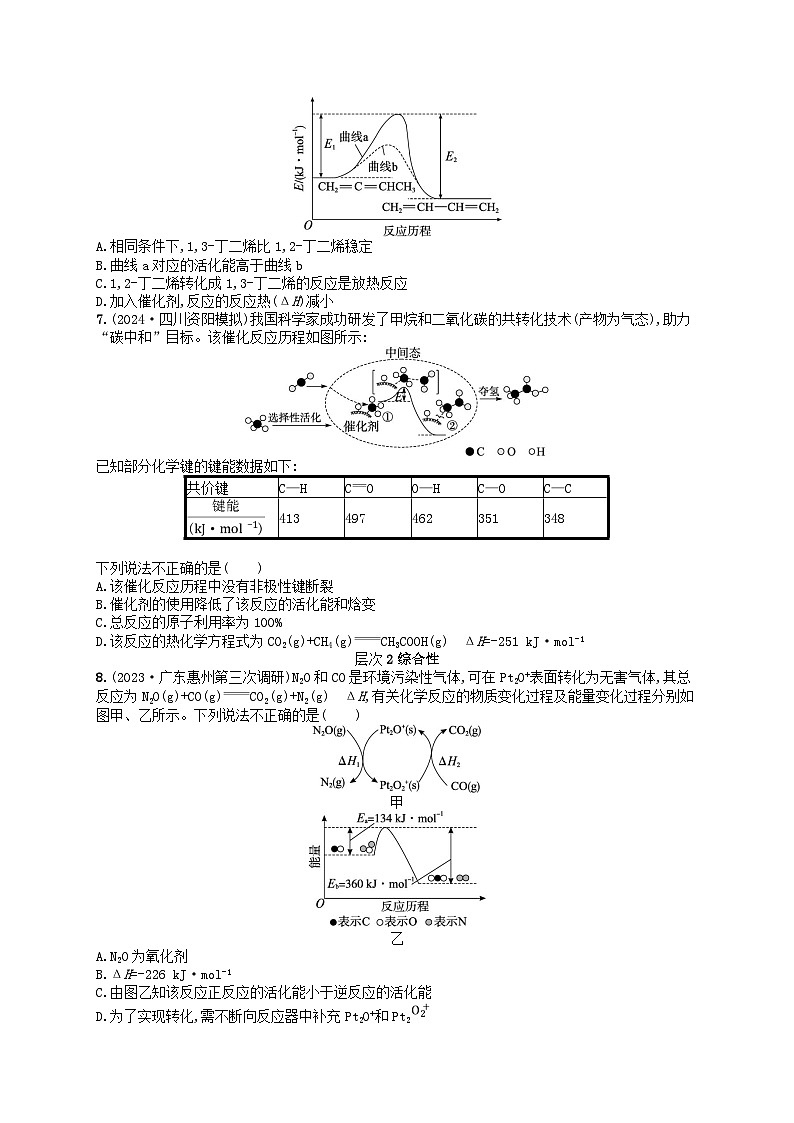
6.1,2-丁二烯(CH2CCHCH3)与1,3-丁二烯(CH2CHCHCH2)之间进行转化时的能量变化如图所示。下列说法错误的是( )
A.相同条件下,1,3-丁二烯比1,2-丁二烯稳定
B.曲线a对应的活化能高于曲线b
C.1,2-丁二烯转化成1,3-丁二烯的反应是放热反应
D.加入催化剂,反应的反应热(ΔH)减小
7.(2024·四川资阳模拟)我国科学家成功研发了甲烷和二氧化碳的共转化技术(产物为气态),助力“碳中和”目标。该催化反应历程如图所示:
已知部分化学键的键能数据如下:
下列说法不正确的是( )
A.该催化反应历程中没有非极性键断裂
B.催化剂的使用降低了该反应的活化能和焓变
C.总反应的原子利用率为100%
D.该反应的热化学方程式为CO2(g)+CH4(g)CH3COOH(g) ΔH=-251 kJ·ml-1
层次2综合性
8.(2023·广东惠州第三次调研)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其总反应为N2O(g)+CO(g)CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是( )
甲
乙
A.N2O为氧化剂
B.ΔH=-226 kJ·ml-1
C.由图乙知该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2
9.(2023·河北邢台检测)N2O是一种温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
途径Ⅰ:2N2O(g)2N2(g)+O2(g) ΔH>0
途径Ⅱ:向盛有N2O的容器中通入少量碘蒸气
①I2(g)2I(g)(快反应)
②I(g)+N2O(g)N2(g)+IO(g)(慢反应)
③2IO(g)+2N2O(g)2N2(g)+2O2(g)+I2(g)(快反应)
下列说法不正确的是( )
A.途径Ⅰ为吸热反应
B.反应②的活化能比反应③的小
C.IO为反应的中间产物
D.途径Ⅱ中I2为催化剂
10.工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是( )
A.NH2COONH4为合成尿素反应的中间产物
B.反应Ⅰ逆反应的活化能>反应Ⅱ正反应的活化能
C.反应Ⅱ在热力学上进行趋势较小
D.2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)的焓变ΔH=E1-E2
11.已知:在标准压强(100 kPa)、298 K,由最稳定的单质合成1 ml物质B的反应焓变,叫做物质B的标准摩尔生成焓,用ΔH(kJ·ml-1)表示。有关物质的ΔH有如图所示关系。下列有关判断正确的是( )
A.2 ml NO(g)的键能大于1 ml N2(g)与1 ml O2(g)的键能之和
B.H2O(l)的ΔH>-241.8 kJ·ml-1
C.N2H4(l)燃烧热ΔH为-534.2 kJ·ml-1
D.NH3比N2H4稳定
12.分析图像书写热化学方程式。
(1)图甲表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 ml气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: 。
(3)图丙表示一定条件下,在水溶液中1 ml Cl-、Cl(x=1,2,3,4)的能量相对大小。
①D是 (填离子符号)。
②反应BA+C的热化学方程式为 (用离子符号表示)。
13.(1)已知在25 ℃、101 kPa下:甲醇(l)的燃烧热ΔH为-727 kJ·ml-1,CO(g)的燃烧热ΔH为-283 kJ·ml-1,H2O(g)H2O(l) ΔH=-44 kJ·ml-1。则甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式为 。
(2)已知几种物质的燃烧热(kJ·ml-1)数据如下:
能表示C2H2(g)燃烧热的热化学方程式为 。
层次3创新性
14.(1)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·ml-1,CH3OH(l)+O2(g)CO2(g)+2H2(g) ΔH=-a kJ·ml-1,则a (填“>”“<”或“=”)726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 ml Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式: 。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·ml-1,则反应过程中,每转移1 ml电子放出的热量为 。
(4)CO2与H2在某催化剂的作用下反应如图所示:
写出该反应的热化学方程式: 。
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如C表示CO2吸附在催化剂表面)。
该反应历程中决速步反应的化学方程式为 。
第29讲 反应热 热化学方程式
1.A 解析 虽然氮气在一定条件下可以与氢气反应,而且是放热反应,但是N≡N键能很大,该反应的速率很慢,氢气不能在氮气中燃烧,在短时间内不能产生大量的热量和大量的气体,因此,液氮—液氢不能作为火箭推进剂,A符合题意;氢气可以在氧气中燃烧,反应速率很快且放出大量的热、生成大量气体,因此,液氧—液氢能作为火箭推进剂,B不符合题意;肼和NO2在一定条件下可以发生剧烈反应,该反应放出大量的热,且生成大量气体,因此,液态NO2—肼能作为火箭推进剂,C不符合题意;煤油可以在氧气中燃烧,反应速率很快且放出大量的热、生成大量气体,因此,液氧—煤油能作为火箭推进剂,D不符合题意。综上所述,本题选A。
2.B 解析 A项,体现了植物中的有机物燃烧产生CO2、H2O,反应过程放出热量,反应为放热反应;B项,以C、CO、H2为还原剂的氧化还原反应为吸热反应,高温时碳与水蒸气的反应为吸热反应;C项,体现了煤燃烧产生CO2,同时放出大量热量,使周围温度升高;D项,该诗句体现了蜡烛燃烧放出大量的热量,反应是放热反应;故选B。
3.C 解析 过程Ⅱ发生SO2、O2中共价键的断裂,过程Ⅲ形成SO3中的共价键,过程Ⅱ、Ⅲ决定了整个反应进行的程度,A项错误;过程Ⅱ为吸热过程,过程Ⅲ为放热过程,B项错误;2SO2(g)+O2(g)2SO3(g)反应可逆,1mlSO2和1mlO2反应生成SO3小于1ml,放出的热量小于99kJ,C项正确;催化剂可降低整个反应的活化能,从而加快反应速率,但不能使ΔH发生变化,D项错误。
4.D 解析 由图可知,1mlI2(s)和1mlH2(g)吸收5kJ能量生成2mlHI(g),A正确;1mlI2(g)和1mlH2(g)生成2mlHI(g)放出12kJ能量,则2mlHI(g)分解生成1mlI2(g)与1mlH2(g)时需要吸收12kJ的能量,B正确;1mlI2(g)变为1mlI2(s)放出17kJ的能量,则1ml固态碘变为1ml碘蒸气时需要吸收17kJ的能量,C正确;1mlI2(g)和1mlH2(g)生成2mlHI(g)放出12kJ能量,应为放热反应,D错误。
5.C 解析 N2和O2反应生成NO的反应中,N、O元素的化合价均有变化,A项正确;1mlN2(g)和1mlO2(g)中化学键断裂吸收的能量为945kJ+498kJ=1443kJ,形成2mlNO(g)中的化学键释放的能量为630kJ×2=1260kJ,则N2(g)和O2(g)反应生成2mlNO(g)时吸收能量1443kJ-1260kJ=183kJ,B项正确;1ml气态氮原子转化成N2(g)时,能放出945kJ÷2=472.5kJ能量,C项错误;从图中数据可知,1mlN2(g)中的化学键断裂需要吸收的能量大于1mlO2(g),则N2比O2更稳定,D项正确。
6.D 解析 根据图示可知,在相同条件下,1,3-丁二烯比1,2-丁二烯的能量更低,故1,3-丁二烯比1,2-丁二烯更稳定,A正确;使用催化剂能够降低反应的活化能,使反应在较低条件下发生,因而反应速率加快,根据图示可知曲线a对应的活化能高于使用催化剂时曲线b的活化能,B正确;由于1,2-丁二烯比1,3-丁二烯的能量高,故1,2-丁二烯转化成1,3-丁二烯时会放出热量,该反应是放热反应,C正确;加入催化剂,只能改变反应途径,降低反应的活化能,但不能改变反应物、生成物的能量,因此反应的反应热(ΔH)不变,D错误。
7.B 解析 由图可知,该反应的反应物为二氧化碳和甲烷,生成物为乙酸,则该催化反应历程中存在极性键的断裂,不存在非极性键断裂,A正确;催化剂的使用能降低反应的活化能,但不能改变反应的焓变,B错误;由图可知,总反应为二氧化碳与甲烷在催化剂作用下反应生成乙酸,则反应的原子利用率为100%,C正确;由图可知,总反应为二氧化碳与甲烷在催化剂作用下反应生成乙酸,反应方程式为CO2(g)+CH4(g)CH3COOH(g),反应的焓变ΔH=(497kJ·ml-1×2+413kJ·ml-1×4)-(413kJ·ml-1×3+348kJ·ml-1+351kJ·ml-1+497kJ·ml-1+462kJ·ml-1)=-251kJ·ml-1,D正确。
8.D 解析 反应N2O(g)+CO(g)CO2(g)+N2(g)中,N元素化合价降低,N2O为氧化剂,A正确;反应物能量高于生成物,反应为放热反应,反应焓变ΔH=Ea-Eb=134kJ·ml-1-360kJ·ml-1=-226kJ·ml-1,B正确;由图乙知该反应正反应的活化能Ea小于逆反应的活化能Eb,C正确;Pt2O+和Pt2是催化剂,催化剂在化学反应前后的化学性质和质量是不变的,无需不断补充,D错误。
9.B 解析 途径Ⅰ为化学键断裂的过程,是吸热反应,A正确;途径Ⅱ中反应②的速率比反应③慢,则途径Ⅱ中反应②的活化能比反应③大,B错误;根据途径Ⅱ的反应历程可知,IO在中间生成又消耗,所以为反应的中间产物,C正确;途径Ⅱ中I2参与反应最终又生成I2,所以I2为催化剂,D正确。
10.D 解析 从图像可知,合成尿素的过程中生成了NH2COONH4,其为合成尿素反应的中间产物,A正确;活化能是指化学反应中反应物分子到达活化分子所需的最小能量,由图像可知,反应Ⅰ逆反应的活化能>反应Ⅱ正反应的活化能,B正确;反应Ⅱ为吸热反应,在热力学上进行趋势较小,C正确;2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)为放热反应,ΔH=生成物的总能量-反应物的总能量<0,即ΔH=E2-E1,D错误。
11.D 解析 NO(g)的标准摩尔生成焓为91.3kJ·ml-1,故N2(g)+O2(g)2NO(g)的反应为吸热反应,即2mlNO(g)的键能小于1mlN2(g)与1mlO2(g)的键能之和,A错误;同种物质气态的能量高于液态的能量,H2O(l)的ΔH<-241.8kJ·ml-1,B错误;N2H4(l)的标准摩尔生成焓为50.6kJ·ml-1,故①N2(g)+2H2(g)N2H4(l) ΔH=+50.6kJ·ml-1,H2O(g)的标准摩尔生成焓为-241.8kJ·ml-1,故②O2(g)+2H2(g)2H2O(g) ΔH=-483.6kJ·ml-1,②-①可得N2H4(l)+O2(g)N2(g)+2H2O(g),但是标准燃烧热是指生成液态水,根据题意无法计算,C错误;N2H4(l)的标准摩尔生成焓为50.6kJ·ml-1,故①N2(g)+2H2(g)N2H4(l) ΔH=+50.6kJ·ml-1,NH3的标准摩尔生成焓为-45.9kJ·ml-1,故②N2(g)+3H2(g)2NH3(g) ΔH=-91.8kJ·ml-1,说明NH3的能量比N2H4低,故氨气较稳定,D正确。
12.答案 (1)NO2(g)+CO(g)NO(g)+CO2(g) ΔH=-234 kJ·ml-1
(2)H2Se(g)Se(s)+H2(g) ΔH=-81 kJ·ml-1
(3)①Cl ②3ClO-(aq)Cl(aq)+2Cl-(aq) ΔH=-117 kJ·ml-1
解析 (1)根据图甲可知,此反应是放热反应,热化学方程式为NO2(g)+CO(g)CO2(g)+NO(g) ΔH=(134-368)kJ·ml-1=-234kJ·ml-1。
(2)同主族元素从上到下非金属性逐渐减弱,其气态氢化物的稳定性逐渐降低,能量逐渐增大,则可确定a、b、c、d分别代表碲、硒、硫、氧元素。b代表硒元素,生成1mlH2Se(g)的ΔH=+81kJ·ml-1,则其分解反应的热化学方程式为H2Se(g)Se(s)+H2(g) ΔH=-81kJ·ml-1。
(3)D中氯元素的化合价为+7价,应为Cl;利用生成物的总能量减去反应物的总能量求得ΔH=(63-60×3)kJ·ml-1=-117kJ·ml-1,写出热化学方程式即可。
13.答案 (1)CH3OH(l)+O2(g)CO(g)+2H2O(g) ΔH=-356 kJ·ml-1
(2)C2H2(g)+O2(g)2CO2(g)+H2O(l) ΔH=-1 299.5 kJ·ml-1
解析 (1)目标反应为CH3OH(l)+O2(g)CO(g)+2H2O(g),反应热ΔH=-727kJ·ml-1-(-283kJ·ml-1)-(-44×2kJ·ml-1)=-356kJ·ml-1,则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为CH3OH(l)+O2(g)CO(g)+2H2O(g) ΔH=-356kJ·ml-1。
(2)在101kPa时,1ml纯物质完全燃烧生成指定产物时放出的热量为此物质的燃烧热,C2H2(g)燃烧热为ΔH=-1299.5kJ·ml-1,表示C2H2(g)燃烧热的热化学方程式为C2H2(g)+O2(g)2CO2(g)+H2O(l) ΔH=-1299.5kJ·ml-1。
14.答案 (1)<
(2)2Cl2(g)+2H2O(g)+C(s)4HCl(g)+CO2(g) ΔH=-290.0 kJ·ml-1
(3)98.0 kJ
(4)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-46 kJ·ml-1
(5)CO2(g)+2H*+2H2(g)COOH*+H*+2H2(g)[或CO2(g)+2H*COOH*+H*或CO2(g)+H*COOH*]
解析 (1)所述反应未完全燃烧,生成的氢气燃烧还要放出热量,则a<726.5。
(2)当有1mlCl2参与反应时释放出145.0kJ热量,该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)4HCl(g)+CO2(g) ΔH=-145.0kJ·ml-1×2=-290.0kJ·ml-1。
(3)4Al(s)+3TiO2(s)+3C(s)2Al2O3(s)+3TiC(s) ΔH=-1176.0kJ·ml-1,每转移12ml电子放出的热量为1176.0kJ,则反应过程中,每转移1ml电子放出的热量为kJ=98.0kJ。
(4)由反应图示可知图形与化学键对应关系为
ΔH=反应物总键能-生成物总键能=2×803kJ·ml-1+3×436kJ·ml-1-3×414kJ·ml-1-326kJ·ml-1-3×464kJ·ml-1=-46kJ·ml-1。
(5)据图可知CO2(g)+2H*+2H2(g)COOH*+H*+2H2(g)活化能最大,是决速步骤。共价键
C—H
CO
O—H
C—O
C—C
413
497
462
351
348
物质
CH4(g)
C2H2(g)
C2H4(g)
H2(g)
-890.3
-1 299.5
-1 411.0
-285.8
化学键
436
326
803
464
414
H—H
C—O
CO
O—H
C—H
2025版高考化学一轮总复习提升训练第六章化学反应与能量第二十讲反应热及计算考点二热化学方程式燃烧热微考点一热化学方程式的书写: 这是一份2025版高考化学一轮总复习提升训练第六章化学反应与能量第二十讲反应热及计算考点二热化学方程式燃烧热微考点一热化学方程式的书写,共3页。试卷主要包含了写出下列反应的热化学方程式等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第1章物质及其变化第3讲离子方程式的书写及正误判断(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第1章物质及其变化第3讲离子方程式的书写及正误判断(附解析),共5页。试卷主要包含了下列离子方程式书写正确的是,下列离子方程式正确的是,含硫化合物的反应具有多样性,下列有关离子方程式正确的是等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析),共6页。试卷主要包含了M、N、P、E四种金属,已知,2 ml e-,阴极生成0等内容,欢迎下载使用。












