
- 备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第28讲晶体结构与性质(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第29讲反应热热化学方程式(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第32讲电解池金属的腐蚀与防护(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第33讲多池或多室电化学装置及分析(附解析) 试卷 0 次下载
备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第30讲反应热的测定及计算(附解析)
展开1.(2023·四川成都联考)下列关于热化学反应的描述错误的是( )
A.由C(s,石墨)C(s,金刚石) ΔH=+1.9 kJ·ml-1可知,石墨能量更高,燃烧热更大
B.已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1,则在一定条件下将2 ml N2和6 ml H2置于一密闭容器中充分反应,放出的热量小于184.8 kJ
C.在稀溶液中:H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·ml-1,若将含1 ml CH3COOH的醋酸溶液与含1 ml NH3·H2O的溶液混合,放出的热量小于57.3 kJ
D.中和热测定实验中可用塑料材质的环形搅拌器代替环形玻璃搅拌器
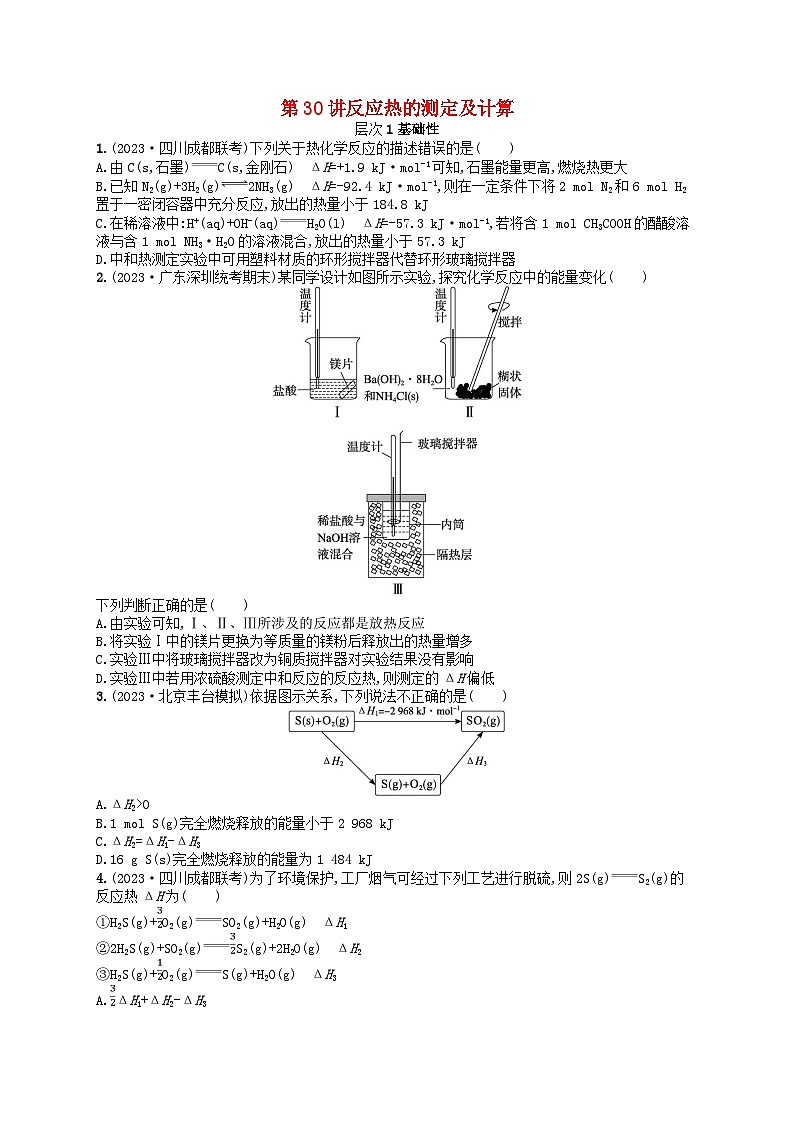
2.(2023·广东深圳统考期末)某同学设计如图所示实验,探究化学反应中的能量变化( )
下列判断正确的是( )
A.由实验可知,Ⅰ、Ⅱ、Ⅲ所涉及的反应都是放热反应
B.将实验Ⅰ中的镁片更换为等质量的镁粉后释放出的热量增多
C.实验Ⅲ中将玻璃搅拌器改为铜质搅拌器对实验结果没有影响
D.实验Ⅲ中若用浓硫酸测定中和反应的反应热,则测定的ΔH偏低
3.(2023·北京丰台模拟)依据图示关系,下列说法不正确的是( )
A.ΔH2>0
B.1 ml S(g)完全燃烧释放的能量小于2 968 kJ
C.ΔH2=ΔH1-ΔH3
D.16 g S(s)完全燃烧释放的能量为1 484 kJ
4.(2023·四川成都联考)为了环境保护,工厂烟气可经过下列工艺进行脱硫,则2S(g)S2(g)的反应热ΔH为( )
①H2S(g)+O2(g)SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)S(g)+H2O(g) ΔH3
A.ΔH1+ΔH2-ΔH3
B.ΔH1+ΔH2-2ΔH3
C.ΔH1-ΔH2+2ΔH3
D.ΔH1+ΔH2-ΔH3
5.已知:2H2(g)+O2(g)2H2O(g) ΔH1
3H2(g)+Fe2O3(s)2Fe(s)+3H2O(g) ΔH2
2Fe(s)+O2(g)Fe2O3(s) ΔH3
2Al(s)+O2(g)Al2O3(s) ΔH4
2Al(s)+Fe2O3(s)Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1<0,ΔH3>0B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3D.ΔH3=ΔH4+ΔH5
6.(2023·广东佛山检测)依据下列热化学方程式得出的结论中,正确的是( )
A.已知2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·ml-1,则氢气的燃烧热ΔH为-241.8 kJ·ml-1
B.已知C(石墨,s)C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·ml-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)2CO2(g) ΔH1,2C(s)+O2(g)2CO(g) ΔH2,则ΔH1>ΔH2
7.(1)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200 ℃时:ⅰ.3N2H4(g)N2(g)+4NH3(g) ΔH1=-32.9 kJ·ml-1;
ⅱ.N2H4(g)+H2(g)2NH3(g) ΔH2=-41.8 kJ·ml-1。
则200 ℃时,肼分解成氮气和氢气的热化学方程式为 。
(2)研究CO2的利用对促进低碳社会的构建具有重要意义。工业上利用废气中的CO2合成CH3OH,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·ml-1
反应Ⅱ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH2
反应Ⅲ:CH3OCH3(g)+H2O(g)2CH3OH(g) ΔH3=+23.4 kJ·ml-1
已知某些化学键的键能数据如下:
氢气中的H—H比甲醇中的C—H (填“强”或“弱”)。用盖斯定律计算反应Ⅱ中的ΔH2= kJ·ml-1。
(3)基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。
总反应3C(s)+N2(g)+3H2O(l)3CO(g)+2NH3(g) ΔH= kJ·ml-1。
层次2综合性
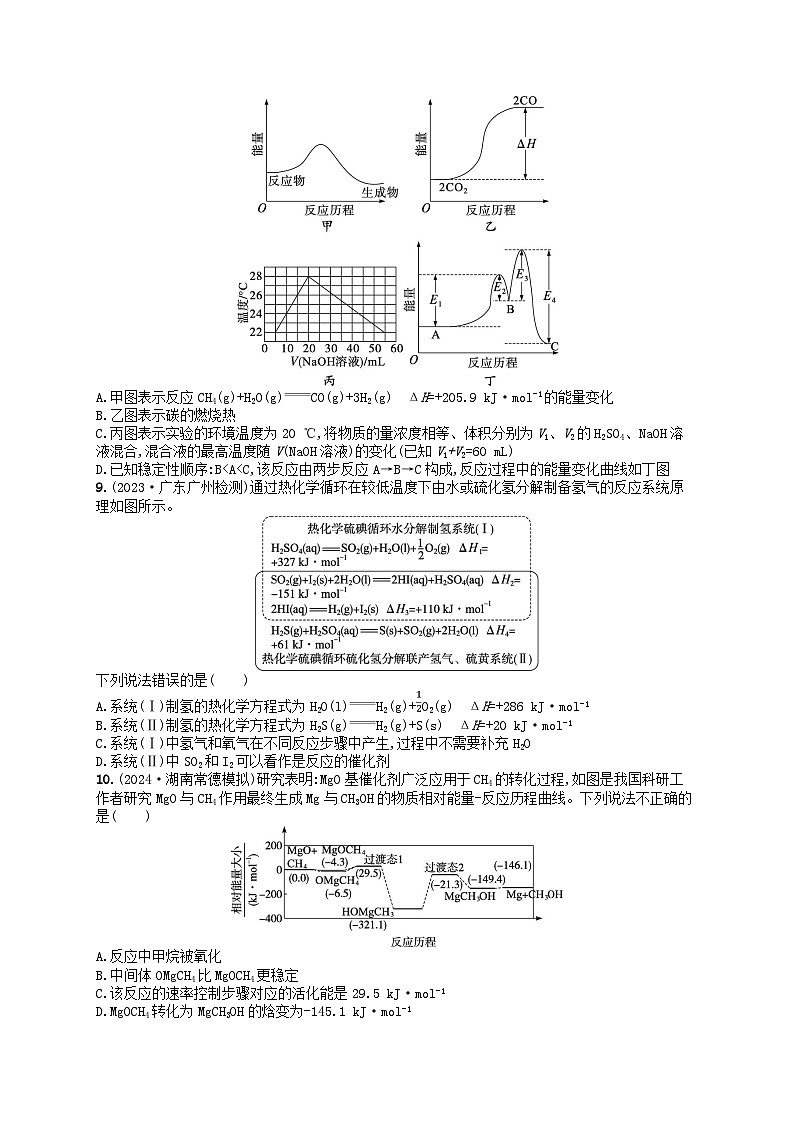
8.下列示意图表示正确的是( )
A.甲图表示反应CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+205.9 kJ·ml-1的能量变化
B.乙图表示碳的燃烧热
C.丙图表示实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,混合液的最高温度随V(NaOH溶液)的变化(已知V1+V2=60 mL)
D.已知稳定性顺序:B
下列说法错误的是( )
A.系统(Ⅰ)制氢的热化学方程式为H2O(l)H2(g)+O2(g) ΔH=+286 kJ·ml-1
B.系统(Ⅱ)制氢的热化学方程式为H2S(g)H2(g)+S(s) ΔH=+20 kJ·ml-1
C.系统(Ⅰ)中氢气和氧气在不同反应步骤中产生,过程中不需要补充H2O
D.系统(Ⅱ)中SO2和I2可以看作是反应的催化剂
10.(2024·湖南常德模拟)研究表明:MgO基催化剂广泛应用于CH4的转化过程,如图是我国科研工作者研究MgO与CH4作用最终生成Mg与CH3OH的物质相对能量-反应历程曲线。下列说法不正确的是( )
A.反应中甲烷被氧化
B.中间体OMgCH4比MgOCH4更稳定
C.该反应的速率控制步骤对应的活化能是29.5 kJ·ml-1
D.MgOCH4转化为MgCH3OH的焓变为-145.1 kJ·ml-1
11.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究重点。
Ⅰ.已知:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·ml-1
H2(g)+Cl2(g)2HCl(g) ΔH=-184 kJ·ml-1
(1)H2与O2反应生成气态水的热化学方程式是 。
(2)断开1 ml H—O所需能量为 kJ。
Ⅱ.已知:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.2 kJ·ml-1①
CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247.4 kJ·ml-1②
又知CH4的燃烧热ΔH为-890.3 kJ·ml-1。
(3)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(5)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是 ,等物质的量的A、H2化学能较低的物质是 。
12.(2023·广东卷)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总·ΔT计算获得。
(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 ml·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。
①上述滴定操作用到的仪器有 (填字母)。
②该盐酸浓度为 ml·L-1。
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为 J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
①温度:b (填“>”“<”或“=”)c。
②ΔH= (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是 。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和 (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 。
层次3创新性
13.(1)乙烯是现代工业的重要原材料,中科院设计完成了在催化剂作用下CO2氧化C2H6制取C2H4的新路径,发生的主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g) ΔH1=+177 kJ·ml-1
Ⅱ.C2H6(g)+2CO2(g)3H2(g)+4CO(g) ΔH2=+430 kJ·ml-1
根据盖斯定律,反应C2H6(g)+2CO(g)+3H2(g)2C2H4(g)+2H2O(g)的ΔH= kJ·ml-1。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ·ml-1
②2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·ml-1
③N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1
则反应:④4NH3(g)+5O2(g)4NO(g)+6H2O(g)的ΔH= kJ·ml-1。根据RlnKp=-+C(C为常数),由图中的数据可推知,该反应的反应热为 kJ·ml-1(保留小数点后2位),图中表示的热化学方程式是 (填序号)。
第30讲 反应热的测定及计算
1.A 解析 吸热反应,反应物的总能量低于生成物的总能量,由C(s,石墨)C(s,金刚石) ΔH=+1.9kJ·ml-1可知,石墨能量更低,燃烧热更小,A错误;已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ·ml-1,N2与H2反应为可逆反应,进行不完全,则在一定条件下将2mlN2和6mlH2置于一密闭容器中充分反应,放出的热量小于184.8kJ,B正确;在稀溶液中:H+(aq)+OH-(aq)H2O(l) ΔH=-57.3kJ·ml-1,弱电解质溶于水吸收热量,盐水解也为吸热反应,故将含1mlCH3COOH的醋酸溶液与含1mlNH3·H2O的溶液混合,放出的热量小于57.3kJ,C正确;塑料材质不易导热,传热缓慢,测定中和热时可用塑料材质的环形搅拌器代替环形玻璃搅拌器,D正确。
2.D 解析 Ⅰ中为镁与盐酸反应置换氢气的过程,属于放热反应,Ⅱ为Ba(OH)2·8H2O与NH4Cl反应的过程,属于吸热反应,Ⅲ涉及的是稀盐酸与氢氧化钠溶液发生的中和反应,属于放热反应,A错误;将实验Ⅰ中的镁片更换为等质量的镁粉,固体的接触面积增大,会加快反应速率,但不会增大反应生成氢气的量,所以不会改变反应放出的热量,B错误;铜导热性好,所以实验Ⅲ中将玻璃搅拌器改为铜质搅拌器会使放出的热量有损失,C错误;浓硫酸溶于水放出热量,所以实验Ⅲ中若用浓硫酸测定中和反应的反应热,对应ΔH会偏低,D正确。
3.B 解析 硫固体转化为硫蒸气的过程为吸热过程,A正确;硫蒸气的能量高于硫固体,B错误;由盖斯定律可知,焓变ΔH2+ΔH3=ΔH1,则焓变ΔH2=ΔH1-ΔH3,C正确;由图可知,16g硫固体完全燃烧释放的能量为×2968kJ·ml-1=1484kJ,D正确。
4.B 解析 根据盖斯定律可知目标方程式2S(g)S2(g),可由①+②-2③得到,则其ΔH=ΔH1+ΔH2-2ΔH3,故选B。
5.B 解析 燃烧反应都是放热反应,故ΔH3<0,A错误;将题述反应分别编号为①②③④⑤,反应⑤是铝热反应,显然是放热反应,ΔH5<0,反应④-反应③可得反应⑤,即ΔH5=ΔH4-ΔH3<0,B正确,D错误;反应②+反应③可得反应3H2(g)+O2(g)3H2O(g),故ΔH1=(ΔH2+ΔH3),C错误。
6.C 解析 2H2(g)+O2(g)2H2O(g) ΔH=-483.6kJ·ml-1中的水是气体,所以不能得出氢气的燃烧热ΔH是-241.8kJ·ml-1,A错误;已知C(石墨,s)C(金刚石,s) ΔH>0,石墨能量低于金刚石,能量越低越稳定,所以石墨比金刚石稳定,B错误;已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4kJ·ml-1,则含20.0gNaOH物质的量为0.5ml的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,C正确;已知2C(s)+2O2(g)2CO2(g) ΔH1①,2C(s)+O2(g)2CO(g) ΔH2②,①-②得到:2CO(g)+O2(g)2CO2(g) ΔH1-ΔH2,一氧化碳燃烧生成二氧化碳是放热反应,焓变为负值,所以ΔH1<ΔH2,D错误。
7.答案 (1)N2H4(g)N2(g)+2H2(g) ΔH=+50.7 kJ·ml-1 (2)强 -121.4 (3)+434.0
解析 (1)根据盖斯定律ⅰ-2×ⅱ得肼分解成氮气和氢气的热化学方程式:N2H4(g)N2(g)+2H2(g) ΔH=-32.9kJ·ml-1-(-41.8kJ·ml-1)×2=+50.7kJ·ml-1。
(2)ΔH=反应物的总键能-生成物的总键能,根据反应Ⅰ,ΔH1=2+3EH—H-(3EC—H+EC—O+3EO—H),代入题表数据可得EH—H-EC—H=63kJ·ml-1>0,故氢气中的H—H比甲醇中的C—H强。根据盖斯定律可知,反应Ⅱ=反应Ⅰ×2-反应Ⅲ,故ΔH2=2ΔH1-ΔH3=-121.4kJ·ml-1。
(3)将反应ⅰ和反应ⅱ相加,即可得到总反应3C(s)+N2(g)+3H2O(l)3CO(g)+2NH3(g) ΔH=+708.1kJ·ml-1+(-274.1kJ·ml-1)=+434.0kJ·ml-1。
8.D 解析 甲图中反应物能量高于生成物能量,是放热反应,而A选项中的热化学方程式是吸热反应,故A错误;乙图体现的是CO2转化成CO的能量变化,而碳的燃烧热是1mlC全部转化成CO2放出的热量,故B错误;丙图中V2为20mL时,温度最高,说明此时酸碱反应完全,又因为实验中始终保持V1+V2=60mL,则V1=40mL,由酸碱中和反应关系式:2NaOH~H2SO4可知,H2SO4和NaOH溶液的浓度不同,和题干不符,故C错误。
9.C 解析 将题给热化学方程式依次编号为①、②、③、④,由盖斯定律可知,①+②+③可得系统(Ⅰ)制氢的反应H2O(l)H2(g)+O2(g),则反应焓变ΔH=(+327kJ·ml-1)+(-151kJ·ml-1)+(+110kJ·ml-1)=+286kJ·ml-1,反应的热化学方程式为H2O(l)H2(g)+O2(g) ΔH=+286kJ·ml-1,A正确;由盖斯定律可知,②+③+④可得系统(Ⅱ)制氢的反应H2S(g)H2(g)+S(s),则反应焓变ΔH=(-151kJ·ml-1)+(+110kJ·ml-1)+(+61kJ·ml-1)=+20kJ·ml-1,反应的热化学方程式为H2S(g)H2(g)+S(s) ΔH=+20kJ·ml-1,B正确;由盖斯定律可知,①+②+③可得系统(Ⅰ)制氢的反应H2O(l)H2(g)+O2(g),反应中消耗水,所以反应过程中需要补充水,C错误;由盖斯定律可知,②+③+④可得系统(Ⅱ)制氢的反应H2S(g)H2(g)+S(s),则系统(Ⅱ)中二氧化硫和碘可以看作是反应的催化剂,D正确。
10.C 解析 由图可知,该过程的总反应为MgO+CH4Mg+CH3OH,反应过程中CH4中C元素的化合价升高,被氧化,A项正确;能量越低越稳定,由图可知,中间体OMgCH4的能量比MgOCH4更低,则OMgCH4比MgOCH4更稳定,B项正确;该反应的反应速率取决于活化能最大的步骤,由图可知,活化能最大的步骤是HOMgCH3到MgCH3OH的步骤,该步骤的活化能为299.8kJ·ml-1,C项错误;由图可知,MgOCH4转化为MgCH3OH的焓变为-149.4kJ·ml-1-(-4.3kJ·ml-1)=-145.1kJ·ml-1,D项正确。
11.答案 Ⅰ.(1)2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·ml-1(答案合理即可)
(2)462.9
Ⅱ.(3)CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890.3 kJ·ml-1
(4)CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=+165.0 kJ·ml-1
(5)H、O(或氢原子、氧原子) H2
解析 Ⅰ.(1)根据盖斯定律,由第一个热化学方程式+第二个热化学方程式×2可得2H2(g)+O2(g)2H2O(g) ΔH=-115.6kJ·ml-1-184kJ·ml-1×2=-483.6kJ·ml-1。(2)反应2H2(g)+O2(g)2H2O(g)发生过程中断裂2mlH—H和1mlOO,形成4mlH—O,则2E(H—H)+E(OO)-4E(H—O)=-483.6kJ·ml-1,则E(H—O)=kJ·ml-1=462.9kJ·ml-1,即断开1mlH—O所需能量为462.9kJ。
Ⅱ.(3)由CH4的燃烧热ΔH为-890.3kJ·ml-1可得甲烷完全燃烧的热化学方程式为CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890.3kJ·ml-1。
(4)根据盖斯定律,由①×2-②即可得到CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=+165.0kJ·ml-1。
(5)观察图像信息知,高温时水先分解生成H2、O2,然后两种单质分子可继续分解成氢原子、氧原子,由于氢原子比氧原子多,故A是氢原子,B是氧原子。氢气分子分解成氢原子时需要吸收能量,故化学能较低的物质是氢气分子。
12.答案 (1)①AD ②0.550 0
(2)418(T1-T0)
(3)①> ②-20.9(b-a) kJ·ml-1或-41.8(c-a) kJ·ml-1
(4)抑制Fe3+水解 Fe+2H+Fe2++H2↑
将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应热,计算得到反应Cu+Fe2(SO4)3CuSO4+2FeSO4的焓变ΔH1;根据(3)中实验计算得到反应Fe+CuSO4Cu+FeSO4的焓变ΔH2;根据盖斯定律计算得到反应Fe+Fe2(SO4)33FeSO4的焓变为ΔH1+ΔH2
(5)燃料燃烧(或铝热反应焊接铁轨等)
解析 本题考查了基本操作仪器的选用、热化学基础知识、水解原理应用等综合知识。
(1)①滴定操作时需要用的仪器有锥形瓶、酸式滴定管、碱式滴定管、铁架台等,故选AD;②滴定时发生的反应为HCl+NaOHNaCl+H2O,故c(HCl)==0.5500ml·L-1。
(2)由Q=cρV总·ΔT可得Q=4.18J·g-1·℃-1×1.0g·mL-1×(50mL+50mL)×(T1-T0)=418(T1-T0)。
(3)100mL0.20ml·L-1CuSO4溶液含有溶质的物质的量为0.02ml,1.20gFe粉和0.56gFe粉的物质的量分别为0.021ml、0.01ml,实验ⅰ中有0.02mlCuSO4发生反应,实验ⅱ中有0.01mlCuSO4发生反应,实验ⅰ放出的热量多,则b>c;若按实验ⅰ进行计算,ΔH=-kJ·ml-1=-20.9(b-a)kJ·ml-1;若按实验ⅱ进行计算,ΔH=kJ·ml-1=-41.8(c-a)kJ·ml-1。
(4)Fe3+易水解,为防止Fe3+水解,在配制Fe2(SO4)3溶液时需加入酸;用pH试纸测得Fe2(SO4)3溶液的pH不大于1说明溶液呈强酸性,向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡即氢气产生,说明溶液中还存在Fe与酸的反应,其离子方程式为Fe+2H+Fe2++H2↑;乙同学根据相关原理,重新设计优化的实验方案的重点为如何防止Fe与酸反应产生影响,可以借助盖斯定律,设计分步反应来实现Fe2(SO4)3溶液与Fe的反应,故可将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应热,计算得到反应Cu+Fe2(SO4)3CuSO4+2FeSO4的焓变ΔH1;根据(3)中实验计算得到反应Fe+CuSO4Cu+FeSO4的焓变ΔH2;根据盖斯定律计算得到反应Fe+Fe2(SO4)33FeSO4的焓变为ΔH1+ΔH2。
(5)化学能转化为热能在生产和生活中应用比较广泛,化石燃料的燃烧、炸药开山、发射火箭等都是化学能转化为热能的应用,另外铝热反应焊接铁轨也是化学能转化为热能的应用。
13.答案 (1)-76 (2)-905 -92.45 ③
解析 (1)已知反应Ⅰ.C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g) ΔH1=+177kJ·ml-1,反应Ⅱ.C2H6(g)+2CO2(g)3H2(g)+4CO(g) ΔH2=+430kJ·ml-1,则目标反应C2H6(g)+2CO(g)+3H2(g)2C2H4(g)+2H2O(g)可由2×Ⅰ-Ⅱ得到,根据盖斯定律,反应C2H6(g)+2CO(g)+3H2(g)2C2H4(g)+2H2O(g)的ΔH=2ΔH1-ΔH2=2×(+177kJ·ml-1)-(+430kJ·ml-1)=-76kJ·ml-1。
(2)依据盖斯定律可知,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)可由①×2+②×3-③×2得到,则焓变ΔH=2×(+180.5kJ·ml-1)+3×(-483.6kJ·ml-1)-2×(-92.4kJ·ml-1)=-905kJ·ml-1;由图像数据代入RlnKp=-+C,-3.710=-2.113ΔH+C,-61.678=-1.486ΔH+C,二式联立可得ΔH≈-92.45kJ·ml-1,即该反应的反应热ΔH≈-92.45kJ·ml-1;依据反应热可知,图中表示的方程式是③。
化学键
CO
C—O
O—H
750
343
465
序号
反应试剂
体系温度/℃
反应前
反应后
ⅰ
0.20 ml·L-1 CuSO4 溶液100 mL
1.20 gFe粉
a
b
ⅱ
0.56 gFe粉
a
c
2025版高考化学一轮总复习真题演练第6章化学反应与能量第20讲反应热及计算: 这是一份2025版高考化学一轮总复习真题演练第6章化学反应与能量第20讲反应热及计算,共4页。
2025版高考化学一轮总复习第6章化学反应与能量第20讲反应热及计算提能训练: 这是一份2025版高考化学一轮总复习第6章化学反应与能量第20讲反应热及计算提能训练,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析),共6页。试卷主要包含了M、N、P、E四种金属,已知,2 ml e-,阴极生成0等内容,欢迎下载使用。












