- 备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第26讲分子的空间结构(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第27讲分子的性质配合物和超分子(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第29讲反应热热化学方程式(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第30讲反应热的测定及计算(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第31讲原电池和化学电源(附解析) 试卷 0 次下载
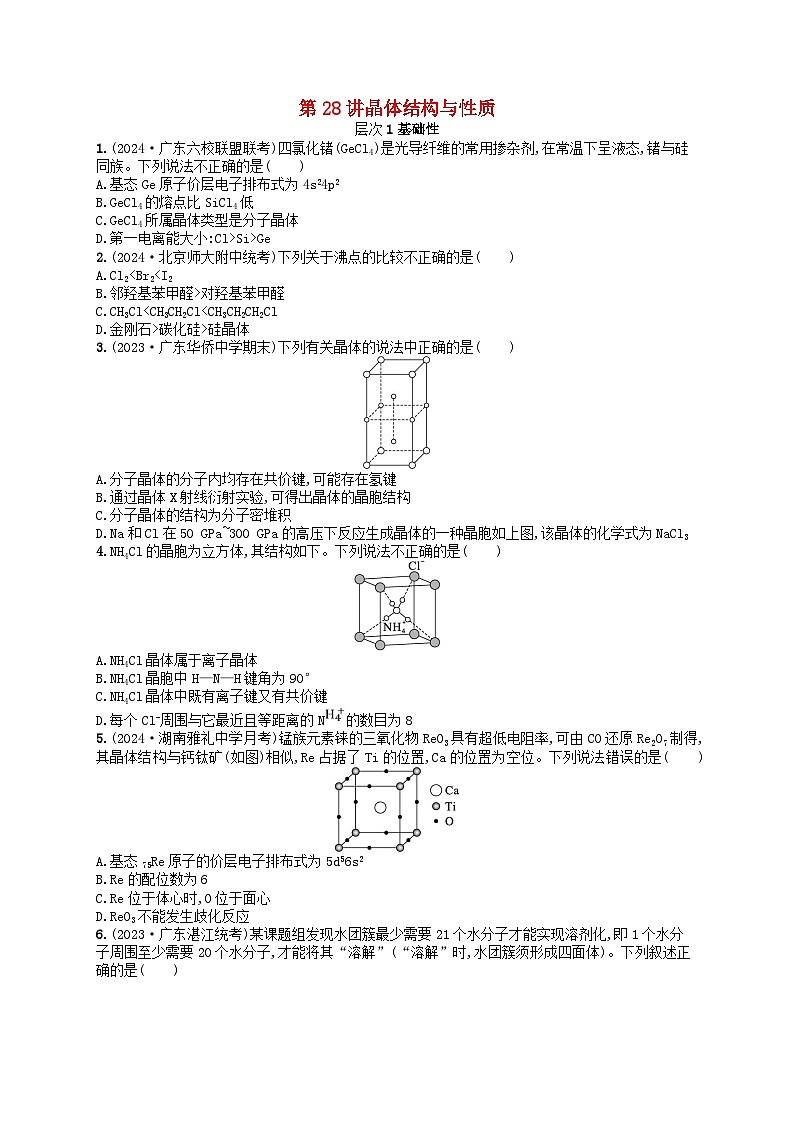
备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第28讲晶体结构与性质(附解析)
展开1.(2024·广东六校联盟联考)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,在常温下呈液态,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4所属晶体类型是分子晶体
D.第一电离能大小:Cl>Si>Ge
2.(2024·北京师大附中统考)下列关于沸点的比较不正确的是( )
A.Cl2
C.CH3Cl
3.(2023·广东华侨中学期末)下列有关晶体的说法中正确的是( )
A.分子晶体的分子内均存在共价键,可能存在氢键
B.通过晶体X射线衍射实验,可得出晶体的晶胞结构
C.分子晶体的结构为分子密堆积
D.Na和Cl在50 GPa~300 GPa的高压下反应生成晶体的一种晶胞如上图,该晶体的化学式为NaCl3
4.NH4Cl的晶胞为立方体,其结构如下。下列说法不正确的是( )
A.NH4Cl晶体属于离子晶体
B.NH4Cl晶胞中H—N—H键角为90°
C.NH4Cl晶体中既有离子键又有共价键
D.每个Cl-周围与它最近且等距离的N的数目为8
5.(2024·湖南雅礼中学月考)锰族元素铼的三氧化物ReO3具有超低电阻率,可由CO还原Re2O7制得,其晶体结构与钙钛矿(如图)相似,Re占据了Ti的位置,Ca的位置为空位。下列说法错误的是( )
A.基态75Re原子的价层电子排布式为5d56s2
B.Re的配位数为6
C.Re位于体心时,O位于面心
D.ReO3不能发生歧化反应
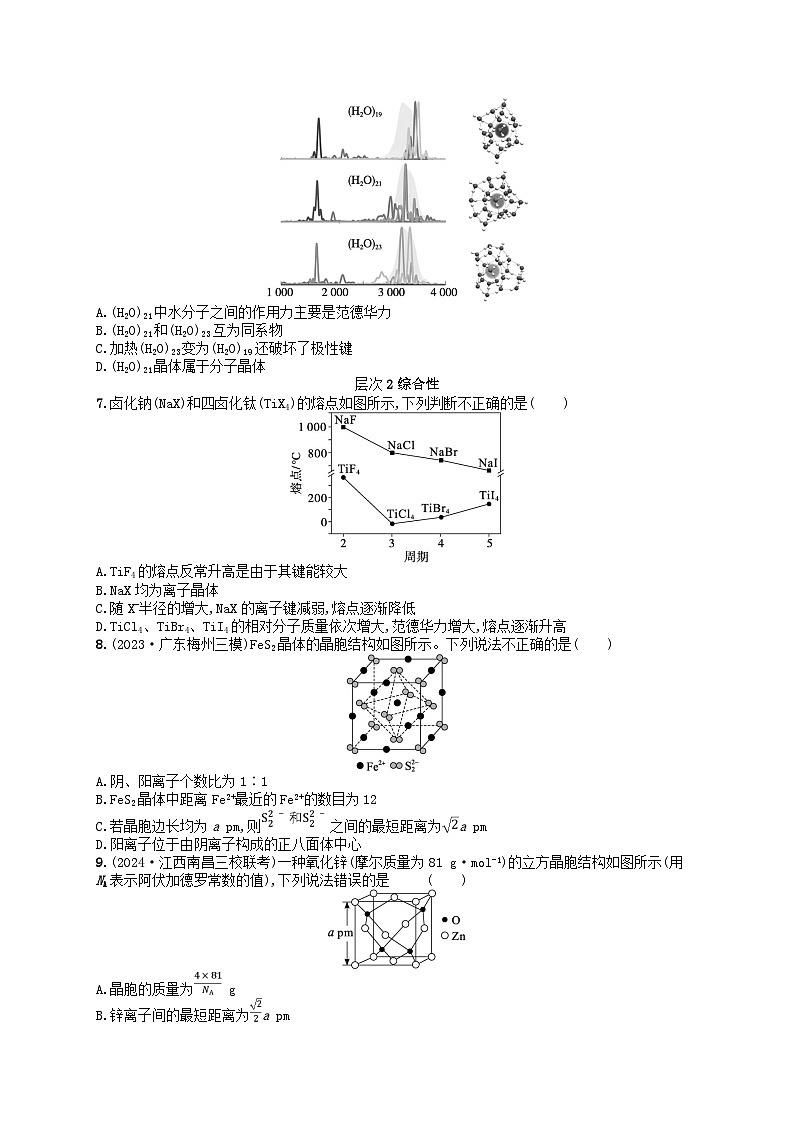
6.(2023·广东湛江统考)某课题组发现水团簇最少需要21个水分子才能实现溶剂化,即1个水分子周围至少需要20个水分子,才能将其“溶解”(“溶解”时,水团簇须形成四面体)。下列叙述正确的是( )
A.(H2O)21中水分子之间的作用力主要是范德华力
B.(H2O)21和(H2O)23互为同系物
C.加热(H2O)23变为(H2O)19还破坏了极性键
D.(H2O)21晶体属于分子晶体
层次2综合性
7.卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,下列判断不正确的是( )
A.TiF4的熔点反常升高是由于其键能较大
B.NaX均为离子晶体
C.随X-半径的增大,NaX的离子键减弱,熔点逐渐降低
D.TiCl4、TiBr4、TiI4的相对分子质量依次增大,范德华力增大,熔点逐渐升高
8.(2023·广东梅州三模)FeS2晶体的晶胞结构如图所示。下列说法不正确的是( )
A.阴、阳离子个数比为1∶1
B.FeS2晶体中距离Fe2+最近的Fe2+的数目为12
C.若晶胞边长均为a pm,则之间的最短距离为a pm
D.阳离子位于由阴离子构成的正八面体中心
9.(2024·江西南昌三校联考)一种氧化锌(摩尔质量为81 g·ml-1)的立方晶胞结构如图所示(用NA表示阿伏加德罗常数的值),下列说法错误的是( )
A.晶胞的质量为 g
B.锌离子间的最短距离为a pm
C.基态氧原子的核外电子有5种运动状态
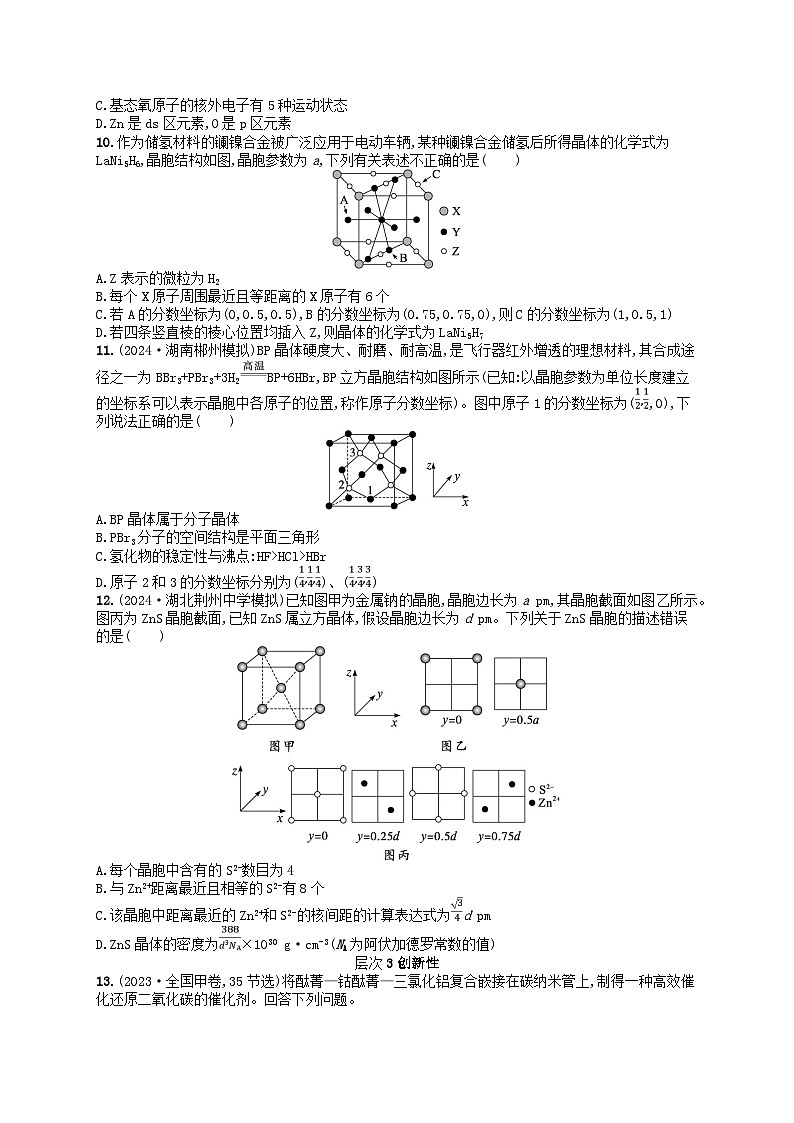
D.Zn是ds区元素,O是p区元素
10.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
11.(2024·湖南郴州模拟)BP晶体硬度大、耐磨、耐高温,是飞行器红外增透的理想材料,其合成途径之一为BBr3+PBr3+3H2BP+6HBr,BP立方晶胞结构如图所示(已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标)。图中原子1的分数坐标为(,0),下列说法正确的是( )
A.BP晶体属于分子晶体
B.PBr3分子的空间结构是平面三角形
C.氢化物的稳定性与沸点:HF>HCl>HBr
D.原子2和3的分数坐标分别为()、()
12.(2024·湖北荆州中学模拟)已知图甲为金属钠的晶胞,晶胞边长为a pm,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为d pm。下列关于ZnS晶胞的描述错误的是( )
A.每个晶胞中含有的S2-数目为4
B.与Zn2+距离最近且相等的S2-有8个
C.该晶胞中距离最近的Zn2+和S2-的核间距的计算表达式为d pm
D.ZnS晶体的密度为×1030 g·cm-3(NA为阿伏加德罗常数的值)
层次3创新性
13.(2023·全国甲卷,35节选)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题。
(1)图1所示的几种碳单质,它们互为 ,其中属于共价晶体的是 ,C60间的作用力是 。
(2)AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
AlF3的晶体结构
14.(2023·广东湛江统考)我国磷、锌、铬等矿产资源储量丰富。请回答下列问题:
(1)Zn2+核外电子占据的最高能级为 ,且其核外有 个空间运动状态不同的电子。
(2)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数或边长为a pm)。
①每个晶胞中实际拥有的B原子数是 个,晶胞中每个B原子周围距离相等且最近的B原子是 个。
②固态磷化硼属于 (填“分子”“离子”或“共价”)晶体,熔点高低比较:BP (填“>”“<”或“=”)BN。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0)、G点为(1,1,1),则Q点的原子分数坐标为 。
④磷化硼晶体的密度为 g·cm-3(列出计算式)。
第28讲 晶体结构与性质
1.B 解析 锗是32号元素,基态Ge原子的价层电子排布式为4s24p2,A正确;GeCl4与SiCl4晶体都属于分子晶体,GeCl4的相对分子质量大,GeCl4分子间作用力大,则GeCl4的熔点比SiCl4高,B错误;GeCl4在常温下呈液态,则其熔点较低,故属于分子晶体,C正确;元素非金属性越强,其第一电离能越大,非金属性大小为Cl>Si>Ge,则第一电离能:Cl>Si>Ge,D正确。
2.B 解析 Cl2、Br2、I2都是分子晶体,结构相似,相对分子质量越大,分子间作用力越大,沸点越高,故沸点顺序为Cl2
3.B 解析 稀有气体分子内没有共价键,A错误;通过X射线衍射实验,可得出晶体的内部结构,B正确;分子间只存在范德华力的分子晶体才是分子密堆积,C错误;用均摊法推知,一个晶胞内含有3个钠离子、1个氯离子,故晶体化学式为Na3Cl,D错误。
4.B 解析 氯化铵由铵根离子和氯离子构成,为离子晶体,A正确;铵根离子中N原子杂化方式为sp3杂化,键角为109°28',B错误;NH4Cl晶体中铵根离子和氯离子之间为离子键,氮原子和氢原子之间为共价键,C正确;根据晶胞结构可知每个Cl-周围与它最近且等距离的铵根离子的数目为8,D正确。
5.D 解析 Re处在第六周期第ⅦB族,Re原子价层电子排布式为5d56s2,A正确;Ti在晶胞的顶角,Re占据Ti的位置,则Re在顶角处,离Re最近且等距离的O有6个,则Re的配位数为6,B正确;若Re在体心,则O位于面心,C正确;Re的最高价为+7价,ReO3中Re为+6价,Re单质为0价,则ReO3中Re化合价可以升高也可以降低,可发生歧化反应,D错误。
6.D 解析 (H2O)21中水分子之间的作用力主要是氢键,A错误;同系物是指结构相似,组成上相差一个或若干个CH2基团的物质,B错误;加热(H2O)23变为(H2O)19破坏的是氢键,没有破坏极性键,C错误;(H2O)21是由多个水分子形成的分子晶体,D正确。
7.A 解析 由于电负性:F>Cl>Br>I,则TiF4形成离子晶体,而TiCl4、TiBr4、TiI4形成分子晶体,TiF4的熔点反常升高原因是TiF4形成离子晶体,而TiCl4、TiBr4、TiI4形成分子晶体,A错误;NaX中只含有离子键,则NaX均为离子化合物,形成的晶体均为离子晶体,B正确;NaX是离子晶体,离子键越强、熔点越高,X-电子层数越多,半径越大,离子键越弱,则随X-半径的增大,NaX的离子键减弱,熔点逐渐降低,C正确;TiCl4、TiBr4、TiI4均为分子晶体,故随着相对分子质量依次增大,范德华力增大,熔点逐渐升高,D正确。
8.C 解析 位于顶点和面心,个数为8×+6×=4,Fe2+位于棱上和体心,个数为12×+1=4,阴、阳离子个数比为1∶1,A项正确;FeS2晶体中,距离Fe2+最近的Fe2+的数目为12,B项正确;之间的最短距离等于晶胞面对角线的一半,即apm,C项错误;由晶胞结构可知,晶胞中心的阳离子位于由阴离子构成的正八面体中心,D项正确。
9.C 解析 1个晶胞中含有4个Zn2+和4个O2-,则晶胞的质量为g,A正确;锌离子间的最短距离为晶胞面对角线的一半,则锌离子间的最短距离为apm,B正确;氧元素原子序数为8,基态氧原子核外8个电子,共有8种运动状态,C错误;Zn为过渡元素,在元素周期表中位于第四周期第ⅡB族,属于ds区,O位于p区,D正确。
10.D 解析 该晶胞含X原子的个数为8×=1,含Y原子的个数为8×+1=5,含Z原子的个数为8×+2×=3,对照晶胞的化学式LaNi5H6可得,Z表示的微粒为H2,A正确;从图中可以看出,每个X原子周围最近且等距离的X原子在顶角上,数目为6,B正确;若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则坐标原点为底面左下角的X原子,则C的分数坐标为(1,0.5,1),C正确;若四条竖直棱的棱心位置均插入Z,则与原晶胞比,增加Z的个数为4×=1,而Z为H2,故晶体的化学式为LaNi5H8,D错误。
11.D 解析 根据BP晶体硬度大、耐磨、耐高温可知,BP是共价晶体,A错误;PBr3中心原子P为sp3杂化,其σ键电子对数为3,孤电子对数为1,分子的空间结构是三角锥形,B错误;元素的非金属性越强其简单氢化物的稳定性越强,则氢化物的稳定性HF>HCl>HBr,氢化物的沸点与相对分子质量和氢键有关,氢化物的沸点为HF>HBr>HCl,C错误。
12.B 解析 由晶胞截面图可知,S2-位于晶胞的顶角和面心,晶胞中S2-个数为8×+6×=4,Zn2+位于S2-构成的正四面体空隙内,每个晶胞中含有S2-的数目为4,A正确;Zn2+位于S2-的正四面体空隙,与Zn2+距离最近且相等的S2-有4个,B错误;与顶角S2-距离最近的Zn2+位于体对角线的处,距离最近的Zn2+与S2-的核间距为dpm,C正确;ZnS晶体的密度为g·cm-3=×1030g·cm-3,D正确。
13.答案 (1)同素异形体 金刚石 范德华力 (2)离子 2
解析 (1)金刚石、石墨、C60和碳纳米管都是由碳元素形成的单质,它们互为同素异形体。金刚石中每个C原子处于其他4个C原子构成的正四面体的中心,向周围无限延伸,形成空间立体网状结构,为共价晶体。C60为分子晶体,微粒间作用力为范德华力。
(2)AlF3的熔点高,应为离子晶体,铝氟之间的化学键为离子键。Al3+与F-具有相同的电子层结构,F-的半径大于Al3+的半径,故F-处于晶胞的棱心,则F-的配位数是2。根据均摊法,每个AlF3晶胞中含有Al3+的个数为8×=1,含有F-的个数为12×=3,AlF3的摩尔质量为84g·ml-1,晶胞体积为a3×10-30cm3,则晶体密度为g·cm-3。
14.答案 (1)3d 28
(2)①4 12 ②共价 <
③() ④
解析 (1)基态Zn原子价电子排布式为3d104s2,失去电子时最先失去最高能层电子,则Zn2+核外电子排布式为1s22s22p63s23p63d10,其电子占据的最高能级为3d;核外每个电子都有一个空间运动状态,Zn2+核外有28个电子,即具有28个不同空间运动状态的电子。
(2)①依据均摊法分析,一个晶胞中B原子占据8个顶点和6个面心,其个数为8×+6×=4;晶胞中每个B原子周围距离相等且最近的B原子,共有12个。
②从晶胞结构可知晶胞内仅有B—P键,无其他作用力,且磷化硼是一种超硬耐磨涂层材料,可以判断其属于共价晶体。
BP与BN晶体均属于共价晶体,且共价晶体的熔、沸点大小与共价键的强弱有关,其键长B—P>B—N,则键能B—P
④根据均摊法分析,一个晶胞中P原子的个数为4,B原子个数为8×+6×=4,故晶体的密度为g·cm-3=g·cm-3。
2025版高考化学一轮总复习真题演练第5章物质结构与性质元素周期律第19讲晶体结构与性质: 这是一份2025版高考化学一轮总复习真题演练第5章物质结构与性质元素周期律第19讲晶体结构与性质,共5页。试卷主要包含了物质结构决定物质性质,超分子的特征,物质结构与性质的综合应用等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第27讲分子的性质配合物和超分子(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第27讲分子的性质配合物和超分子(附解析),共5页。试卷主要包含了下列事实与解释不相符的是,下列对实验事实的解释不正确的是等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第25讲化学键(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第5章物质结构与性质元素周期律第25讲化学键(附解析),共5页。试卷主要包含了下列说法正确的是,某些化学键的键能如下表所示等内容,欢迎下载使用。












