备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第15讲氯气的实验室制法及应用(附解析)
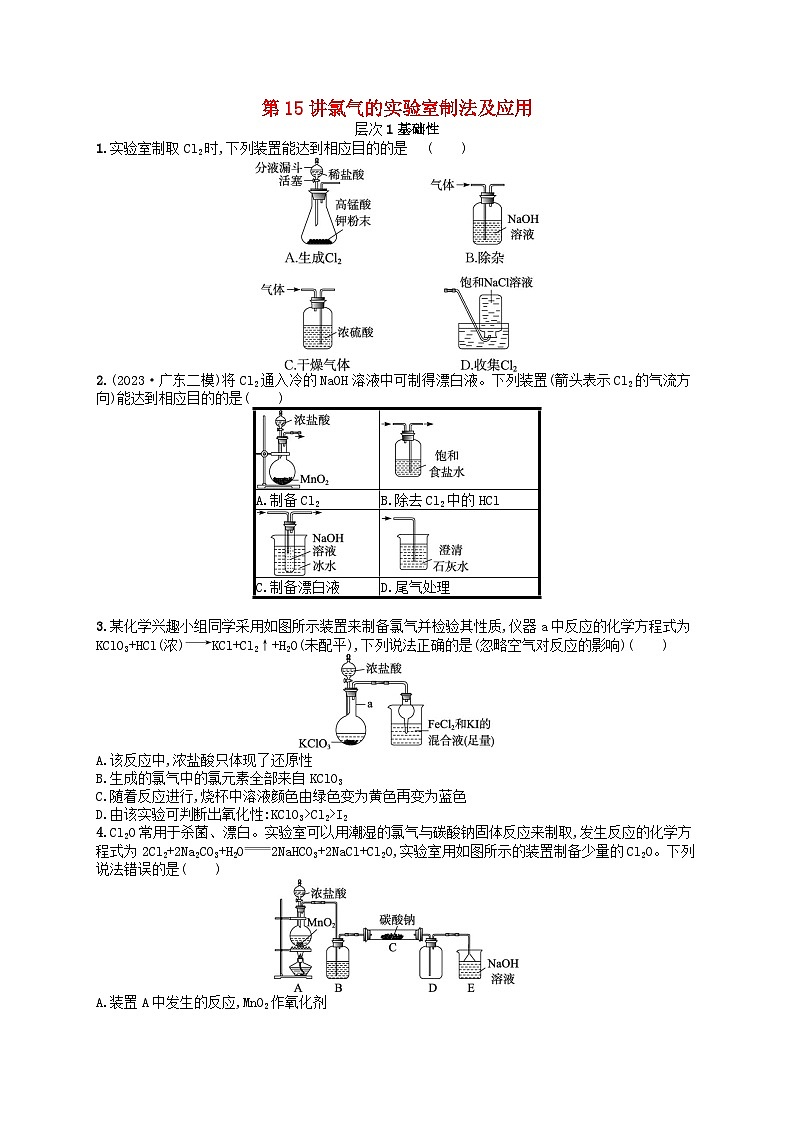
展开1.实验室制取Cl2时,下列装置能达到相应目的的是( )
2.(2023·广东二模)将Cl2通入冷的NaOH溶液中可制得漂白液。下列装置(箭头表示Cl2的气流方向)能达到相应目的的是( )
3.某化学兴趣小组同学采用如图所示装置来制备氯气并检验其性质,仪器a中反应的化学方程式为KClO3+HCl(浓)KCl+Cl2↑+H2O(未配平),下列说法正确的是(忽略空气对反应的影响)( )
A.该反应中,浓盐酸只体现了还原性
B.生成的氯气中的氯元素全部来自KClO3
C.随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色
D.由该实验可判断出氧化性:KClO3>Cl2>I2
4.Cl2O常用于杀菌、漂白。实验室可以用潮湿的氯气与碳酸钠固体反应来制取,发生反应的化学方程式为2Cl2+2Na2CO3+H2O2NaHCO3+2NaCl+Cl2O,实验室用如图所示的装置制备少量的Cl2O。下列说法错误的是( )
A.装置A中发生的反应,MnO2作氧化剂
B.装置B盛放的试剂是浓硫酸
C.装置D可用来收集Cl2O
D.装置E中可能发生反应Cl2O+2NaOH2NaClO+H2O
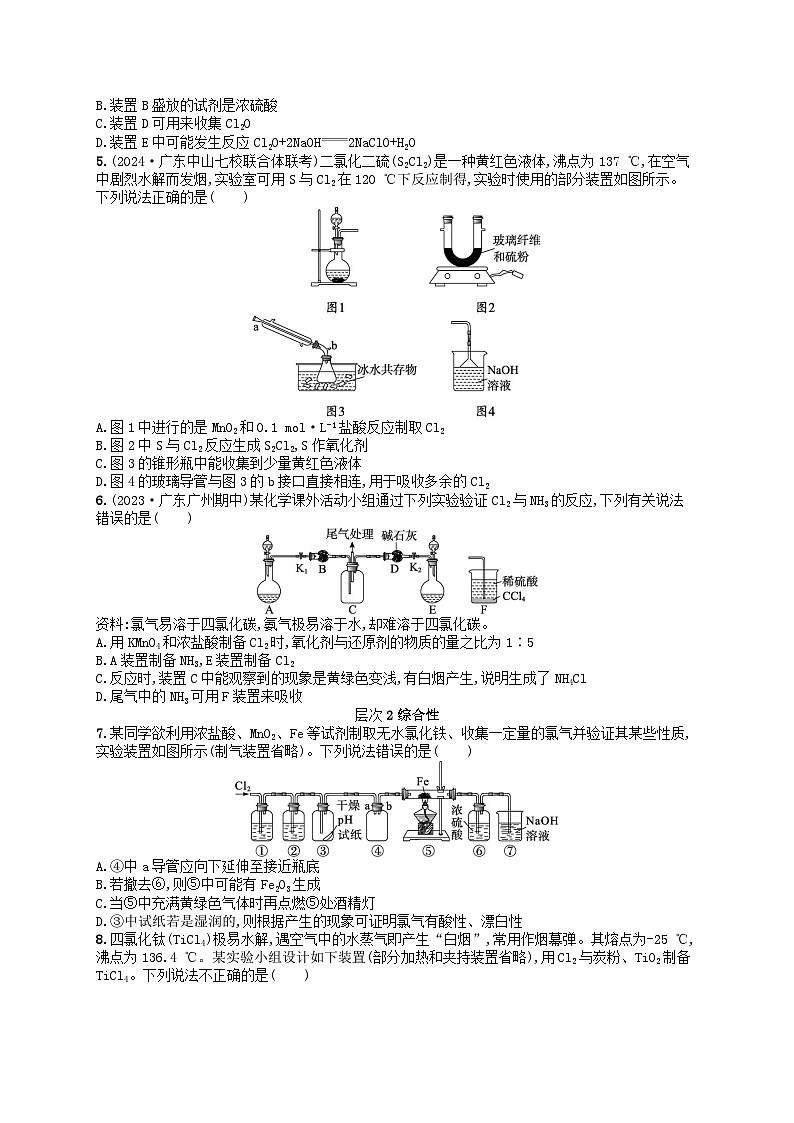
5.(2024·广东中山七校联合体联考)二氯化二硫(S2Cl2)是一种黄红色液体,沸点为137 ℃,在空气中剧烈水解而发烟,实验室可用S与Cl2在120 ℃下反应制得,实验时使用的部分装置如图所示。下列说法正确的是( )
A.图1中进行的是MnO2和0.1 ml·L-1盐酸反应制取Cl2
B.图2中S与Cl2反应生成S2Cl2,S作氧化剂
C.图3的锥形瓶中能收集到少量黄红色液体
D.图4的玻璃导管与图3的b接口直接相连,用于吸收多余的Cl2
6.(2023·广东广州期中)某化学课外活动小组通过下列实验验证Cl2与NH3的反应,下列有关说法错误的是( )
资料:氯气易溶于四氯化碳,氨气极易溶于水,却难溶于四氯化碳。
A.用KMnO4和浓盐酸制备Cl2时,氧化剂与还原剂的物质的量之比为1∶5
B.A装置制备NH3,E装置制备Cl2
C.反应时,装置C中能观察到的现象是黄绿色变浅,有白烟产生,说明生成了NH4Cl
D.尾气中的NH3可用F装置来吸收
层次2综合性
7.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。下列说法错误的是( )
A.④中a导管应向下延伸至接近瓶底
B.若撤去⑥,则⑤中可能有Fe2O3生成
C.当⑤中充满黄绿色气体时再点燃⑤处酒精灯
D.③中试纸若是湿润的,则根据产生的现象可证明氯气有酸性、漂白性
8.四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是( )
A.②中应盛装浓硫酸
B.冷凝管有冷凝、回流和导气的作用
C.反应结束时,应先停止①处的加热,后停止③处的加热
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
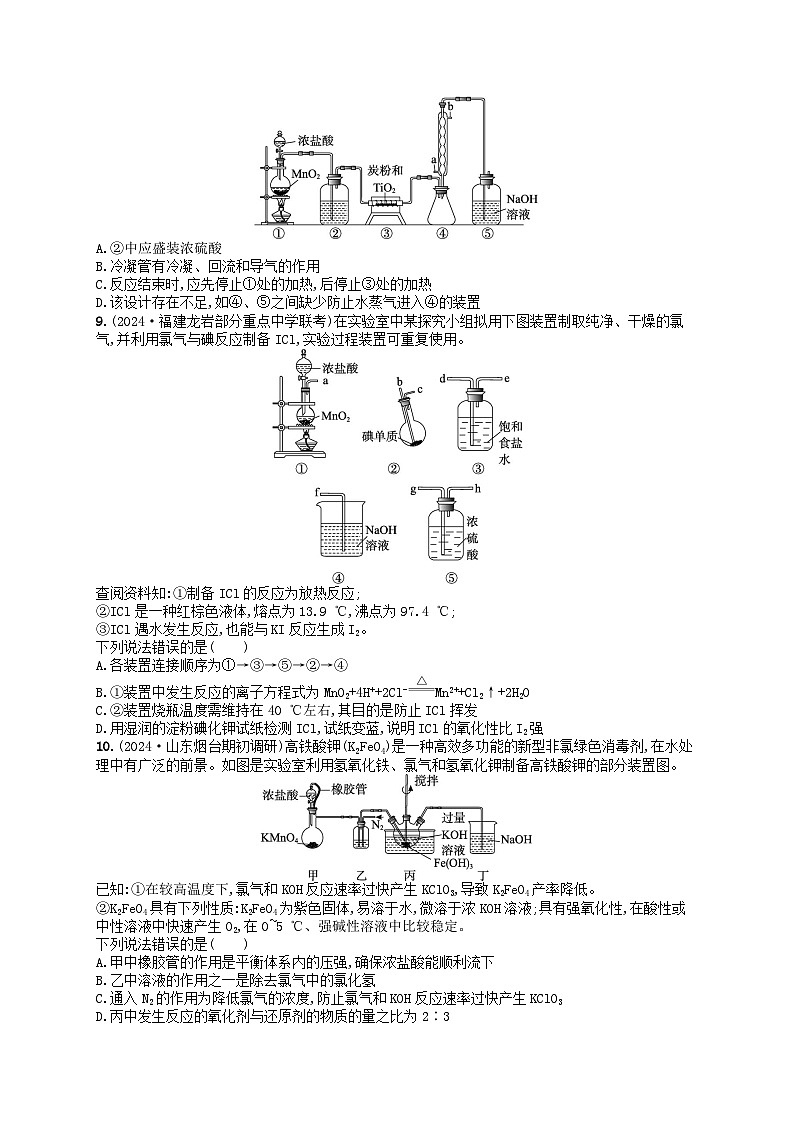
9.(2024·福建龙岩部分重点中学联考)在实验室中某探究小组拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备ICl,实验过程装置可重复使用。
查阅资料知:①制备ICl的反应为放热反应;
②ICl是一种红棕色液体,熔点为13.9 ℃,沸点为97.4 ℃;
③ICl遇水发生反应,也能与KI反应生成I2。
下列说法错误的是( )
A.各装置连接顺序为①→③→⑤→②→④
B.①装置中发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
C.②装置烧瓶温度需维持在40 ℃左右,其目的是防止ICl挥发
D.用湿润的淀粉碘化钾试纸检测ICl,试纸变蓝,说明ICl的氧化性比I2强
10.(2024·山东烟台期初调研)高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,在水处理中有广泛的前景。如图是实验室利用氢氧化铁、氯气和氢氧化钾制备高铁酸钾的部分装置图。
已知:①在较高温度下,氯气和KOH反应速率过快产生KClO3,导致K2FeO4产率降低。
②K2FeO4具有下列性质:K2FeO4为紫色固体,易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0~5 ℃、强碱性溶液中比较稳定。
下列说法错误的是( )
A.甲中橡胶管的作用是平衡体系内的压强,确保浓盐酸能顺利流下
B.乙中溶液的作用之一是除去氯气中的氯化氢
C.通入N2的作用为降低氯气的浓度,防止氯气和KOH反应速率过快产生KClO3
D.丙中发生反应的氧化剂与还原剂的物质的量之比为2∶3
11.(2024·湖南株洲模拟)实验室用Cl2氧化K2MnO4来制备KMnO4,装置如图1所示:
图1
已知:K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应3Mn+2H2O2Mn+MnO2↓+4OH-。
请回答下列问题:
(1)K2MnO4中锰元素的化合价为 价。
(2)装置B中生成KMnO4的离子方程式为 。
(3)进入装置B的Cl2中含有杂质HCl,HCl (填“需要”或“不需要”)除去,理由是 。
(4)甲同学设计如图2所示的实验来研究二氧化锰与盐酸的反应情况,各组实验参数如表所示:
图2
根据第一组、第二组的实验可得出的结论是 。
根据第三组实验可得出的结论是 。
(5)为测定某NaHSO3固体的纯度,现用0.100 0 ml·L-1的酸性KMnO4溶液进行滴定。(已知:2Mn+5HS+H+2Mn2++5S+3H2O)
①称取W g NaHSO3固体溶于水配成100 mL溶液,下列仪器在该过程中肯定不需要用到的是 (填仪器名称)。
②取25.00 mL NaHSO3溶液置于锥形瓶中,用酸性KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。滴定终点的现象为 。
层次3创新性
12.二氧化氯(ClO2)是一种新型的环保饮用水消毒剂,某课题小组拟选择如图所示部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
已知:①常温下,亚氯酸钠(NaClO2)与氯气反应的生成物之一为二氧化氯;②常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体。
回答下列问题:
(1)制备干燥、纯净的氯气:气体发生装置是 (填字母),反应的离子方程式为 。
(2)制备二氧化氯:导管口连接顺序为a→ →n→p→j。本实验选择装置I而不选择装置H的原因是 。
(3)写出装置G中发生反应的化学方程式: 。
(4)装置E的作用是 。
(5)请设计简易实验证明二氧化氯具有永久的漂白性: 。
(6)二氧化氯还会与H2O2和NaOH的混合溶液反应,其产物之一是NaClO2。写出该反应的化学方程式: 。
第15讲 氯气的实验室制法及应用
1.D 解析 Cl2易溶于水,要利用浓盐酸与KMnO4粉末反应制取Cl2,A错误;Cl2和HCl都与NaOH溶液反应,应将混合气体通过盛有饱和食盐水的洗气瓶除去HCl,B错误;干燥Cl2时,要将气体从长导管通入盛有浓硫酸的洗气瓶,C错误;Cl2不易溶于饱和NaCl溶液,故可采用排饱和NaCl溶液的方法收集Cl2,D正确。
2.C 解析 二氧化锰和浓盐酸反应需要加热,A错误;用饱和食盐水除去Cl2中的HCl,导气管应该“长进短出”,B错误;氯气和氢氧化钠在较低温度下反应生成氯化钠和次氯酸钠,C正确;澄清石灰水的浓度太小,吸收氯气的量少,应该用氢氧化钠溶液吸收氯气,D错误。
3.D 解析 仪器a中的反应中,HCl的Cl元素一部分化合价升高为氯气,一部分未发生化合价的改变形成了KCl,故浓盐酸起酸性和还原性作用,A错误;生成的氯气既是氧化产物,又是还原产物,故Cl元素一部分来源于HCl,一部分来自KClO3,B错误;因还原性:I->Fe2+,随着反应进行,烧杯中溶液颜色由绿色变为黄色,因无淀粉试剂,溶液不会变为蓝色,C错误;结合氧化还原反应的规律可判断出,氧化性:KClO3>Cl2>I2,D正确。
4.B 解析 装置A用于制备氯气,HCl作还原剂,MnO2作氧化剂,A正确;由反应2Cl2+2Na2CO3+H2O2NaHCO3+2NaCl+Cl2O可知,反应中需要有水参与,则装置B中盛装的试剂应是饱和食盐水,作用是除去HCl气体,不能用浓硫酸除去水,B错误;Cl2O易冷凝为液体,则装置D为Cl2O的收集装置,C正确;装置E用于吸收Cl2O,可能发生反应Cl2O+2NaOH2NaClO+H2O,D正确。
5.C 解析 0.1ml·L-1盐酸的浓度较小,制取氯气应用二氧化锰和浓盐酸反应,A错误;S的非金属性小于Cl,则S2Cl2中S为正价,Cl为负价,S单质生成S2Cl2时S元素的化合价升高,S作还原剂,B错误;该反应在120℃下进行,S2Cl2沸点为137℃,会有S2Cl2在锥形瓶中冷凝,锥形瓶中能收集到少量黄红色液体,C正确;S2Cl2在空气中剧烈水解,为防止S2Cl2与水接触,应在图4的玻璃导管与图3的b接口再连接一个干燥装置,D错误。
6.B 解析 反应16HCl(浓)+2KMnO42KCl+2MnCl2+8H2O+5Cl2↑中,氧化剂为KMnO4,还原剂为HCl,氧化剂与还原剂物质的量之比为1∶5,A正确;根据C中导气管的位置可知,A中制备的气体密度大于空气,A装置制备Cl2,E装置中制备的气体密度小于空气,且干燥氨气用碱石灰,氯气不能用碱石灰干燥,会吸收氯气,故E装置制备NH3,B错误;装置C中观察到的现象是黄绿色变浅,有白烟产生,说明氯气和氨气反应生成NH4Cl,根据化合价的变化可知,氯气中氯元素的化合价从0价降低到-1价,则氮元素的化合价升高,另一种生成物是N2,C正确;NH3极易溶于水,难溶于四氯化碳,氨气进入有机层会上升,到有机物和稀硫酸交界处被稀硫酸吸收,可以防止倒吸,D正确。
7.D 解析 氯气的密度比空气的大,应采用向上排空气法收集,故需要将a导管延长至接近瓶底,A正确;若撤去⑥,则⑦中的水蒸气逆向进入⑤中,导致FeCl3水解生成Fe(OH)3,Fe(OH)3受热分解变为Fe2O3,B正确;加热时装置中的空气会与Fe反应,故应先通入一段时间Cl2,以排尽装置中的空气,防止加热时Fe被空气氧化,C正确;干燥的氯气没有漂白性,氯气没有酸性,D错误。
8.C 解析 四氯化钛极易水解,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,故②中应盛装浓硫酸,A正确;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,B正确;反应结束时,应先停止③处加热,后停止①处加热,可以使制得的TiCl4在氯气氛围中冷却,防止空气进入装置中使TiCl4变质,C错误;因四氯化钛极易水解,故应在装置④和⑤之间增加一个防止水蒸气进入④的装置,D正确。
9.A 解析 根据实验发生装置→除杂装置→反应装置→尾气处理装置排序连接,但是ICl易与水反应,在②与④之间要放一个⑤做除水装置,故连接顺序为①→③→⑤→②→⑤→④,A错误;①是氯气的发生装置,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,B正确;装置烧瓶温度需维持在40℃左右,原因是温度过低反应速率太慢,温度过高会造成ICl挥发,C正确;根据资料③ICl能与KI反应生成I2,说明ICl的氧化性比I2强,故湿润的淀粉碘化钾试纸变蓝,D正确。
10.D 解析 甲中橡胶管能保持平衡体系内的压强相等,确保浓盐酸能顺利流下,A正确;乙中溶液为饱和氯化钠溶液,用以除去氯气中的氯化氢,B正确;由于在较高温度下,氯气和KOH反应速率过快产生KClO3,导致K2FeO4产率降低,通入N2的作用为降低氯气的浓度,防止氯气和KOH反应速率过快产生KClO3,C正确;丙中氯气把氢氧化铁氧化为高铁酸钾,铁元素化合价从+3价升高到+6价,1分子氯气得到2个电子,根据得失电子守恒可知,发生反应的氧化剂与还原剂的物质的量之比为3∶2,D错误。
11.答案 (1)+6
(2)Cl2+2Mn2Cl-+2Mn
(3)需要 因为K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应有MnO2生成
(4)MnO2与浓盐酸的反应需在加热的条件下才能得到氯气 浓度为5 ml·L-1的盐酸不能与MnO2反应得到氯气
(5)①分液漏斗
②滴入最后半滴酸性KMnO4溶液时,溶液由无色变为浅红色,且半分钟内不变色
解析 装置A中浓盐酸与二氧化锰共热制取氯气,在装置B中,碱性环境中氯气将K2MnO4氧化得到KMnO4,装置C中可以盛放NaOH溶液吸收尾气。(1)依据化合物中各元素化合价代数和为零可知,Mn的化合价为+6价。(2)根据题意知Cl2可以氧化K2MnO4得到KMnO4,根据得失电子守恒、元素守恒可得离子方程式为Cl2+2Mn2Cl-+2Mn。(3)为防止K2MnO4发生歧化反应,需要除去Cl2中含有的杂质HCl,且酸性环境中,KMnO4具有强氧化性,会被Cl-还原。(4)淀粉KI溶液变蓝色可以说明有氯气生成,对比一、二两组实验可知,MnO2与浓盐酸的反应需在加热的条件下才能得到氯气;根据第三组实验可知浓度为5ml·L-1的盐酸不能与MnO2反应得到氯气。(5)①配制NaHSO3溶液需要烧杯溶解、在容量瓶中定容,定容时还需要胶头滴管加水,不需要分液漏斗;②达到滴定终点时酸性KMnO4溶液稍过量,溶液会变为浅红色,所以滴定终点现象为滴入最后半滴酸性KMnO4溶液时,溶液由无色变为浅红色,且半分钟内不变色。
12.答案 (1)A MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(或B 2Mn+16H++10Cl-2Mn2++5Cl2↑+8H2O)
(2)z→m→x→y→b→c→r→s 装置H中的水蒸气会进入装置F中,且可能会引起倒吸
(3)Cl2+2NaClO22ClO2+2NaCl
(4)吸收二氧化氯中的氯气
(5)取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色
(6)2ClO2+2NaOH+H2O22NaClO2+O2+2H2O
解析 (1)若用MnO2作氧化剂制备Cl2,则气体发生装置应选取装置A,因该反应需加热;若用KMnO4作氧化剂,则气体发生装置应选取装置B,因该反应不需要加热。
(2)制备ClO2的过程:制备Cl2,除去Cl2中HCl杂质,用装置C中的浓硫酸进行干燥,用装置G中的NaClO2与Cl2反应生成ClO2和NaCl,用装置E中的CCl4除去多余的Cl2,用装置F收集ClO2,用装置I吸收有毒尾气,装置I还起到防止空气中的水蒸气进入装置F中的作用。故导管口的连接顺序为a→z→m→x→y→b→c→r→s→n→p→j。装置I与装置H的不同之处在于装置I可防止空气中的水蒸气进入装置F中,而装置H中盛有烧碱溶液,其中的水蒸气可进入装置F中,且可能会引起倒吸。
(3)装置G中制备ClO2发生反应的化学方程式为Cl2+2NaClO22ClO2+2NaCl。
(4)装置E中的CCl4可吸收ClO2中的Cl2,起到净化ClO2的作用。
(5)可用品红溶液来验证二氧化氯的漂白性。
(6)由题意可知反应物为ClO2、NaOH、H2O2,产物之一是NaClO2,根据氧化还原反应原理及原子守恒可知其余的产物为O2、H2O,故该反应的化学方程式为2ClO2+2NaOH+H2O22NaClO2+O2+2H2O。
A.制备Cl2
B.除去Cl2中的HCl
C.制备漂白液
D.尾气处理
组别
反应条件
盐酸浓度
淀粉KI溶液的颜色变化
第一组
微热
10 ml·L-1
变蓝色
第二组
常温
10 ml·L-1
不变色
第三组
微热
5 ml·L-1
不变色
备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第16讲卤族元素溴碘的提取(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第16讲卤族元素溴碘的提取(附解析),共5页。试卷主要包含了下列说法中正确的是,某同学设计完成了以下两个实验等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第19讲氮及其氧化物硝酸(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第19讲氮及其氧化物硝酸(附解析),共5页。试卷主要包含了氮及其化合物的转化具有重要应用,065 ml·L-1等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第14讲氯及其化合物(附解析): 这是一份备战2025届新高考化学一轮总复习分层练习第4章非金属及其化合物第14讲氯及其化合物(附解析),共6页。试卷主要包含了氯气性质的微型实验装置如图所示等内容,欢迎下载使用。












