





2024贵州中考一轮复习 人教版化学 阶段达标测试卷(三) 课件
展开这是一份2024贵州中考一轮复习 人教版化学 阶段达标测试卷(三) 课件,共27页。PPT课件主要包含了5∶1,氢氧化钙,灼烧闻气味,不饱和,∶21,刷漆合理即可,硫酸铜溶,液合理即可,硫酸锌,产生大量气泡等内容,欢迎下载使用。
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40一、选择题(本题包括7个小题,每小题2分,共14分。每小题只有一个选项符合题意)1.为了提高导弹的运载能力,增大其结构强度,弹体外壳材料通常选择( )①铝合金 ②硬塑料 ③水泥 ④钛合金A.①③B.①②④C.①④D.②③④
2.下列各组物质在水中能大量共存且溶液为无色、透明的是( )A.NaOH、KNO3、MgCl2 B.Na2CO3、HCl、BaCl2 C.KNO3、NaCl、H2SO4 D.CuSO4、KCl、HCl
3.下列关于物质的检验、鉴别、除杂正确的是( )A.检验气体是否为二氧化碳:向集气瓶内伸入燃着的木条,观察是否熄灭B.除去CO2中混有的少量CO:用点燃的方法C.鉴别硬水和软水:取等量水样,滴加等量肥皂水,振荡,观察现象差异D.淡化海水:加适量明矾粉末,搅拌溶解后,静置
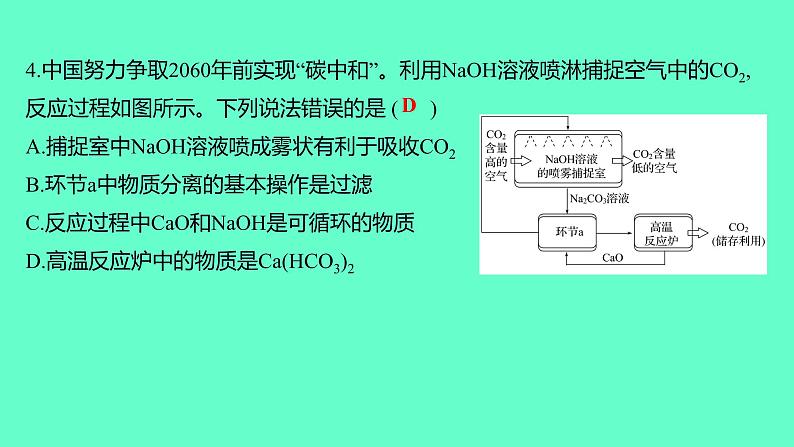
4.中国努力争取2060年前实现“碳中和”。利用NaOH溶液喷淋捕捉空气中的CO2,反应过程如图所示。下列说法错误的是 ( )A.捕捉室中NaOH溶液喷成雾状有利于吸收CO2B.环节a中物质分离的基本操作是过滤C.反应过程中CaO和NaOH是可循环的物质D.高温反应炉中的物质是Ca(HCO3)2
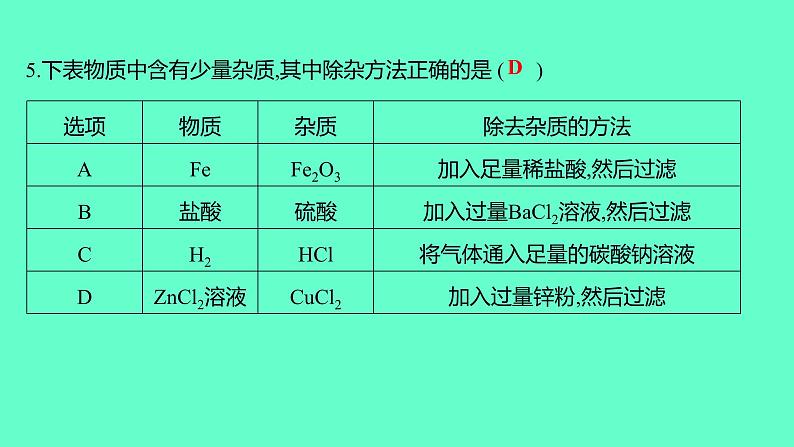
5.下表物质中含有少量杂质,其中除杂方法正确的是 ( )
6.现有一瓶久置的过氧化氢溶液,为测定其溶质质量分数,小颖同学用烧杯取该溶液100 g,向其中加入2 g MnO2粉末,待完全反应后,称得烧杯内剩余物质的总质量为98.8 g,下列有关计算和分析,不正确的是( )A.该实验中,生成氧气的质量为3.2 gB.该过氧化氢溶液中的氧元素质量分数约为89%C.烧杯内剩余液体中氢、氧元素的质量比是1∶9D.该过氧化氢溶液的溶质质量分数为6.8%
7.(2023·襄阳中考)现有80 g稀硫酸和硫酸铜的混合溶液,向其中加入过量氯化钡溶液,充分反应后再滴加溶质质量分数为20%的氢氧化钠溶液,利用数字化传感器测得生成沉淀的质量与滴入氢氧化钠溶液的质量的变化关系如图所示。以下说法正确的是( )A.a点溶液中含有两种溶质B.a→b段溶液中发生的化学反应为CuSO4+2NaOH===Na2SO4+Cu(OH)2↓C.原混合溶液中H2SO4与CuSO4的质量比为49∶80D.向c点溶液中滴加稀硫酸,不会立即出现白色沉淀
二、非选择题(本题包括7个小题,共46分)8.(6分)金属材料在生产、生活中有着广泛应用。(1)下列属于金属材料的是__________(填字母)。 A.水泥B.硬铝C.纯铜D.玻璃(2)《天工开物》中记载“凡金箔,每金七厘造方寸金一千片”,体现金具有的物理性质是_________________________。
黄金具有良好的延展性
(3)汉代海昏侯国遗址考古发掘出大量珍贵文物。如图是首都博物馆展出的3件文物,其中由金属材料制成的是__________(填字母);出土的铁质编磬锈蚀严重,金饼却依然金光灿灿,从物质性质的角度解释其原因:______________________________________________________。
金的化学性质不活泼,不易
和其他物质反应,铁比金活泼
(4)2022年3月29日,我国首型固体捆绑中型运载火箭“长征六号改”首飞,标志着我国新一代运载火箭家族再添新成员。火箭中运用了大量合金,下列有关合金的说法不正确的是__________(填字母)。 A.合金的抗腐蚀性能比组成它们的纯金属好B.合金中一定含非金属元素C.生铁是比钢含碳量高的铁合金D.合金的熔点比组成它们的纯金属高(5)金属资源的保护格外重要。下列做法不能有效保护金属资源的是______(填字母)。 A.寻找、开发金属的代用品 B.在金属栏杆表面刷漆防锈 C.任意开采金属矿物 D.回收废旧金属
9.(6分)“二十四节气”是我国古代农耕文化的产物,农耕生产与节气息息相关。(1)“立春”:万物复苏,春暖花开。乙酸苯甲酯(C9H10O2)是一种具有茉莉花香味的物质,乙酸苯甲酯分子中氢原子和氧原子的个数比是_________(填最简整数比)。 (2)“谷雨”:时雨乃降,百果乃登。pH<5.6的雨水容易导致土壤酸化,不利于农作物生长,常用于改良酸性土壤的物质是_____________(填名称)。 (3)“小满”:小满不满,麦有一险。为促进小麦生长,应追加肥料。下列肥料属于复合肥的是______(填字母)。 A.CO(NH2)2B.Ca3(PO4)2C.NH4NO3D.KNO3
(4)“白露”:白露满地,割谷拾棉。棉花的主要成分为纤维素,鉴别棉纤维和羊毛纤维的方法是_______________。 (5)“秋分”:一粒良种,万担好粮。农业上常用溶质质量分数为16%的氯化钠溶液来选种。已知室温下氯化钠的溶解度约为36 g,则选种用的氯化钠溶液是________________(填“饱和溶液”或“不饱和溶液”),该溶液中溶质与溶剂的质量比为______。
10.(8分)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图。(1)铜是人类使用较早的金属。三星堆出土了大量的青铜器,青铜的熔点比纯铜_______(选填“高”或“低”)。 (2)铁器时代大约在公元前500年,至今铁仍是年产量最高的金属,但每年因腐蚀造成巨大的损失,铁锈的主要成分是_______________,写出一条防止铁制品生锈的措施:__________________。
Fe2O3·xH2O
(3)欲比较铁、铜、银三种金属的活动性顺序,可选用的试剂是铁、_________________________、银,写出能发生反应的化学方程式:_______________________________________________。 (4)向一定质量CuSO4、FeSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生。根据实验现象分析判断,滤渣中一定含有的金属是___________,滤液中一定含有的溶质是___________。
Fe+CuSO4===FeSO4+Cu
(与前面试剂对应即可)
(5)为探究铁和锌两种金属与酸反应的情况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断正确的是__________。 A.甲是铁,乙是锌B.若反应后铁和锌都有剩余,则为图1C.图1中消耗硫酸的质量甲>乙D.若为图2,表明反应后硫酸有剩余
11.(10分)某实验小组同学在学习完酸、碱、盐的化学性质后,进行了如图所示的实验,请你来参与他们的探究。(1)甲实验中发生反应的化学方程式为____________________________,小明触摸甲试管外壁,感到管壁发热,得出盐酸与氢氧化钠的反应是放热反应,小军认为小明的结论不严谨,理由是___________________________________。 (2)乙实验中可观察到的现象为_________________,反应乙的化学方程式为_____________________________________。
NaOH+HCl===NaCl+H2O
氢氧化钠固体溶于水也放出大量热
2HCl+Na2CO3===2NaCl+H2O+CO2↑
(3)丙实验中可观察到的现象为_________________。 (4)实验结束后,小组同学将三支试管内的物质倒入一干净的烧杯中并滴入酚酞溶液,观察到烧杯中液体始终呈红色,为了得出烧杯中溶液的溶质成分,小组同学又进行了以下实验探究。【提出问题】烧杯中溶液的溶质成分有哪些?(酚酞除外)资料:氯化钠溶液为中性溶液【进行猜想】猜想一:NaCl、NaOH、Ca(OH)2 猜想二:NaCl、NaOH、Na2CO3 猜想三:NaCl、NaOH猜想四:NaCl、Na2CO3 猜想五:NaCl、Na2CO3、Ca(OH)2①小红认为猜想五不正确,理由为________________________________________。
Na2CO3、Ca(OH)2不共存,互相发生反应
【进行实验】②小芳设计实验证明了猜想一也不成立,她的方法为____________________________________________________________________________。 ③小组为进一步验证猜想,进行了如下实验,请将他们的实验报告补充完整。
取少量烧杯中溶液于试
管中,再滴加碳酸钠溶液,没有产生白色沉淀,猜想一不正确
取少量烧杯中溶液于试管
中,再滴加过量的氯化钙或
产生白色沉淀,上层清
【反思拓展】小组同学认为可对烧杯中的上层清液进行处理,得到较为纯净的氯化钠固体,具体操作步骤为___________________________________________________________________________。
向烧杯中的上层清液中滴加过量的稀盐酸,待反应完
全后,再将反应后的溶液蒸发
12.(7分)我国是一个海洋大国,海水中蕴含着丰富的化学资源。(1)海水晒盐:盐田法晒盐,盐田分蒸发池和结晶池两部分。下列说法正确的是__________。 A.在蒸发池中水蒸发所需能量主要为太阳能和风能 B.在结晶池中主要通过降温结晶使氯化钠析出C.当氯化钠晶体析出时,结晶池中的溶液为氯化钠的饱和溶液
(2)海水制镁:镁及其合金是一种用途很广的金属材料。结晶池中分离出氯化钠后的溶液称为母液,母液中含大量MgCl2,可制备金属镁,主要物质转化关系如图所示:①写出生成Mg(OH)2的化学方程式:_____________________________________。 ②步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是_______________________________________________。 ③步骤①得到的Mg(OH)2沉淀中混有少量的_____________(填化学式),除去少量该杂质的方法是将沉淀加入氯化镁溶液中,充分搅拌后经过滤、_________(填操作方法)、干燥,即可得到纯净的Mg(OH)2。
MgCl2+Ca(OH)2===CaCl2+ g(OH)2↓
母液中氯化镁的含量高,可以制得更多的氢氧化镁
13.(6分)(2023·长沙模拟)学习了酸和碱的化学性质后,某学校化学课外学习小组的同学根据如图所示的实验,进行酸碱中和反应的探究。【探究实验一】通过溶液酸碱性变化的角度,证明酸碱发生中和反应。(1)试管①中证明碱与酸发生反应的现象是___________________________。
溶液由红色逐渐变为无色
(2)图②中b点所示溶液中的溶质(酚酞除外)是_________________(填化学式),b、c、d三点对应溶液中所含溶质NaCl的质量大小关系是______(填字母)。 A.b=c>d B.d=c>b C.d>c>b【探究实验二】(3)可以通过比较试管③和试管⑤,观察到_______________________________________,证明试管④中的酸碱发生了中和反应。(4)要证明试管④中的酸碱发生了中和反应,还可以选用的物质是__________(填字母)。 A.AgNO3溶液B.石蕊试液C.铁粉(5)总结得出结论:通过证明_______________的角度,证明酸碱发生中和反应。
NaOH、NaCl
14.(3分)现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(石灰石样品中的杂质不溶于水,也不发生反应)试计算:该石灰石样品中碳酸钙的质量是多少?
相关课件
这是一份2024贵州中考一轮复习 人教版化学 2024贵州初中学业水平考试模拟卷(三) 课件,共26页。PPT课件主要包含了隔绝氧气,不稳定,强度大,分子间的间隔变小,22∶3,锥形瓶,与氧气接触,铝与氧气反应,YX铁铜,肥皂水等内容,欢迎下载使用。
这是一份2024贵州中考一轮复习 人教版化学 2024贵州初中学业水平考试模拟卷(二) 课件,共27页。PPT课件主要包含了CuOH2,Rb2O,1∶2,浓硫酸,BCD,铜或Cu,钙沉淀,氢氧化钙等内容,欢迎下载使用。
这是一份2024贵州中考一轮复习 人教版化学 阶段达标测试卷(一) 课件,共21页。PPT课件主要包含了①②③,用手拿砝码,将平衡螺母向右拧,仰视读数,应用酒精灯外焰加热,长颈漏斗,K2O,浮在水面上,澄清石灰水变浑浊,二氧化碳和水等内容,欢迎下载使用。












