





2024贵州中考一轮复习 人教版化学 热考专题 专题五 实验探究题 课件
展开认识化学实验探究活动的一般思路与基本方法;学习控制变量和对比实验的实验设计方法。科学探究的一般过程:
【类型一】探究金属及金属材料【例题1】(2023·贵州中考)金属材料在生产生活中应用广泛。(1)高铁电传输系统的材料主要含铜,是利用了铜良好的__________性。 (2)高铁轨道、车厢、附属设施使用大量的铁合金和铝合金。小组同学探究合金中金属的化学性质。
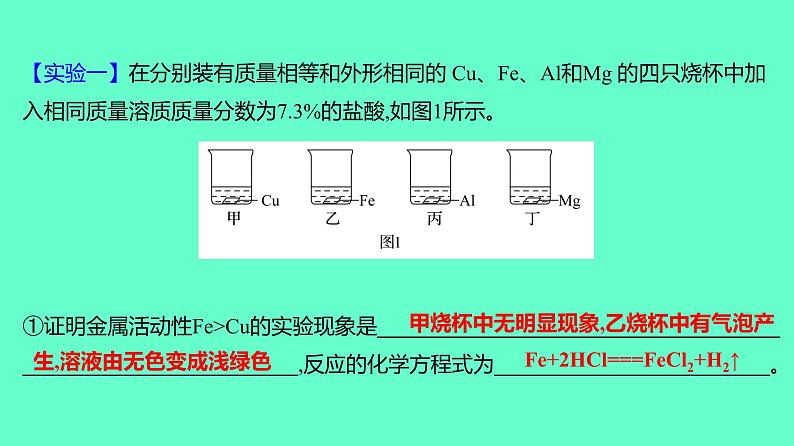
【实验一】在分别装有质量相等和外形相同的 Cu、Fe、Al和Mg 的四只烧杯中加入相同质量溶质质量分数为7.3%的盐酸,如图1所示。①证明金属活动性Fe>Cu的实验现象是________________________________________________________________,反应的化学方程式为__________________________。
甲烧杯中无明显现象,乙烧杯中有气泡产
生,溶液由无色变成浅绿色
Fe+2HCl===FeCl2+H2↑
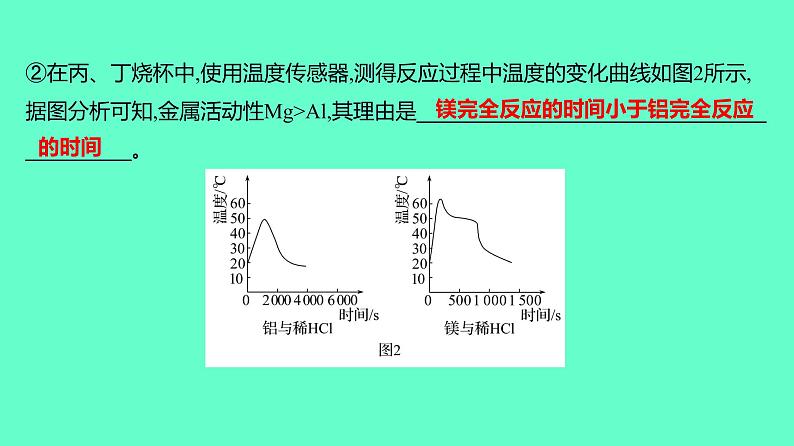
②在丙、丁烧杯中,使用温度传感器,测得反应过程中温度的变化曲线如图2所示,据图分析可知,金属活动性Mg>Al,其理由是___________________________________________。
镁完全反应的时间小于铝完全反应
【实验二】把一定质量的Al放入刚反应结束的乙烧杯中,观察现象,得出结论:金属活动性Al>Fe。③分析实验一和实验二,下列说法正确的是__________。 A.由实验一、二可知,金属活动性Mg>Al>Fe>CuB.实验二,反应后所得溶液中一定有AlCl3C.实验二充分反应后,所得溶液质量一定变小D.实验一,若丁中固体有剩余,则丙、丁中参加反应的盐酸的质量相等
(3)某铝合金可能含有Al、Mg、Cu中的两种或三种。现提供n g样品和足量的稀盐酸,请设计实验确定该铝合金的成分,写出依据实验获取的证据和合金可能的成分:________________________________________________________________________________________________________________________________________________。 (4)目前,铁是使用量最大的金属。写出工业上用赤铁矿(主要成分是Fe2O3)和CO反应生成Fe的化学方程式:______________________________。
取n g铝合金样品于试管中,加入足量的稀盐酸,充分反应后,若固体全部溶解,
则铝合金含有Al、Mg,若有未溶解的红色固体,则铝合金含有Al、Mg、Cu或Al、
3CO+Fe2O3 2Fe+3CO2
【类型二】探究酸碱盐及其性质【例题2】(2023·深圳中考)已知H2与菱铁矿(主要成分为FeCO3,其他成分不参与反应)反应制成纳米铁粉。某小组进行探究并完成如下实验:查阅资料:①H2能与CuO反应生成H2O,H2O能使无水硫酸铜变蓝②CO2与无水硫酸铜不反应(1)某同学探究反应后气体成分,先将反应后气体通入无水硫酸铜,无水硫酸铜变蓝,证明气体中含有___________________,再通入足量的澄清石灰水,澄清石灰水变浑浊,反应方程式为_________________________________。
水蒸气(或H2O)
CO2+Ca(OH)2===CaCO3↓+H2O
(2)对剩余气体成分进行以下猜想:猜想一:H2 猜想二:_________猜想三:CO和H2浓H2SO4的作用:________________________________。
干燥气体,防止影响氢气的鉴别
固体由黑色变为红色
(3)热处理后的纳米铁粉能够除去地下水中的磷元素,如图所示450 ℃或者550 ℃热处理纳米铁粉的除磷率以及pH如图所示,分析_________℃时以及__________(酸性或碱性)处理效果更好。 【考法揭秘】 根据混合物气体成分,利用相关物质进行合理的除杂,再通过剩余气体的化学性质进行设计实验,通过反应后观察到的现象进行合理分析,获取正确的结论。
1.(2023·烟台中考)垃圾是放错地方的资源,城市的废旧电器是一座“金属矿山”,某废旧电器中含有锌、铜、镍(Ni)三种金属,兴趣小组的同学为了从中回收金属铜和镍,做了如下的探究。已知:硫酸镍(化学式NiSO4)能溶于水。实验一:探究锌、铜、镍三种金属在溶液中的活动性强弱【提出猜想】兴趣小组结合常见金属活动性顺序,提出了以下猜想。猜想一:Zn>Ni>Cu;猜想二:Zn>Cu>Ni;猜想三:_______________。
【进行实验】兴趣小组进行了如下的实验,请完成实验报告。
Ni+H2SO4 ===NiSO4+H2↑
实验二:从含有锌、铜、镍三种金属的废旧电器中回收铜和镍【设计方案】兴趣小组设计了如图所示的物质转化流程。步骤①中得到的A是_____________。步骤②中生成C的化学方程式是 _________________________。 【反思评价】合理开发城市“金属矿山”的意义是_____________________________________________(答1条)。
Zn+NiSO4===ZnSO4+Ni
节约金属资源,减少对环境
2.学习化学的一个重要途径是科学探究,请你完成以下探究活动。【探究活动一】化学反应后溶液中溶质成分的探究。如图所示,向碳酸钠溶液和氢氧化钡溶液中,分别滴加稀盐酸,A试管中有气泡产生,B试管中无明显现象,待充分反应后,将两支试管中的溶液倒入同一洁净烧杯中,有气泡和白色沉淀产生。
【提出问题】烧杯中溶液的溶质是什么?【猜想与假设】猜想1:溶质为NaCl猜想2:溶质为NaCl、BaCl2猜想3:溶质为___________________(填化学式) 【验证与探究】同学们取少量烧杯中的溶液于试管中,加入适量的稀硫酸。若有__________________现象,则猜想2正确;若有______________现象,则猜想3正确。 【归纳与总结】经实验证明,猜想3正确。【反思与评价】同学们经过上述实验,认为确定反应后溶液中溶质成分时,除了要考虑生成物外,还要考虑____________________。
NaCl、Na2CO3
【探究活动二】制备与生产流程的探究。钨(W)是一种重要的战略资源。如图是生产钨的一种工业流程。已知:①白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等。②碳在高温条件下会与金属钨反应生成碳化钨。(1)操作3的名称是__________。 (2)“酸浸”时适当升高温度会提高浸出率,但温度不宜太高,原因是____________________。 (3)操作2所得滤液中一定含有的溶质是________________(填化学式)。
CaCl2、HCl
3.(2023·绥化中考)有一包白色粉末,可能是NaHCO3、NaCl中的一种或两种。同学们设计了如下两个实验对其成分进行探究。【定性探究】样品成分验证。【定量探究】样品中NaHCO3的质量分数。
【设计实验】装置图如下:【进行实验】已知:装置B、C、D中药品均足量。①连接装置并检查气密性,加入a g样品于锥形瓶中。②打开K1,通一段时间N2后,称量装置B、C的质量分别是a1 g和a2 g,记录数据。③关闭K1,打开K2,向锥形瓶中缓慢注入足量稀硫酸,关闭K2。④待锥形瓶中无气泡产生时……关闭K1。第二次称量装置B、C的质量分别是a3 g和a4 g记录数据。
【分析讨论】(1)A中反应的化学方程式是____________________________________________。 (2)装置D的作用是_________________________________________。 (3)将④中省略号处的操作补充完整:______________________。 (4)如果没有步骤②中通一段时间N2的操作,会使测得NaHCO3的质量分数_________(选填“偏大”“偏小”或“无影响”)。 【得出结论】样品中NaHCO3的质量分数是__________________(用含有相关字母的式子表示)。
2NaHCO3+H2SO4===Na2SO4+2H2O+2CO2↑
防止空气中的水蒸气和二氧化碳进入C中
4.(2023·长沙中考)“暖宝宝”是我们日常生活中常用的物品。小孔同学打开一个使用过的“暖宝宝”内包装,发现黑色固体中掺杂有红棕色物质,于是她把这包固体带到实验室,和兴趣小组的同学在老师的指导下对这包固体的成分展开了探究。【查阅资料】①铁与空气中的氧气、水蒸气等发生缓慢氧化而生锈;②室温下部分盐的溶解性如表所示;③“暖宝宝”中只有氯化钠含有氯元素。部分盐的溶解性表(室温)
【初步判断】通过阅读标签(如图1),大家一致认为打开“暖宝宝”外包装后,铁粉与空气接触发生缓慢氧化有__________热量的现象;其中出现的红棕色固体是_____________。
【提出问题】这包使用过的“暖宝宝”中是否还有铁粉、活性炭、氯化钠?【进行实验】兴趣小组同学设计如表实验方案并进行实验:
2024中考一轮复习 鲁教版化学 热考专题 专题五 常见气体的制备与净化 课件: 这是一份2024中考一轮复习 鲁教版化学 热考专题 专题五 常见气体的制备与净化 课件,共31页。PPT课件主要包含了专题突破·明技法,用来给物质加热,氯化氢气体,强化训练·检成效,长颈漏斗,导管口有气泡冒出,检查装置气密性,CABD,合理即可,锥形瓶等内容,欢迎下载使用。
2024中考一轮复习 鲁教版化学 热考专题 专题六 实验探究题 课件: 这是一份2024中考一轮复习 鲁教版化学 热考专题 专题六 实验探究题 课件,共52页。PPT课件主要包含了专题突破·明技法,有气泡生成,紫色石蕊试液,Cl-,实验探究1,KSCN,溶液呈血红色,小苏打,氢氧化钠部分变质,进行实验等内容,欢迎下载使用。
2024广西中考复习 通用版化学 热考专题突破 专题五 工艺流程题 课件: 这是一份2024广西中考复习 通用版化学 热考专题突破 专题五 工艺流程题 课件,共41页。PPT课件主要包含了专题突破·明技法,强化训练·检成效,CuO,Na2CO3,CaCO3,有气泡产生,玻璃棒,稀盐酸,金或Au,生石灰等内容,欢迎下载使用。












