
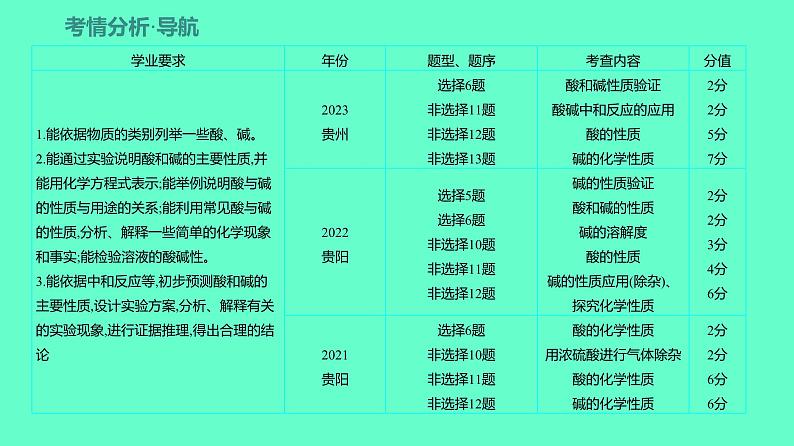
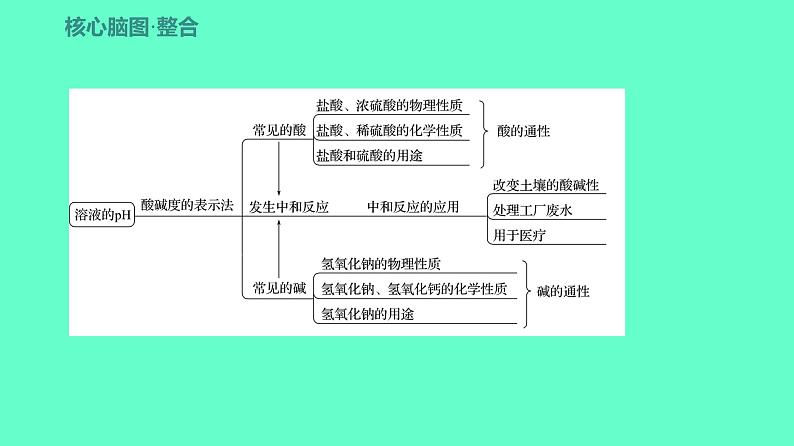


2024贵州中考一轮复习 人教版化学 教材基础复习 主题二 第五讲 课时5 常见的酸和碱 课件
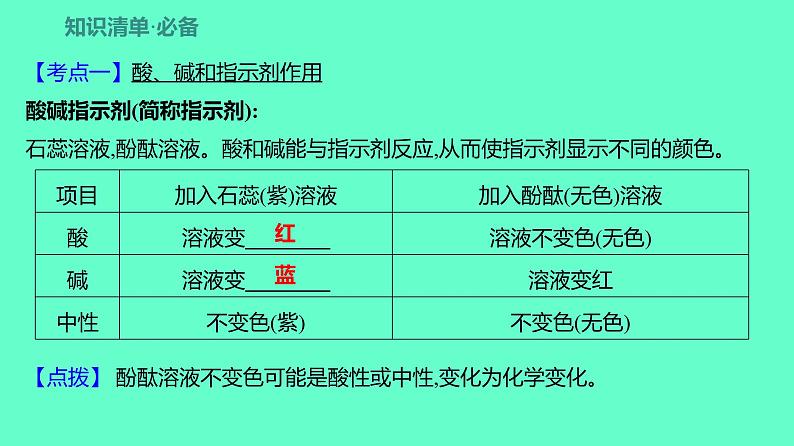
展开【考点一】酸、碱和指示剂作用酸碱指示剂(简称指示剂):石蕊溶液,酚酞溶液。酸和碱能与指示剂反应,从而使指示剂显示不同的颜色。【点拨】 酚酞溶液不变色可能是酸性或中性,变化为化学变化。
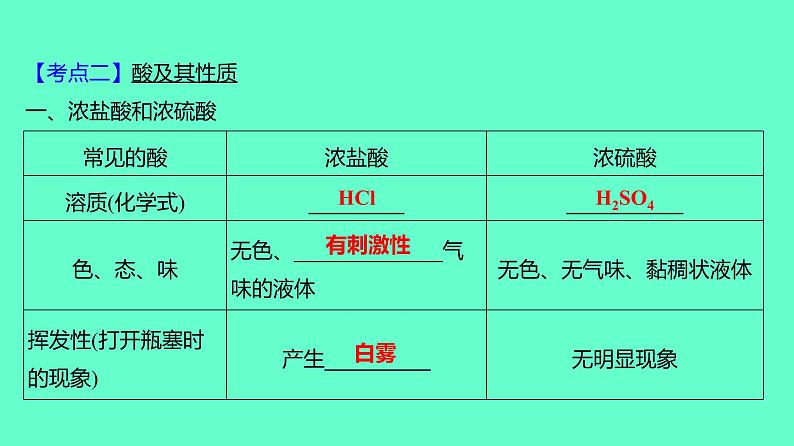
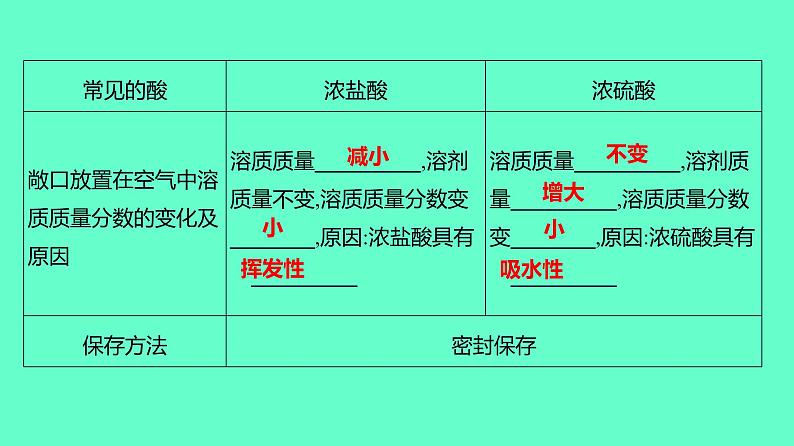
【考点二】酸及其性质一、浓盐酸和浓硫酸
【特别提醒】浓硫酸具有吸水性,在实验室中常用它作干燥剂。常用来干燥O2、H2、CO2、CH4、CO等中性和酸性气体,不能用来干燥碱性气体,如NH3。
2Al+3H2SO4 Al2(SO4)3+3H2↑
Zn+H2SO4 ZnSO4+H2↑
Fe+2HCl FeCl2+H2↑
二、酸的通性 酸溶液都有许多共同的性质,这是由于酸在水中都能电离出____________。
Fe2O3+6HCl 2FeCl3+3H2O
CuO+H2SO4 CuSO4+H2O
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O
CaCO3+2HCl CaCl2+CO2↑+H2O
2NaOH+H2SO4 Na2SO4+2H2O
Ca(OH)2+2HCl CaCl2+2H2O
【特别提醒】浓硫酸、硝酸分别与金属反应不会产生氢气。
HCl+AgNO3 AgCl↓+HNO3
H2SO4+BaCl2 BaSO4↓+2HCl
三、酸的特性1.不同的酸化学性质不同的原因:_______________________________。 2.(1)盐酸与硝酸银反应:________________________________。 (2)硫酸与氯化钡反应:__________________________________。 【特别提醒】 酸的特性不属于酸的共性,酸的性质实际上是H+的化学性质。
阴离子不同(或酸根离子不同)
【考点三】碱及其性质一、氢氧化钠与氢氧化钙
CaCO3 CaO+CO2↑、
CaO+H2O Ca(OH)2
Ca(OH)2+Na2CO3
CaCO3↓+2NaOH
【特别提醒】①氢氧化钠在空气中容易吸水而潮解,可作某些气体的干燥剂,但不可以干燥CO2、HCl、SO2等气体。②碱石灰:主要成分是NaOH和CaO,一般作干燥剂。干燥装置如图:
2NaOH+CO2 Na2CO3+H2O
Ca(OH)2+CO2 CaCO3↓+H2O
二、碱的通性 碱具有通性的原因:在溶液中都能解离出________________。
3NaOH+FeCl3 Fe(OH)3↓+3NaCl
Cu(OH)2+H2SO4 CuSO4+2H2O
NaOH+HCl NaCl+H2O
2NaOH+CuSO4
Cu(OH)2↓+Na2SO4
三、碱的特性1.碱具有特性的原因:____________不同。 2.氢氧化钙溶液与碳酸钠溶液反应,化学方程式为__________________________________________。 【特别提醒】氢氧化铜、氢氧化铁、氢氧化镁等不溶性碱,除能与盐酸、稀硫酸反应外,不具有其他的共性。
Ca(OH)2+Na2CO3
2NaOH+CaCO3↓
【微测诊断】1.常见的酸和碱是中学阶段化学学科的核心主干知识,了解其性质能够更好地解决生活、生产中的实际问题。2.在利用酸或碱化学性质解决实际问题时,需要考虑成本、操作是否便利、是否对环境造成二次污染等,能够在基本知识掌握的同时,学会对酸或碱物质的性质进行科学化、合理探究。
(2023·广安中考)性质决定用途,用途反映性质。下列物质的用途与性质对应不正确的是( )A.用熟石灰改良酸性土壤——熟石灰可与酸性物质反应B.用CO冶炼金属——CO具有可燃性C.用洗涤剂清洗餐具上的油渍——洗涤剂有乳化功能D.用稀盐酸除铁锈——盐酸可与Fe2O3反应
【类型一】酸、碱和指示剂作用 小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )A.紫色 B.蓝色 C.红色 D.无色
【考法揭秘】 根据指示剂的变色情况进行分析,石蕊遇酸变红,遇碱变蓝,酚酞遇碱变红,遇酸不变色。
【举一反三】 下列关于酸和碱的说法正确的是( )A.氢氧化钠可用于干燥二氧化碳气体B.氢氧化钠和氢氧化钙溶于水都会放出大量的热C.人体胃液中含有硫酸,可以帮助消化D.氢氧化钙可用于配制波尔多液、改良酸性土壤
【类型二】常见的酸(盐酸,硫酸) (2023·眉山中考)将一块已生锈的铁片放入质量分数为7.3%的稀盐酸中充分反应, 测得生成H2的质量与稀盐酸的质量关系如图所示(假设铁片除有Fe2O3外不含其他杂质)。下列说法错误的是( )A.配制200 g质量分数为7.3%的稀盐酸需要质量分数为36.5%的浓盐酸40 gB.刚开始加稀盐酸时发生反应的化学方程式为Fe2O3+6HCl 2FeCl3+3H2OC.加入12 g稀盐酸时,溶液中的溶质为FeCl2和FeCl3D.m=0.2
【考法揭秘】 酸能与部分活泼金属及金属氧化物反应,但往往需要关注优先反应的情境。1.金属混合物与酸反应时,比较活泼的金属先与酸反应。如锌和铁的混合物加入盐酸中,锌先与盐酸反应,铁再与盐酸反应。2.金属与混合盐溶液反应时,在金属活动性顺序表里,距离远的先置换(最不活泼的金属最先置换出来),除了钾、钙、钠(太活泼了,无法置换),只能左边置换右边,活泼金属置换不活泼的金属。如向硝酸铜和硝酸银的混合溶液中加入锌,锌先与硝酸银反应,再与硝酸铜反应。3.当金属与金属氧化物的混合物与酸反应时,金属氧化物优先与酸反应。如将稀硫酸滴入氧化铜和铁的混合物中,氧化铜先与硫酸反应生成硫酸铜,铁再与硫酸铜反应,铁与稀硫酸最后反应。
【举一反三】 (2023·滨州中考)下列有关实验现象的描述,正确的是( )A.打开盛浓硫酸的试剂瓶,瓶口会形成白雾B.铁与稀硫酸反应时有气泡产生,形成黄色溶液C.将铜片放入稀硫酸中,铜片逐渐消失,形成蓝色溶液D.用稀硫酸除铁锈时,铁锈逐渐溶解,形成黄色溶液
【类型三】常见的碱(苛性钠,熟石灰) (2023·眉山中考)某化学兴趣小组发现上次做实验用的澄清石灰水忘记了盖瓶盖,试剂瓶内壁附着一层白色固体,底部也有白色固体。【提出问题】白色固体是什么?怎样产生的?【猜想与假设】猜想一:碳酸钙;空气中的二氧化碳与澄清石灰水反应生成碳酸钙。猜想二:氢氧化钙;水分蒸发,析出氢氧化钙固体。猜想三:氢氧化钙和碳酸钙的混合物。
CaCO3+2HCl CaCl2+CO2↑+H2O
【实验探究】(1)甲同学取少量白色固体于试管中,加入过量稀盐酸,振荡,固体全部溶解并有气泡产生。产生气泡的化学方程式为______________________________________,甲同学得出结论,猜想一正确;
CaCl2+2H2O、CaCO3+2HCl CaCl2+CO2↑+H2O
(2)乙同学提出疑问,认为甲同学实验结论不够严谨,其理由是____________________ _________________________________________________;(用化学方程式表示),并补充实验如下: 【实验结论】综上所述,猜想三正确。【实验反思】(3)澄清石灰水必须要__________保存。
Ca(OH)2+2HCl
取少量白色固体于试管中,加适量的
水振荡,静置,在上层清液中滴加少量酚
【举一反三】 (2023·连云港中考)在三颈烧瓶中用排空气法收集CO2气体,然后将三颈烧瓶与盛有盐酸、NaOH溶液的注射器和压强传感器密封连接(如图1)。检验气密性后,在t0时快速注入一种溶液,t2时快速注入第二种溶液,测得瓶内压强随时间变化曲线如图2。下列说法中正确的是( ) A.t0时注入的溶液是盐酸B.t1前压强减小对应的反应示意图如图3所示C.t1~t2期间压强不变且大于0可证明收集的CO2气体不纯D.t2后压强增大的原因是NaOH溶液与盐酸发生中和反应
1.(2023·滨州中考)下表是人体中某些体液的正常pH范围,其中酸性最强的是( )A.胃液 B.唾液 C.血液 D.尿液
2.(2023·本溪模拟)天宫课堂中,宇航员通过实验呈现了“奥运五环”,实验中使用了指示剂——溴百里酚蓝,溴百里酚蓝溶液在酸碱性不同的溶液中的显色情况如图:下列溶液能使绿色溴百里酚蓝溶液变为黄色的是( )A.氯化钠溶液 B.氢氧化钾溶液C.醋酸溶液 D.碳酸钠溶液
3.(2023·枣庄中考)实验室中有两瓶失去标签的无色溶液,分别为稀盐酸与氢氧化钠溶液,下列选用的物质不能将它们鉴别出来的是( )A.紫色石蕊试液 B.镁条C.氧化铜 D.硫酸钠溶液
4.(2023·泰安期中)为验证“酸的化学性质”,某班同学进行了如下的实验。下列说法正确的是( )A.①②③三支试管中没有明显现象的是①B.②中的反应可以用于实验室制取二氧化碳气体C.③中反应的现象是铁锈逐步消失,溶液变为浅绿色D.要全面验证酸的化学通性,④试管中能与酸反应的固体单质可以是铜
5.某化学兴趣小组绘制碱的化学性质思维导图如甲所示,并以氢氧化钠为例设计实验验证碱的化学性质。请回答下列问题:(1)氢氧化钠是重要的化工原料,其俗称是_______(选填字母)。 A.纯碱 B.烧碱 C.小苏打 D.熟石灰
【实验验证】(2)将无色酚酞试液滴入氢氧化钠溶液中,溶液呈________色。 (3)将稀盐酸滴入一定质量的氢氧化钠溶液中,测出溶液的pH随加入稀盐酸的质量变化关系如图乙所示;当pH=7时,溶液中所含的溶质是__________(填化学式)。 (4)用丙图装置进行实验(查阅资料可知CaCl2溶液呈中性)。
2NaOH+CO2 Na2CO3+H2O
【实验过程】打开分液漏斗的活塞,将NaOH浓溶液加入充满CO2气体的锥形瓶A中,关闭活塞,打开弹簧夹,观察到A中产生白色沉淀,烧杯B中液面降低。①写出CO2与NaOH溶液发生反应的化学方程式:______________________________。 ②实验结束后,同学们又分别做了以下三组实验:Ⅰ:取少量A中溶液测其pH,pH>7Ⅱ:取少量A中溶液,向其中加入CaCl2溶液,无明显现象,再测其pH,pH>7Ⅲ:取少量A中溶液,测其pH,pH>7,再向其中加入K2CO3溶液,产生白色沉淀以上三组实验事实中,能说明A中溶液一定含有NaOH的是____________(选填序号)。 (5)若将丙图B中的CaCl2溶液换成澄清石灰水,打开弹簧夹,观察到的实验现象是________________________。该实验验证了上述知识导图中碱能够与________反应。
2024贵州中考一轮复习 人教版化学 教材基础复习 主题一 第二讲 课时1 物质鉴别、检验与推断 课件: 这是一份2024贵州中考一轮复习 人教版化学 教材基础复习 主题一 第二讲 课时1 物质鉴别、检验与推断 课件,共42页。PPT课件主要包含了考情分析·导航,核心脑图·整合,知识清单·必备,H2O+Cu,Cu+CO2,大量气泡,2H2O,BaSO4↓,+2HCl,变浑浊等内容,欢迎下载使用。
2024贵州中考一轮复习 人教版化学 教材基础复习 主题五 第十讲 化学与能源 课件: 这是一份2024贵州中考一轮复习 人教版化学 教材基础复习 主题五 第十讲 化学与能源 课件,共39页。PPT课件主要包含了考情分析·导航,核心脑图·整合,知识清单·必备,可燃性,空气或氧气,足够大的接触面积,高频考点·研析,煤或石油,1∶2,温室效应等内容,欢迎下载使用。
2024贵州中考一轮复习 人教版化学 教材基础复习 主题二 第五讲 课时6 盐 化学肥料 课件: 这是一份2024贵州中考一轮复习 人教版化学 教材基础复习 主题二 第五讲 课时6 盐 化学肥料 课件,共28页。PPT课件主要包含了考情分析·导航,核心脑图·整合,知识清单·必备,侯德榜,侯氏制碱法,小苏打,易分解,胃酸过多,大理石,建筑材料等内容,欢迎下载使用。












