





2024贵州中考复习 人教版化学 板块三 第2讲 质量守恒定律 课件
展开【命题分析】 根据2022版《化学课程标准》及2023年省统考化学试题,从命题内容及考查角度和中考题型两个维度分析如下: 1.从命题内容及考查角度分析: (1)给出生活或实验中的一些变化,利用质量守恒定律进行解释。 (2)结合现代科技或生活中的某些化学反应根据化学方程式,推断其中一种未知物质的化学式。
(3)给出具体的化学反应,应用质量守恒定律判断物质中所含元素的种类,或计算所含元素的质量。 (4)给出某化学反应的微观示意图,考查质量守恒定律的本质、反应类型、物质种类及质量关系等内容。 (5)通过设计实验证明质量守恒定律,分析实验中产生误差的原因,评价实验方案的严密性、可行性。
2.从中考题型上分析: (1)以选择题的形式考查对质量守恒定律的理解和应用,物质所含元素种类的判断,化学式的推导,某种物质质量的计算,化学方程式书写正误及反应类型的判断。 (2)以实验探究题的形式考查质量守恒定律的分析和验证。
【复习建议】 质量守恒定律的理解与应用:对质量守恒定律的理解和应用是中考的重点和必考点,复习时建议: (1)从微观角度理解质量守恒定律是学生复习的难点,复习时应从宏观与微观两个不同角度梳理出化学变化中的“六个不变”“两个一定变”“两个可能变”,帮助学生加深理解质量守恒的本质。 (2)从以下角度练习质量守恒定律的应用:①解释有关现象;②根据化学方程式确定物质的化学式;③根据化学方程式确定物质的相对分子质量;④根据化学方程式求某元素的质量;⑤结合图表信息或微观示意图判断反应类型、物质种类、质量关系等。
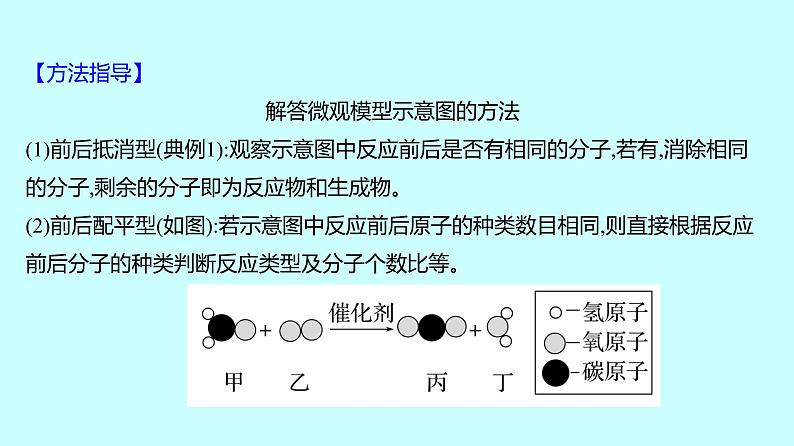
要点 质量守恒定律及其应用角度1 微观模型示意图题【典例1】(2023·自贡中考)中国计划在2060年实现“碳中和”,彰显了大国担当。资源化利用CO2是实现“碳中和”的重要途径。如图是CO2转化为甲醇(CH3OH)的微观示意图,关于该反应的说法错误的是 ( )A.该反应体系中共有4种化合物B.该反应体现了无机物在一定条件下可以转化为有机物C.参加反应的CO2、H2分子个数比为1∶3D.参加反应的CO2与H2的总质量等于生成的CH3OH与H2O的总质量
【方法指导】解答微观模型示意图的方法(1)前后抵消型(典例1):观察示意图中反应前后是否有相同的分子,若有,消除相同的分子,剩余的分子即为反应物和生成物。(2)前后配平型(如图):若示意图中反应前后原子的种类数目相同,则直接根据反应前后分子的种类判断反应类型及分子个数比等。
(3)前后未配平型(如图):根据图注写出各物质的化学式,然后写出反应的化学方程式,根据方程式判断反应类型、物质类别及参加反应的分子个数比、物质的质量比等。
角度2 图表数据分析题【典例2】(2023·衡阳中考)在一个密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如图所示。下列说法正确的是( )A.x=14B.乙一定是催化剂C.甲可能是单质D.丙和丁的相对分子质量之比一定是9∶8
【方法指导】有关质量守恒定律图表题的解题方法(“三步走”)中考常考的方式有柱状图、饼状图或表格图。虽然呈现形式不同,但解题方法相同。
实验 有关质量守恒定律的实验探究1.必记基础知识:(1)理论依据:质量守恒定律应用于化学变化,不能用于物理变化,因此所选择的实验原理必须是化学反应。(2)实验过程:选择反应现象明显能通过肉眼观察到的反应,物质发生反应后,通过托盘天平称量反应前后的质量无变化,得出质量守恒的结论。
(3)装置要求:若整个反应过程中无气体生成,装置不需要为密闭容器;若反应中有气体参加或生成,则应在密闭容器中进行。常见装置如下:
2.问题探究:(1)在用白磷或红磷进行此实验时,气球的作用是什么?___________________________________________________________________________________________ (2)任何化学反应都遵守质量守恒定律。造成反应前后天平不平衡的原因可能有哪些?(答出两条即可)_________________________________________________________________________________________________________________
提示:一是调节锥形瓶内的压强,起缓冲作用;二是起密封作用,防止实验时锥形瓶
提示:①反应装置气密性不好,使部分物质进入或逸散,造成质量发生变化。②如
用气球收集反应生成的气体时浮力的影响等。
【示范题】(2023·泸州中考)老师组织同学们对质量守恒定律进行了实验探究。回答相关问题:(1)第1小组设计甲图的实验方案,用电子秤称量,读取加入盐酸前后的质量。反应的化学方程式为______________________________________,比较读数发现反应前后的质量并不相等,其原因是________________________________。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
反应生成的二氧化碳逸出装置
(2)第2小组设计了乙图方案,以解决第1小组遇到的问题。但有同学认为会产生误差,他的理由是气球膨胀后不可忽略__________的影响。老师肯定了该同学勇于质疑、精益求精的科学精神。
(3)第3小组善于创新,设计了丙图方案,既达成本实验目的,又可以测定空气中氧气的含量。①连接好装置后,打开弹簧夹,推或拉注射器活塞,松开手后活塞回到原位,说明气密性________(选填“好”或“不好”)。 ②关闭弹簧夹,记录注射器初始读数,强光引燃白磷,冷却后打开弹簧夹。为保证锥形瓶内氧气完全反应,实验应采取的措施是______________(任答1点); 实验中需要测定的数据是锥形瓶(含导管)的容积、__________________________。
注射器反应前后的体积
1.(2022·黔东南州中考)纯净物甲是一种绿色能源,常用作火锅和内燃机的燃料。在一定条件下,一定质量的甲与4.8 g乙完全反应,生成4.4 g丙和2.7 g丁,反应的微观示意图如图所示,下列有关说法正确的是 ( )A.甲中含碳、氢元素,可能含氧元素B.甲中含碳、氢、氧元素C.该反应属于复分解反应D.反应前后各元素的化合价均没有发生变化
2.(2022·遵义中考)下列反应可用于汽车尾气处理,其反应的微观示意图如下。下列说法正确的是 ( )A.该反应的基本反应类型为置换反应B.反应前后氮元素的化合价未发生改变C.参加反应的甲与生成的丁的分子个数比为2∶3D.反应前后原子种类、分子种类都没有发生改变
3.(2022·黔西南州中考)观察下列在一定条件下发生的化学反应的微观示意图:(1)如图中,生成物的化学式是 _________。 (2)上述反应过程中,发生反应的物质与所生成物质的微粒个数之比 ∶ ∶ 为 _____________。
4.(2023·贵州中考)自然界有一种含镁矿石,经处理后得到只含MgCO3和Mg(OH)2的混合物,可作生产耐火材料氧化镁的原料。为确定其组成,现各取w g样品两份,第一份样品加过量稀盐酸,生成气体8.8 g;第二份样品加热,固体质量与反应时间的变化关系如图所示,化学方程式:MgCO3 MgO+CO2↑;Mg(OH)2 MgO+H2O↑。下列说法错误的是 ( )A.MgCO3和Mg(OH)2的混合物可用作防火材料B.样品中MgCO3与Mg(OH)2的质量比为168∶58C.第二份样品加热后,固体中镁元素的质量分数变大D.两份样品充分反应后,生成CO2气体的质量相等
【基础达标】1.(2023·宜昌中考)下列现象能用质量守恒定律解释的是 ( )A.蔗糖溶于水后总质量不变B.浓硫酸敞口放置质量增加C.饱和硝酸钾溶液升温,溶液质量不变D.硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
2.(2023·黔东南州一模)近年来,随着排放标准的日益严苛,基于锂离子电池的新能源汽车异军突起,已成为取代传统燃油车的新生力量。锂电池充电时发生反应的化学方程式为LiCO2+6C===X+LiC6,下列说法正确的是 ( )A.X的化学式为COB.该反应不符合质量守恒定律C.该反应属于置换反应D.反应中一定有元素化合价发生变化
4.(2023·绥化中考)在化学反应A+2B===C+2D中,已知C和D的相对分子质量之比是22∶9,当6.4 g B与足量A完全反应后,生成3.6 g D。则在此反应中,B和C的质量比是( )A.8∶11 B.2∶11 C.16∶11 D.16∶9
5.氨气的催化氧化是制备硝酸的主要反应之一,如图是该反应的微观示意图。下列说法正确的是( )A.反应前后原子的总数改变B.甲物质由1个氮原子和3个氢原子构成C.参加反应的乙、丙两物质的分子个数比为5∶4D.参加反应的甲、乙两物质的质量比为17∶4
6.(2023·郴州中考)一定条件下,在密闭容器中发生某化学反应,测得反应过程中各物质的质量数据如表:
下列选项正确的是( )A.a=11 B.丁一定是催化剂C.该反应为分解反应D.b=3
7.(2022·安顺模拟)容器内有甲、乙、丙、丁四种物质,一定条件下发生了化学反应,各物质的质量变化如图所示。下列说法正确的是( )A.X=0B.丙可能为该反应的催化剂C.乙、丁两物质变化的质量比为2∶3D.甲和丁的相对分子质量之比为1∶2
8.(2023·滨州中考)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是( )A.物质甲是生成物B.反应后乙物质的质量分数是18%C.该化学反应中甲、乙两物质的质量比是14∶3D.物质丁一定是该反应的催化剂
9.(2023·贵阳模拟)从宏观、微观相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:宏观辨识(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束后,再次称量,观察到托盘天平的指针________(填“向左”“向右”或“不”)偏转。
微观探析(2)如图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为__________反应。从微观角度分析,过程Ⅰ表示分子分解成__________的过程。
【能力提升】1.(2023·怀化中考)一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量关系如下表:
根据上表信息判断,下列说法中不正确的是( )A.a=10B.该反应属于置换反应C.Z为化合物D.反应中Y、W两种物质发生改变的质量比为22∶9
2.(2023·遵义模拟)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为21.6 g、m g、9.2 g。下列说法正确的是 ( )A.AgNO3的质量为30.8 gB.m=3.6C.X的化学式为NOD.该反应方程式中Ag与O2的化学计量数之比为2∶1
4.(2022·贺州中考)将138 g酒精(C2H5OH)点燃,酒精燃烧全部变为CO、CO2和H2O,恢复到室温,测得所得气体中氧元素质量分数为64%,则燃烧所耗氧气的质量为( )A.96 g B.128 g C.136 g D.224 g
5.小华同学在复习“质量守恒定律”时,回忆了老师做的如图几个演示实验:
已知:Fe+CuSO4===FeSO4+Cu(1)实验1中所用的白磷过量,该实验涉及的化学方程式为_______________________。该实验中气球的作用是_______________________________________________。实验后冷却至室温,将锥形瓶倒置于盛满水的水槽中,取下瓶塞,观察到的现象是________________________________________________________________。 (2)在实验2结束后,天平指针向右偏,该实验 __________(填“遵循”与“不遵循”)质量守恒定律,天平不平衡的原因是________________________________。
4P+5O2 2P2O5
形成密封装置,平衡装置内外压强,防止瓶塞飞出
水进入锥形瓶,进入的水的体积约占锥形瓶中空气总体积的五分之一
2024贵州中考复习 人教版化学 板块一 第7讲 盐 化肥 课件: 这是一份2024贵州中考复习 人教版化学 板块一 第7讲 盐 化肥 课件,共60页。PPT课件主要包含了复习导航·析考向,知识清单·理脉络,复分解反应,考点突破·释疑难,实验探究·培素养,溶解性,不再溶解,再过滤一次,玻璃棒,食盐不是纯净物等内容,欢迎下载使用。
2024贵州中考复习 人教版化学 板块一 第6讲 酸和碱 课件: 这是一份2024贵州中考复习 人教版化学 板块一 第6讲 酸和碱 课件,共60页。PPT课件主要包含了复习导航·析考向,知识清单·理脉络,常见的酸,酸的化学性质,常见的碱,碱的化学性质,中和反应,考点突破·释疑难,铁或Fe,O2或氧气等内容,欢迎下载使用。
2024贵州中考复习 人教版化学 板块一 第4讲 常见的溶液 课件: 这是一份2024贵州中考复习 人教版化学 板块一 第4讲 常见的溶液 课件,共60页。PPT课件主要包含了复习导航·析考向,知识清单·理脉络,溶解与乳化,考点突破·释疑难,1∶4,蒸发结晶,乙甲丙,实验探究·培素养,托盘天平,玻璃棒等内容,欢迎下载使用。












