

高中化学鲁科版 (2019)必修 第二册第3节 化学反应的快慢和限度精练
展开
这是一份高中化学鲁科版 (2019)必修 第二册第3节 化学反应的快慢和限度精练,共11页。试卷主要包含了 下列叙述中正确的是等内容,欢迎下载使用。
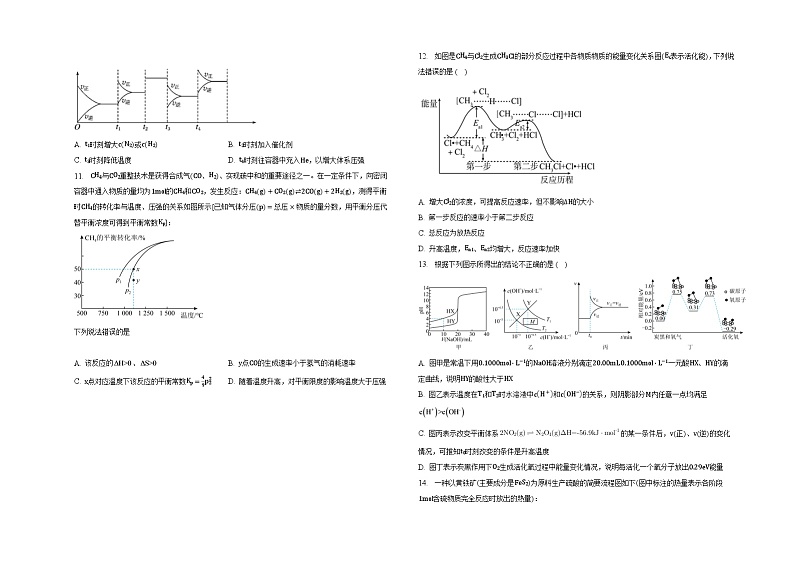
1. 反应AX3g+X2g⇌AX5g在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.20 ml。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
A. 实验c,从反应开始至达到平衡时v(AX3)=2.0×10−4ml⋅L−1⋅min
B. 实验a,用浓度表示的平衡常数为100
C. 该反应的△H>0
D. 比较实验a、c可得出升高温度反应速率加快
2. CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是
A. 反应①为CaO+CO2=CaCO3;反应②为CaCO3+CH4催化剂 CaO+2CO+2H2
B. t1 t3,nH2比n(CO)多,且生成H2速率不变,可能有副反应CH4催化剂 C+2H2
C. t2时刻,副反应生成H2的速率大于反应②生成H2速率
D. t3之后,生成CO的速率为0,是因为反应②不再发生
3. 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法正确的是 ( )
A. pH越大氧化率越大
B. 温度越高氧化率越小
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 实验说明降低pH、升高温度有利于提高Fe2+的氧化率
4. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。此反应合成甲醇的速率较慢,要使反应速率加快,应主要降低能量差的步骤是( )
A. ∗CO+∗OH→∗CO+∗H2OB. ∗CO→∗OCH
C. ∗OCH2→∗OCH3D. ∗OCH3→∗CH3OH
5. 下列叙述中正确的是 ( )
A. 图1表示25 min内,用Y表示的平均反应速率为0.016 ml·L−1·min−1
B. 图2可表示碳与二氧化碳反应的能量变化
C. 图3表示在钢铁内部电子由碳一侧流向铁一侧
D. 图4表示反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)中NO和CO转化率为2:1时,反应达平衡状态
6. 可逆反应A(g)+3B(g)⇌2C(g)ΔH0,在80℃时,将0.4ml的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)20s时,N2O4的分解率是_________________。
(2)40s时,NO2的浓度为_________________,0∼40s内N2O4的平均反应速率为__________________。
(3)在80℃时该反应的平衡常数K值为_________________ (保留2位小数)。
(4)判断t2、t3、t4时刻对该反应采取的措施。
t2:__________________;t3:__________________;t4:__________________。
三、实验题
18. 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O 72−转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的Cr2O 72−浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为_______________________________________(填化学式)。
(3)实验①和②的结果表明_________________________________________________;
实验①中0~t1时间段反应速率v(Cr3+)=__________ ml·L−1·min−1(用代数式表示)。
19. 某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应;2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
(1)图1装置中盛放A溶液的仪器名称是________。
(2)此实验探究的是________因素对化学反应速率的影响,若实验②在40 s末收集了44.8 mL CO2(标准状况下)则在40 s内v(MnO4−)= ________(忽略溶液混合前后体积的变化)。
(3)小组同学将图1的气体收集装置改为图2,实验完毕后,应先将气体冷却至室温,再调节量气管高度使两液面相平(或向下移动量气管使两端液面相平),最后平视量气管刻度进行读数。为减小气体测量误差,还可以将量气管中的水换成________。
(4)除了从生成气体角度,通过测定_________________来比较反应速率,本实验还可以通过测定硫酸浓度变化来比较化学反应速率。
(5)同学们在实验中发现反应速率总是如图3所示,探究时间内速率变快的主要原因可能是________(填标号)。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大
答案和解析
1.【答案】C
【解析】实验c,设达到平衡时X2转化的物质的量为x ml,根据“三段式”法进行计算:
起始量/ml 0.20 0.20 0
转化量/ml x x x
平衡量/ml 0.20−x 0.20−x x
则0.20−x+0.20−x+x0.20+0.20=140175,解得x=0.08,vAX3=0.08 ml10 L×40 min=2×10−4 ml⋅L−1⋅min−1,A项正确。
实验a,设平衡时转化的X2,的物质的量为y ml,运用“三段式法进行计算:
起始量/ml 0.20 0.20 0
转化量/ml y y y
平衡量/ml 0.20−y 0.20−y y
则0.20−y+0.20−y+y0.20+0.20=120160,解得y=0.10,则平衡时cAX3=cX2=cAX5=0.01 ml⋅L−1,故用浓度表示的平衡常数K=×0.01=100,B项正确;
实验c相对于实验a,容器容积和起始投料量均相同,但起始总压强增大,因此实验c的温度高于实验a,由于实验a达到平衡时AX3(g)转化0.10 ml,实验c达到平衡时AX3(g)转化0.08 ml,因此升高温度,平衡向逆反应方向移动,该反应的逆反应为吸热反应,正反应为放热反应,ΔH0;同一压强下,升高温度,CH4的平衡转化率升高,则该反应为吸热反应,ΔH>0;A正确;
B.y点,CH4的转化率还未达到平衡转化率,说明平衡正向移动,则CO的生成速率大于CO的消耗速率,CO的消耗速率等于H2的消耗速率,所以,y点CO的生成速率大于H2的消耗速率,B错误;
C.x点,CH4的平衡转化率为50%,则CH4和CO2的物质的量变化量均为0.5ml,则平衡时,CH4、CO2、CO和H2的物质的量分别为0.5ml、0.5ml、1ml和1ml,p(CH4)=p(CO2)=0.5ml3ml×P2=16P2,p(CO)=p(H2)=1ml3ml× P2=13P2,Kp=p2CO⋅p2H2pCH4⋅pCO2=(13P2)2×(13P2)216P2×16P2=49P22,C正确;
D.随着温度升高,同一温度,不同压强下,CH4的平衡转化率的差别越来越小,说明对平衡限度的影响温度大于压强,D正确;
故选B。
12.【答案】D
【解析】Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,但增大氯气的浓度不影响ΔH的大小,故A正确;
第一步的活化能大于第二步活化能,所以第一步反应的速率小于第二步反应,故B正确;
反应物的总能量大于生成物的总能量,为放热反应,故C正确;
Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,故D错误。
13.【答案】C
【解析】
【分析】
略
【解答】
⋅L−1一元酸HX、HY的pH,HY
相关试卷
这是一份高中化学鲁科版 (2019)必修 第二册第3节 化学反应的快慢和限度课后测评,共12页。试卷主要包含了单选题,实验题,原理综合题等内容,欢迎下载使用。
这是一份化学必修 第二册第3节 化学反应的快慢和限度课时作业,共13页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第3节 化学反应的快慢和限度习题,共10页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。










