






化学必修 第一册第三章 铁 金属材料第一节 铁及其化合物课堂教学ppt课件
展开
这是一份化学必修 第一册第三章 铁 金属材料第一节 铁及其化合物课堂教学ppt课件,共39页。PPT课件主要包含了第二节金属材料,北大校园,铁及其化合物,第二课时,铁的重要化合物,Fe2O3,FeO,Fe3O4,铁的氧化物,俗名铁红等内容,欢迎下载使用。
第三章 铁 金属材料
第一节 铁及其化合物
新课标人教版必修第一册
1、铁的单质2、铁的重要化合物3、铁的重要化合物与铜
走进《必修1》,探索无机世界的奥秘,从学习铁及其化合物开始!
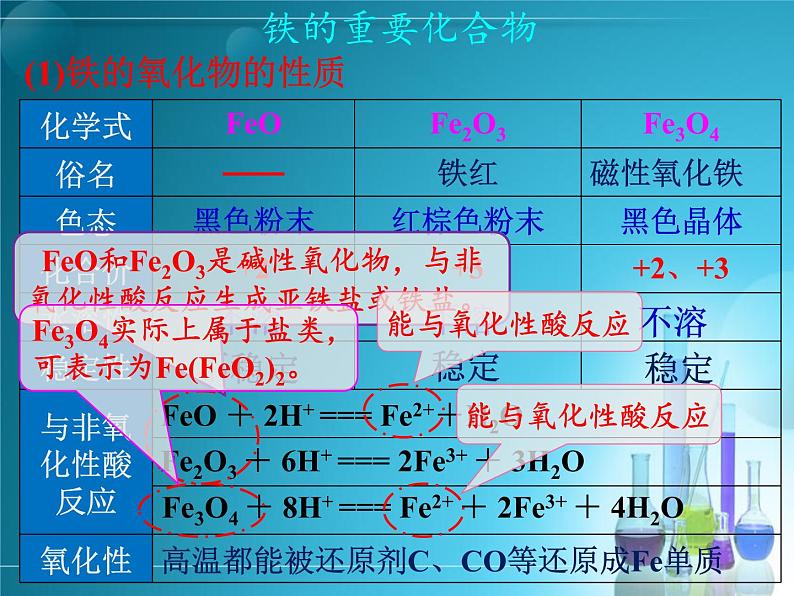
Fe2O3是红棕色粉末用Fe2O3制成的红棕色涂料 FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。 Fe3O4是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁,是磁铁矿的主要成分。
铁与氧气的反应生成Fe3O4
铁的存在:铁在地壳中的含量仅次于铝,主要以+2和+3价化合物的形式存在。
+2 +3 +2 +3
(1)铁的氧化物的性质
FeO + 2H+ === Fe2++H2O
Fe2O3 + 6H+ === 2Fe3+ + 3H2O
Fe3O4 + 8H+ === Fe2+ + 2Fe3+ + 4H2O
高温都能被还原剂C、CO等还原成Fe单质
FeO和Fe2O3是碱性氧化物,与非氧化性酸反应生成亚铁盐或铁盐。
Fe3O4实际上属于盐类,可表示为Fe(FeO2)2。
(1)铁的氧化物的性质①与氧化性酸的反应:如与稀硝酸的反应
3FeO +NO3- +10H+ === 3Fe3++NO↑+5H2O
3Fe3O4+NO3-+28H+ === 9Fe3++NO↑+14H2O
②氧化物间的相互转化:Fe2O3 和 Fe3O4 性质稳定, FeO不稳定,受热时讯速被氧化为Fe3O4。
③易被还原:高温时,都能被C、CO、H2等还原剂还原成Fe单质。用 FexOy表示铁的氧化物
ⅱ.铁红:用于制红色油漆、涂料和油墨
(2)铁的氧化物的用途
①氧化铁(Fe2O3) :红棕色粉末ⅰ.赤铁矿:作为冶炼金属铁的原料
图3-7 (P71):氧化铁作外墙涂料
③四氧化三铁(俗称磁性氧化铁、Fe3O4):黑色晶体,用于制录音磁带和电讯器材。
②氧化亚铁(FeO) :黑色粉末,用作色素;用于化妆品、刺青墨水,使瓷器釉层呈绿色)
FeCl3中有红褐色沉淀; FeSO4中白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
在两支试管中分别加入少量的 FeCl3 溶液和 FeSO4 溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeSO4+2NaOH=Fe(OH)2↓+3Na2SO4
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
4Fe(OH)2+O2+2H2O =4Fe(OH)3
Fe3++3OH- =Fe(OH)3↓
Fe2+ + 2OH- =Fe(OH)2↓
白色絮状沉淀→迅速变成灰绿色→最后变成红褐色
4Fe(OH)2+O2+2H2O =4Fe(OH)3
①Fe(OH)2和Fe(OH)3的生成
(1)铁的氢氧化物的制备
图3-8(课本P71):Fe(OH)2和 Fe(OH)2的生成
思考1、为什么实验中生成Fe(OH)2白色絮状沉淀迅速变成灰绿色,最后变成红褐色呢?
反应原理: Fe2+ + 2OH- ===Fe(OH)2↓ 4Fe(OH)2+O2+2H2O ===4Fe(OH)3
思考2、制取Fe(OH)2时应注意什么问题?实验时如何操作?
正二价铁具有还原性,容易被溶解在溶液中的氧气氧化成正三价的铁。
制取Fe(OH)2应防氧化
思考与讨论(课本P72)
②氢氧化亚铁的制备 ——防氧化制备原理:
制备方案:ⅰ.试剂:使用新配制FeSO4溶液(保存时加少量铁粉、滴加几滴稀硫酸)和新配制NaOH溶液。
Fe2++2OH-===Fe(OH)2↓
ⅳ.滴加NaOH操作:滴加NaOH溶液的长胶头滴管的尖端插入FeSO4溶液的液面以下。
ⅲ.隔绝空气:在试管中FeSO4溶液液面上预先注入一层植物油(或苯),防空气中氧气氧化。
ⅱ.蒸馏水:把配制溶液使用的蒸馏水事先加热煮沸一段时间,冷却后用于配制溶液。
常见的几种制备氢氧化亚铁的装置
②氢氧化亚铁的制备 ——防氧化制备装置:
ⅰ.隔绝空气:隔绝空气防氧化
ⅱ.排除空气:排除空气防氧化
思考3、用如图所示的方法制取Fe(OH)2,最终为何没有得到预想中的白色沉淀?
②氢氧化亚铁的制备 —防氧化
Fe2++OH- === Fe(OH)2↓
Fe(OH)2同时还发生氧化反应
4Fe(OH)2+2H2O + O2 === 4Fe(OH)3
思考4、若要制得纯净的Fe(OH)2,最问题的关键是什么?如何解决呢?
白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
滴管插入试管中的液面以下来防氧化
训练1、下列各图示中,能够较长时间的看到Fe(OH)2白色沉淀的是( )
A.①② B.①③ C.②③ D.①②③
Fe(OH)2+2H+ === Fe2+ +2H2O
Fe(OH)3+3H+ === Fe3++3H2O
(2)铁的氢氧化物的性质
①铁氢氧化物与可溶性酸的反应
ⅰ.跟非氧化性酸的反应:如稀硫酸、盐酸
ⅱ. Fe(OH)2跟氧化性酸的反应:如稀硝酸
与非氧化性酸反应,反应前后铁元素的化合价没有变化。
3Fe(OH)2+10HNO3 ===3Fe(NO3)3+NO↑+8H2O
3Fe(OH)2+10H++NO3- ===3Fe3++NO↑+8H2O
②铁氢氧化物不稳定性:受热易分解
ⅲ. Fe(OH)3跟还原性酸的反应:如氢碘酸
2Fe(OH)3 + 6H+ +2I- === 2Fe2++6H2O+I2
2Fe(OH)3 + 6HI === 2FeI2 + 6H2O+I2
与氧化性酸反应,铁元素的化合价最终为高价态的+3价。
与还原性酸反应,铁元素的化合价最终为低价态的+2价。
4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3
白色絮状沉淀,迅速变为灰绿色,最终变为红褐色。
Fe2+ + 2OH- === Fe(OH)2↓
Fe(OH)2 + 2H+ === Fe2+ + 2H2O
Fe(OH)3 + 3H+ === Fe3+ + 3H2O
(1)Fe3+、Fe2+的检验
FeCl3溶液由黄色(或棕黄色)变成红色(或血红色); FeCl2溶液颜色(浅绿)无明显变化
在2支试管里,分别加入 5ml FeCl2溶液和 5 ml FeCl3溶液,各滴加几滴KSCN溶液,观察现象并记录。
Fe3++3SCN- === Fe(SCN)3
图3-9 (P68):Fe3+、Fe3+的检验
Fe3+ Fe2+
(1)Fe3+、Fe3+的检验
溶液由黄色(或棕黄色)变成红色(或血红色)
溶液颜色(浅绿)无明显变化
① Fe2+的检验方法
ⅰ.用KSCN溶液检验Fe2+
滴入KSCN溶液,溶液颜色无变化;滴加氯水溶液呈血红色。
氯水改为H2O2先变红后褪色,最终溶液呈黄色
ⅱ.用NaOH溶液检验Fe2+
2Fe2++Cl2=== Fe3+ +2Cl-
滴入NaOH溶液,有白色絮状沉淀,白色沉淀又迅速变成灰绿色,最后变成红褐色。
Fe2++2OH- === Fe(OH)2↓
4Fe(OH)2+2H2O+O2===4Fe(OH)3
若H2O2代替氯水,必须控制好H2O2溶液的用量。且溶液最终呈黄色, H2O2不能使Fe3+褪色
ⅰ.用KSCN溶液检验Fe2+:滴入KSCN溶液,无明显现象,再滴加氯水,溶液呈红色。
ⅱ.用NaOH溶液检验Fe3+
滴入NaOH溶液,有红褐色沉淀产生
Fe3++3OH- === Fe(OH)3↓
② Fe3+的检验方法
③混合离子中Fe3+或Fe2+的检验
ⅰ. Fe3+的检验:含有Fe3+和Fe2+的溶液中,检验Fe3+的存在。
滴入KSCN溶液,溶液呈血红色,证明有溶液中有Fe3+存在。
Fe2+不影响用KSCN溶液检验Fe3+
ⅱ. Fe2+的检验:含有Fe3+和Fe2+的溶液中,检验Fe2+的存在。
检验方法: 滴加紫红色酸性KMnO4溶液,紫红色褪去溶液呈黄色,证明有溶液中有Fe2+存在。
5Fe2++MnO4-+8H+=== 5Fe3++Mn2++4H2O
若用氯水和KSCN溶液检验Fe2+,Fe3+影响用KSCN溶液对Fe2+的检验
实验现象:ⅰ.Fe3+被还原:溶液由棕黄色(或黄色)变为浅绿色。滴加几滴KSCN溶液无明显现象。 ⅱ.Fe2+被氧化:溶液(含KSCN)由浅绿变为红色
(2)Fe3+和Fe2+的转化
图3-10 (P68)离子的转化
在盛有 2 ml FeCl3溶液的试管里加入少量铁粉振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录现象。把上层清液倒入另一支试管中,在滴入几滴氯水,又发生了什么反应。
这里溶液含有KSCN,应该由浅绿色变为血红色。
溶液由棕黄色变为浅绿色。
溶液变为血红色或红色。
2Fe3+ + Fe===3Fe2+
2Fe2++Cl2 ===2Fe3++2Cl-
Fe3++3SCN- ===Fe(SCN)3
①Fe3+被还原: Fe3+具有氧化性,能被Fe单质还原剂还原。
②Fe2+被氧化: Fe2+既有氧化性又有还原性,主要表现还原性,能被Cl2等氧化剂氧化。
2Fe2++Cl2==2Fe3++2Cl-
Fe3++3SCN -==Fe(SCN)3
图3-10 (P68):离子转化
Fe3+能被Cu单质还原。
2Fe3+ + Cu===2Fe2+ + Cu2+
思考与讨论 (课本P69)
Fe3+ 和Fe2+在一定条件下可以相互转化:
2Fe2++Cl2===2Fe3++2Cl-
讨论1、Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂?哪种可做还原剂?哪种既可做氧化剂又可做还原剂?写出相应的化学反应方程式,并加以说明。
Fe2+ +Mg===Mg2+ + Fe
讨论2、请用图示方法归纳Fe、Fe3+和Fe2+三者之间的相互转化关系?
请改写成相应的化学反应方程式!
ⅰ. Fe:只具有还原性ⅱ. Fe3+:只具有氧化性ⅲ.Fe2+:既具有氧化性又具有还原性
c .强还原剂:Al、Zn、H2、C、CO等
d.弱还原剂:Fe、Cu、S2-、SO32-、I-等
b.强氧化剂:O2、 Cl2、 Br2、HNO3、H2O2、ClO-、KMnO4(H+) 等
a.弱氧化剂:I2、H+ 、Cu2+ 、Ag+、S 、 Fe3+等
O2 、H2O与Fe在一定条件下反应,生成的产物均是Fe3O4
(1)Fe3O4中的Fe的化合价有+2和+3价,故Fe3O4为混合物( )(2)Fe(OH)2在空气中易转化为Fe(OH)3,说明Fe(OH)2易被还原。( )(3)Cu与Fe3+的反应为置换反应。( )(4)FeCl3与Fe的反应体现了Fe3+的氧化性 ( )
训练2.判断正误(正确的打“√”,错误的打“×”)
训练3.下列关于Fe2+和Fe3+的叙述中,错误的是( ) A.Fe2+的水溶液为浅绿色 B.Fe3+的水溶液为棕黄色 C.Fe2+具有还原性和氧化性 D.向含Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
(3)含铁物质的分离与提纯
滴加过量氯水或通入过量Cl2。
先加过量铁粉,后过滤。
一般地,加入的试剂要过量,且滴加的试剂与原物质状态不同,便于分离。
①Fe2+保存:应密封保存,加入铁粉(滴几滴对应的酸)防氧化。② Fe3+保存:加入对应的酸,防水解。
H2O2作氧化剂最好,不引入杂质;但价格高。
(4)铁盐、亚铁盐的保存
均能与非氧化性酸反应,其中FeO、Fe3O4能与氧化性酸反应。
Fe3++3OH-=Fe(OH)3↓
(2)铁的氢氧化物的性质 铁的氢氧化物均能与酸反应、具有不稳定性易分解;氢氧化亚铁还能被氧化性酸氧化。
3、铁盐、亚铁盐:Fe3+有氧化性,Fe2+既有氧化性,又有还原性,以还原性为主。
(1)铁离子的检验① Fe3+的检验:用KSCN溶液检验Fe3+②Fe2+的检验:用KMnO4溶液检验Fe2+
(2)铁离子转化:Fe、Fe2+、Fe3+之间在一定条件下可以相互转化。
2Fe3+ + Fe === 3Fe2+
4Fe(OH)2+O2+2H2O ===4Fe(OH)3
练习1、下列物质发生反应时,其离子方程式正确的是( )A. 三氯化铁溶液中加入过量铁粉 Fe3+ + Fe=2Fe2+B. 向氯化亚铁溶液中通入氯气 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-C. 氯化铁溶液中通入硫化氢 2Fe3+ + S2- = 2Fe2+ + SD. 向盛硫化亚铁的容器中加入稀硝酸 FeS + 2H+=Fe2+ + H2S↑
练习2、(双选)证明某溶液只含有Fe2+而不含Fe3+的实验方法是( ) A. 先滴加氯水,再滴加KSCN溶液后显红色 B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 C. 滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色 D. 只需滴加KSCN溶液
练习3.用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,这种试剂是( ) A.BaCl2溶液 B.FeCl2溶液 C.FeCl3溶液 D.Fe(NO3)3溶液
相关课件
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课文内容ppt课件,共1页。
这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物教学ppt课件,共20页。PPT课件主要包含了学习目标,Fe2O3,FeO等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物评优课ppt课件,共24页。PPT课件主要包含了铁的氧化物,铁的氢氧化物,本节重难点,红砖青砖知多少,FeO,Fe2O3,Fe3O4,黑色粉末,红棕色粉末,均不溶于水等内容,欢迎下载使用。









