

- 3.4 物质的量在化学方程式计算中的应用(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 3.4 物质的量在化学方程式计算中的应用(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 4.1 原子的组成与结构(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 4.2 元素周期表的结构(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 4.2 元素周期表的结构(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
人教版 (2019)必修 第一册第一节 原子结构与元素周期表课时练习
展开核心要点
1.了解元素、核素和同位素的含义。
2.了解原子的构成。
3.了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
能力构建
一、原子组成与结构
二、核素和同位素
1.核素
具有一定数目质子和一定数目中子的一种原子称为核素。氕、氘、氚这三种氢原子是氢元素的三种中子数不同的原子:(H)、(D)、(T),它们质子数相同(1个),核外电子数相同(1个),核内中子数不同。(H)核内无中子,(D)核内有1个中子,(T)核内有2个中子。、、核内质子数相同,所以它们属于同一种元素。
(1)每一种核素都是一种原子,不同的核素是不同的原子。由于许多元素有多种原子,所以原子种数远远大于元素种数。
(2)在天然元素中,有许多元素有多种核素,也有部分元素只有一种核素。
2.同位素
质子数相同而中子数不同的同一种元素的不同核素互为同位素。
(1) “同位”是指几种核素的质子数(即核电荷数)相同,在元素周期表中占据同一位置。
(2)同位素中的“同”含义广泛,包括质子数相同、电子数相同、元素符号相同等。
(3)同位素表明的是核素间的相互关系,显然互为同位素的不同核素属于同种元素。
(4)同一元素的各种同位素虽然质量数不同,但它们的化学性质基本相同。
(5)天然存在的某种元素里,不论是游离态还是化合态,各同位素所占的百分数一般是不变的,即是一个定值。
深化理解
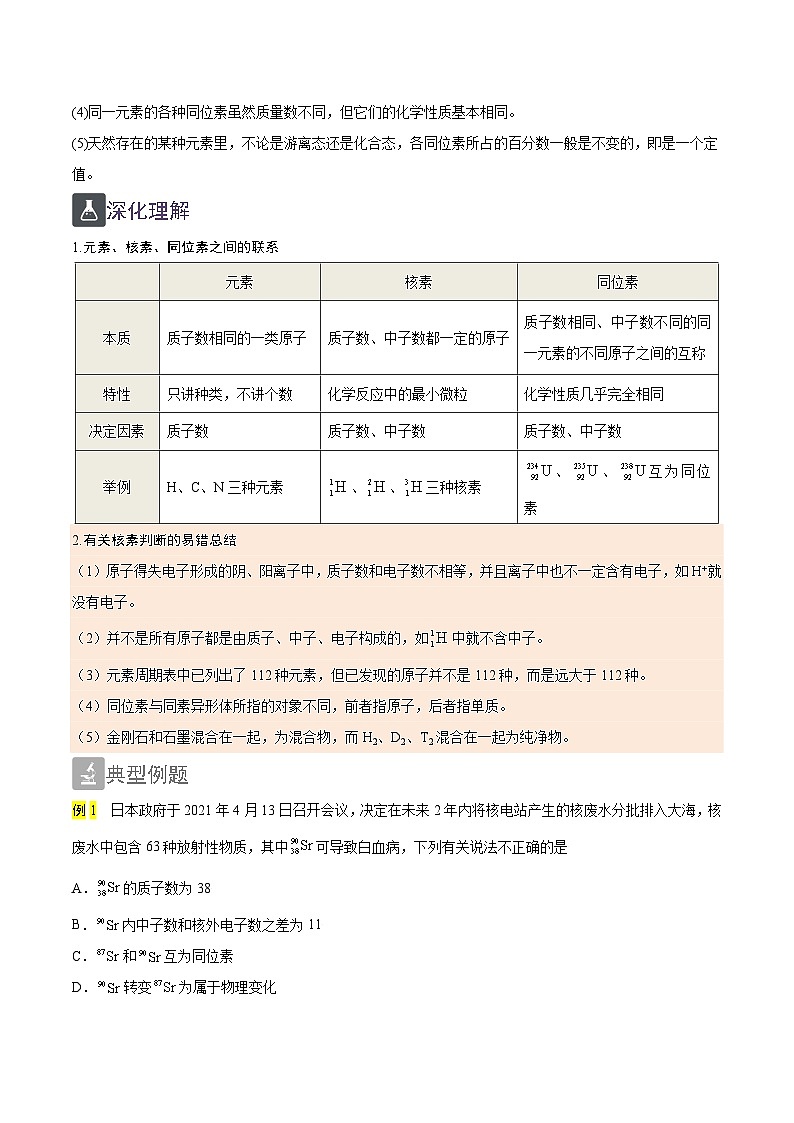
1.元素、核素、同位素之间的联系
2.有关核素判断的易错总结
(1)原子得失电子形成的阴、阳离子中,质子数和电子数不相等,并且离子中也不一定含有电子,如H+就没有电子。
(2)并不是所有原子都是由质子、中子、电子构成的,如中就不含中子。
(3)元素周期表中已列出了112种元素,但已发现的原子并不是112种,而是远大于112种。
(4)同位素与同素异形体所指的对象不同,前者指原子,后者指单质。
(5)金刚石和石墨混合在一起,为混合物,而H2、D2、T2混合在一起为纯净物。
典型例题
例1 日本政府于2021年4月13日召开会议,决定在未来2年内将核电站产生的核废水分批排入大海,核废水中包含63种放射性物质,其中可导致白血病,下列有关说法不正确的是
A.的质子数为38
B.内中子数和核外电子数之差为11
C.和互为同位素
D.转变为属于物理变化
【答案】B
【详解】
A.左下角表示质子数,则的质子数为38,A正确;
B.内中子数和核外电子数之差为90-38-38=14,B错误;
C.和的质子数相同,质量数不同,二者互为同位素,C正确;
D.转变过程是没有产生新物质,为属于物理变化,D正确;
答案选B。
例2 (已知原子M的原子核内有n个中子,M原子的质量数为A,则m g 中所含电子的物质的量是
A.B.
C.D.
【答案】C
【详解】
M原子的中子数为n,质量数为A,则其质子数为(A-n),则M2+离子的电子数为(A-n-2),m g M2+的物质的量为,则m g M2+中所含电子的物质的量为,答案选C。
例3 某简单微粒的结构示意图为,且x、y均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其他元素的原子反应,这种微粒的符号是___________。
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为___________。
(3)若该微粒为正一价阳离子,且对应的碱为可溶性强碱,则x=_______,y=_______。
(4)当x-y=10时,该粒子为___________(填“原子”“阳离子”或“阴离子”)。
(5)当y=8时,粒子可能为(填粒子符号)____、___、___、___、____。
【答案】Ar 19 8 原子 Ar Cl- S2- K+ Ca2+
【分析】
根据核外电子排布规律及元素性质分析元素的种类,根据核电荷与核外电子数目相对大小分析微粒的种类。
【详解】
(1) 依据题目所给的结构示意图可知,若微粒性质稳定,则为稀有气体Ar,故答案为:Ar;
(2) 若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,则该微粒是最外层电子数为7的氯原子,原子结构示意图为:;故答案为:;
(3) 若该微粒为正一价阳离子,且对应的碱为可溶性强碱,则该微粒是K+,其原子核内有19个质子,其离子最外层电子数为8,故答案为:19;8;
(4) 当x-y=10时,x=10+y,说明核内质子数等于核外电子数,所以该粒子应为原子,故答案为:原子;
(5) 当y=8时,应为18个电子的粒子,可能为氩原子、氯离子、硫离子、钾离子、钙离子等,故答案为:Ar;Cl-;S2-;K+;Ca2+。
学会了吗
1.据科学家预测,月球的土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以He的形式存在。下列说法正确的是
A.He原子核内含有4个质子
B.He和He为同一元素的不同核素
C.He原子核内含有3个中子
D.He的最外层电子数为2,所以He具有较强的金属性
【答案】B
【详解】
A.He原子核内含有2个质子,A错误;
B.He和He为同一元素的不同核素,B正确;
C.He原子核内含有3-2=1个中子,错误;
D.He的最外层电子数为2,是稳定结构,D错误;
故选B。
2.核内中子数为N的离子,质量数为A,则g它的氧化物()中所含质子的物质的量为
A.B.
C.D.
【答案】B
【详解】
核内中子数为N的R2+离子,质量数为A,则R原子的质子数是A-N;R氧化物的化学式是R18O,R18O的质子数为A-N+8;ng氧化物的物质的量是ml,则所含质子的物质的量为,故答案选B。
3.用X表示原子:
(1)中性原子的中子数N=_______
(2)写出表示含有8个质子,10个中子的原子的化学符号:_______
(3)AXn+共有x个电子,则该阳离子的中子数N=_______
(4)AXn-共有x个电子,则该阴离子的中子数 N=_______
(5)12C16O2分子中的中子数N=_______
(6)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_______
【答案】A-Z A-x-n A-x+n 22
【详解】
用X表示原子,A是质量数,Z是质子数,
(1)中性原子的中子数N= A-Z,答案为:A-Z;
(2)含有8个质子,10个中子的原子为氧元素的同位素原子,其质量数为18,其化学符号为:,答案为;
(3)AXn+共有x个电子,因为失去了n个电子,则AX原子的电子数为x+n,其中子数为N=A-x-n,答案为:A-x-n;
(4)AXn-共有x个电子,因为得到了n个电子,则AX原子的电子数为x-n,其中子数为N=A-x+n,答案为A-x+n;
(5)12C16O2分子中12C的中子数为6,16O的中子数为8,则12C16O2分子中的中子数N=6
+8×2=22,答案为22;
(6)A2-原子核内有x个中子,其质量数为m,则其质子数为m-x,而A原子又得到2个电子,所以A2-的电子总数为m-x+2,则n g A2-所含电子的物质的量为ml,答案为;
元素
核素
同位素
本质
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的同一元素的不同原子之间的互称
特性
只讲种类,不讲个数
化学反应中的最小微粒
化学性质几乎完全相同
决定因素
质子数
质子数、中子数
质子数、中子数
举例
H、C、N三种元素
、、三种核素
、、互为同位素
高中化学人教版 (2019)必修 第一册第二节 元素周期律同步练习题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t7/?tag_id=28" target="_blank">第二节 元素周期律同步练习题</a>,文件包含42元素周期表的结构精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版原卷版doc、42元素周期表的结构精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版解析版doc等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。
高中化学第一节 原子结构与元素周期表课后复习题: 这是一份高中化学<a href="/hx/tb_c161996_t7/?tag_id=28" target="_blank">第一节 原子结构与元素周期表课后复习题</a>,文件包含41原子的组成与结构精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版原卷版doc、41原子的组成与结构精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版解析版doc等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
化学必修 第一册第二节 氯及其化合物同步测试题: 这是一份化学必修 第一册<a href="/hx/tb_c161981_t7/?tag_id=28" target="_blank">第二节 氯及其化合物同步测试题</a>,共5页。试卷主要包含了检验Cl−的实验,检验Cl−的方法等内容,欢迎下载使用。













