






2024广西中考复习 通用版化学 教材基础复习 专项突破7:物质的共存、检验与鉴别、分离与除杂 课件
展开一、物质的共存1.共存的条件:组内物质均可溶,物质(即所含离子)之间不发生反应,即不会生成沉淀或气体或水。2.常见的不能共存的离子对:(1)生成水:H++OH-===H2O(2)生成气体和水H++__________===H2O+CO2↑ 2H++_________ ===H2O+CO2↑ __________+OH-===NH3↑+H2O
BaSO4、AgCl
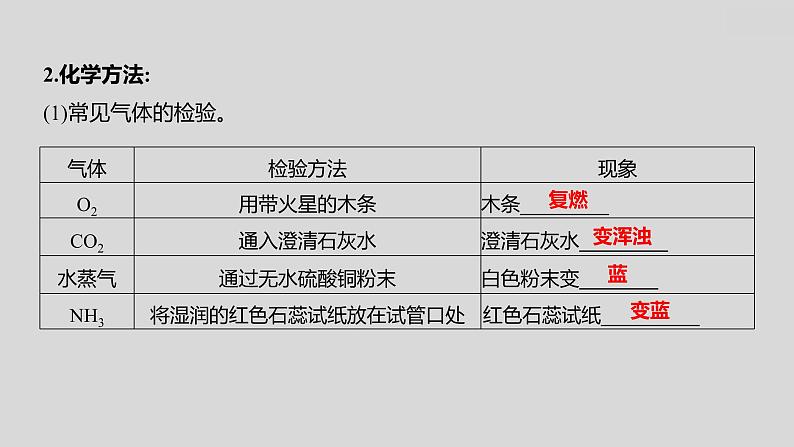
2.化学方法:(1)常见气体的检验。
注意 检验CO前要先除CO2,检验H2前要先除H2O。
(2)常见离子的检验。
产生有刺激性气味的气体,
三、物质的鉴别1.鉴别原则:用最简单的方法,最少的试剂和最明显的现象将物质区分开来。2.鉴别的思路:首先依据物质特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象等)进行观察、分析、判断,若用此方法仍不能鉴别出来,可利用物质的化学性质如可燃性、还原性、热稳定性及其他特性继续鉴别。
3.鉴别方法:Ⅰ.物理方法(1)看颜色:如含Cu2+的溶液呈蓝色,含Fe3+的溶液呈黄色,含Fe2+的溶液呈浅绿色等。(2)闻气味:如可用闻气味的方法区分白酒和白醋,白酒具有醇香味,而白醋具有酸味。(3)溶解性:如可用水区分氯化钙和碳酸钙,氯化钙能溶于水,而碳酸钙不溶于水。(4)溶解时的吸放热现象:如可用水区分硝酸铵固体和氢氧化钠固体,硝酸铵固体溶于水吸热,溶液温度降低,而氢氧化钠固体溶于水放热,溶液温度升高。(5)依据磁性区分:Fe(或Fe3O4)能被磁铁吸引,而FeO(黑色)不能。
Ⅱ.化学方法(部分以物理方法为基础)(1)加试剂鉴别。原理:选择一种或多种试剂,分别加入待测物质中,根据不同的现象鉴别。如可选用紫色石蕊溶液来鉴别HCl、CaCl2、NaOH溶液。(2)不加试剂鉴别。①特征现象法:利用物质的物理性质(如颜色等)不同,通过观察找到突破口,然后利用已鉴别出来的物质作为试剂将剩余物质连环鉴别出。【举例】不用任何试剂鉴别NaOH、Na2SO4、CuSO4、NH4Cl四种溶液。【分析】通过观察,蓝色的为CuSO4溶液,其余均为无色,再用鉴别出的CuSO4作为已知试剂,鉴别出其他物质,鉴别顺序为CuSO4→NaOH→NH4Cl→Na2SO4。
②两两混合法:当无法通过物理性质入手时,采用两两混合的方法,若各自能产生不同现象,便可加以区别。【举例】Na2SO4、Na2CO3、BaCl2、HCl,用两两混合反应的方法分析,通常采用列表的方法统计现象,见表:【分析】(注:表中“↑”表示产生气体,“↓”表示产生沉淀,“-”表示不反应或反应无明显现象)
③借助产物法:若用以上两种方法还不能将组内的一种或两种物质鉴别出来,可借用相关反应产物和酸反应加以鉴别(组内物质一般含有酸)。【举例】鉴别FeCl3、HCl、NaCl、NaOH四种溶液。【分析】HCl和NaCl溶液利用FeCl3与NaOH反应的产物Fe(OH)3来鉴别,能使沉淀溶解的是HCl溶液,不能使沉淀溶解的是NaCl溶液。
4.日常生活中一些常见物质的鉴别:
四、物质的分离1.原理:把混合物中的各成分分开,得到纯净的单一成分。2.常见物质的分离方法:
3.化学分离法:用物理方法无法分离的物质,可以使用化学反应进行分离。如分离氯化钙和氯化钠固体→加水溶解→加入足量碳酸钠溶液,过滤→
五、物质的除杂1.原理:除去混合物中的杂质,得到纯净物。2.除杂原则(主不减,杂不增,易分离):主不减→不能减少被提纯物质,加入试剂只与杂质反应;杂不增→除去杂质过程中,不能引入新杂质;易分离→分离简便易行,杂质应转化为气体、沉淀或水等易分离物质。剩余的除杂试剂与被提纯物质也易分离。
3.除杂试剂的选择:(1)被提纯物质和杂质均为气体【特别提醒】吸收气体的试剂若为液体,则最后需通过干燥剂除去水蒸气。除杂试剂的用量要适量或足量。
(2)被提纯物质和杂质均为固体
六、注意事项1.分离与除杂不同:分离:将混合物中各物质分开,要保留其中各种物质,且要恢复到原来的状态。除杂:需加入试剂除去杂质,被提纯物质必须恢复原状态且不能引入新杂质,具体要求:不增、不减、简便、安全、试剂易得、效果最好。2.分离除杂三原则:不增(不增加新杂质);不减(不减少主要成分);易分离(杂质转化为沉淀、气体等,易分离除去)。
3.明确除杂的几个优化原则:a.若同时有几种方法能除去杂质,则选用步骤简单、操作简便、除杂最干净的方法;b.应尽量选择既可除去杂质,又可增加主体物质量的方法,即“一举两得”;c.先考虑物理方法(如过滤、蒸发结晶、蒸馏、升华等),再用化学方法(如沉淀法、吸收法、转化法等)。
角度2 物质的检验与鉴别1.(2023·重庆中考B卷)鉴别是重要的实验技能。分别鉴别两组物质:①C、CuO ②稀H2SO4、Na2CO3溶液,都能选用的试剂是( )A.O2 B.NaOH溶液C.铁片D.稀H2SO4
2.(2023·宜昌中考)鉴别下列各组物质,所选试剂不正确的是( )A.硬水和软水——肥皂水B.黄铜和黄金——硝酸银溶液C.纯碱和烧碱——酚酞溶液D.氯化铵和氯化钾——熟石灰
3.(2022·黄石中考)物质的鉴别是重要的实验技能,下列方案正确的是( )
4.下列各组物质的溶液不用其他试剂无法鉴别的是( )A.H2SO4 NaCl Na2CO3 CaCl2B.HCl NaOH CuSO4 MgSO4C.NaNO3 HCl CaCl2 KOHD.Na2CO3 K2SO4 BaCl2 HCl
5.下列物质的检验、鉴别与除杂方法正确的是( )
6.(2023·南宁二模)已知某溶液中的溶质可能是HCl、K2CO3、H2SO4、CuCl2、NaCl溶液中的一种或几种,向该混合液中逐滴加入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示。下列说法中不正确的是( )A.该混合液中一定不含有H2SO4B.该混合液中一定有HCl和CuCl2,一定没有K2CO3C.F点溶液中的溶质一定有两种D.恰好完全反应时,消耗Ba(OH)2的质量为68.4 g
7.绿水青山就是金山银山,保护环境人人有责。(1)2018年第二十六届“世界水日”,我国的宣传主题是“实施国家节水行动,建设节水型社会”。下列用水方式,符合该主题的是__________(填字母序号)。 A.用淘米水浇花B.洗脸、刷牙时,不间断地放水C.及时修理坏的水龙头D.农业和园林改漫灌为喷灌或滴灌
(2)我国对江河的管理实施了河长制,某条河的附近有一硫酸厂,该厂的废水经处理后排放到此河流中。假如你是该河的河长,如何检验经处理后排放的废水中是否还含有硫酸根离子。检验方法是______________________________________________________________________________________________________________________________________________________________。
取少量处理后的河水样品于试管中,
滴加Ba(NO3)2溶液和稀HNO3,若有白色沉淀生成且白色沉淀不溶解,则废水
中还含有硫酸根离子;若无白色沉淀生成,则废水中不含硫酸根离子
8.(2022·抚顺中考)化学小组同学在老师的指导下,开展了以“物质的鉴别”为主题的学习活动。活动一:气体物质的鉴别【活动目的】鉴别空气与氧气【操作与结论】
活动二:固体物质的鉴别【活动目的】鉴别氢氧化钠与氯化钠【操作与结论】分别取少量固体于两个表面皿上,在空气中放置一会儿,观察到其中一种固体表面潮湿并逐渐溶解,该固体为______________,而表面无明显变化的为另一种固体。 【交流与讨论】经讨论后,小组同学认为只用水也可以鉴别两种物质,依据是氢氧化钠溶于水,溶液温度__________(填“升高”或“降低”),氯化钠溶于水,溶液温度无明显变化。
活动三:液体物质的鉴别【活动目的】鉴别稀硫酸与碳酸钠溶液【查阅资料】碳酸钠溶液呈碱性【实验操作】将两种溶液编号为甲溶液、乙溶液,并分别取样于两支试管中,分别滴加稀盐酸。
【实验现象】甲溶液中无明显现象,乙溶液中有气泡产生。【实验结论】甲溶液为____________,乙溶液为另一种溶液。 乙溶液中产生气泡的化学方程式为__________________________________。 【拓展延伸】下列物质还可以鉴别稀硫酸与碳酸钠溶液的是____(填字母)。 A.酚酞溶液 B.氧化铜 C.铜活动感悟:在进行物质鉴别时,首先要分析物质的组成、性质等,然后选择合适的方法进行实验,实验过程中必须产生____________________,最后才能达到物质鉴别的目的。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
角度3 物质的分离与除杂1.(2023·威海中考)下列除去物质中杂质(括号内为杂质)的方法不正确的是( )
2.(2023·南宁一模)除去下列物质中混有的少量杂质,所用试剂和操作方法均正确的是( )
3.(2023·南宁一模)分离、除杂、提纯和检验是化学实验的重要环节,下面实验设计能够达到目的的是( )
2024贵州中考一轮复习 人教版化学 技能提升专项训练四 物质共存、检验、鉴别、分离与除杂 课件: 这是一份2024贵州中考一轮复习 人教版化学 技能提升专项训练四 物质共存、检验、鉴别、分离与除杂 课件,共13页。PPT课件主要包含了CaCO3,NaOH等内容,欢迎下载使用。
中考化学一轮复习精品课件第18讲 物质的共存、检验与鉴别、除杂与分离(含解析): 这是一份中考化学一轮复习精品课件第18讲 物质的共存、检验与鉴别、除杂与分离(含解析),共60页。PPT课件主要包含了物质或离子的共存,OH-,例题精选,NaCl,习题精选,物质的除杂与分离,化学方法等内容,欢迎下载使用。
中考总复习化学第19讲 物质的共存、检验与鉴别、分离与除杂课件: 这是一份中考总复习化学第19讲 物质的共存、检验与鉴别、分离与除杂课件,共46页。PPT课件主要包含了复习指导航标,关键能力提升,必备知识精讲,核心素养创新等内容,欢迎下载使用。












